VEGF、MMP-9及TIMP-1在Rb患儿中的临床检测价值
2020-04-28周苗苗
周苗苗
(皖西卫生职业学院,安徽 六安 237005)
Rb主要来源于光感受器前体细胞,属于眼内恶性肿瘤之一,好发于3岁以下的婴幼儿,可单眼、双眼先后或者双眼同时罹患[1-3]。Rb患者的临床症状较为复杂,主要表现为水肿、结膜内充血、虹膜新生血管、角膜水肿、眼压升高、斜视及玻璃体混浊等[4]。Rb易出现远处或颅内转移现象,严重危及了患儿的身体健康及生命安全,故及早诊治Rb患儿可有效降低死亡率并改善其预后,提高治愈率[5-6]。MMP-9与多种恶性肿瘤的发生及病情进展关系密切,但在我国Rb组织中的表达水平的相关报道不多[7]。TIMP-1与MMP-9在神经母细胞瘤癌细胞侵袭及转移期间具有突出的拮抗作用,故联合检测TIMP-1与MMP-9可准确地显示出肿瘤细胞的侵袭转移方向,并为此类患者的针对性治疗方案的制定提供可靠的理论参考[8]。VEGF与肿瘤的血管形成相关,其在人体正常组织内及各种动物、肿瘤细胞株内均有表达,对肿瘤心血管的形成、生长及转移均具有一定的促进作用[9]。本研究旨在通过观察分析VEGF、MMP-9及TIMP-1在Rb患儿中的表达水平,以期探析上述三种指标在Rb患儿中的检测价值,给Rb患儿的临床诊治提供一定的理论依据。
1 资料与方法
1.1 研究对象分析2007年4月至2018年4月间在我院接受诊断治疗并手术切除的47例Rb标本。入选标准:(1)年龄4个月~5岁,临床资料完整者;(2)经临床检查确诊为Rb者,标本经福尔马林固定并包埋于石蜡中;(3)术前均未接受任何放化疗治疗。排除标准:(1)唐氏综合征患儿;(2)存在先天性心脏病合并症的患儿。根据菊形团排列情况,将入选者分为分化型(18例)和未分化型(29例)两组。本研究经我院医学伦理委员会批准,患者及其家属知情同意此次研究并签署相关知情同意书。
1.2 研究方法(1)主要试剂:广州深达生物制品技术有限公司生产的兔抗人VEGF多克隆抗体(产品编号SP0810)、美国SantaCruz公司生产的抗人MMP-9多克隆抗体(产品编号SC.6840)、武汉博士德公司生产的抗人TIMP-1多克隆抗体(产品编号BA1368)、上海博谷生物科技有限公司生产的苏木素、北京索莱宝科技有限公司生产的DAB显色剂。(2)VEGF、MMP-9及TIMP-1检测方法及结果判定标准:免疫组化PV6000二步法。采用PBS代替一抗作阴性对照,将已知阳性乳癌组织切片作本次研究的阳性对照。以细胞质或细胞膜内有明显棕黄色或黄色颗粒视作MMP-9和TIMP-1阳性着色,根据Shimizu评分标准对结果实施半定量积分评判:①0分:无阳性细胞数;②1分,阳性细胞数<1/3;③2分,阳性细胞数1/3~2/3;④3分,阳性细胞数>2/3。每张切片的阳性细胞着色情况判定标准为:①0分:无着色;②1分,黄色;③2分,棕黄色;④3分,棕褐色。阳性细胞数与阳性细胞着色情况的积分和可视作MMP-9和TIMP-1结果评判标准:0~2分,阴性(-);3分,弱阳性(+);4~5分,强阳性(++)[10]。以细胞质出现棕黄色颗粒状染色作为VEGF染色阳性标准,每张切片的阳性细胞染色强度评分标准:0分,阴性(-);1分,弱阳性(+);2分,中等阳性(++);3分,强阳性(+++),阳性细胞百分数评判标准:无阳性细胞,0分;≤25%阳性细胞,1分;26%~50%阳性细胞,2分;>50%阳性细胞,3分。阳性细胞染色强度与百分率的积分之和可视作VEGF阴阳性表达标准:0~2分,阴性(-);3~4分,弱阳性(+);5~6分,强阳性(++)[11]。
1.3 统计学方法采用SPSS 19.0软件处理与分析数据。定性变量以[n(%)]形式表示,组间比较采用卡方检验;定量变量以“均数±标准差”形式表示,组间比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 Rb患儿的组织学表现患儿眼部肿瘤细胞内存在大面积致密的核深染,且胞浆稀少,主要由较多呈核分裂相的小圆细胞组成,表现为巢状及梁状结构,有些区域可见花瓣状结构(真菊形团)和F-W菊形团。清晰可见广泛钙化及坏死的肿瘤细胞。见图1。

图1 RB组织形态学表现(HE×200)
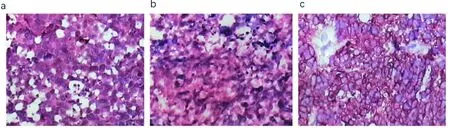
图2 MMP-9、TIMP-1、VEGF在RB中的表达
2.2 VEGF、MMP-9及TIMP-1的阳性表达在Rb患儿中VEGF、MMP-9及TIMP-1的阳性表达主要出现于肿瘤细胞质内,且呈棕黄色颗粒状。其中TIMP-1在成纤维细胞、血管内皮细胞上也呈阳性表达。检测结果显示,Rb患儿中VEGF的阳性表达率为68.1%(32/47);MMP-9的阳性表达率为55.3%(26/47);TIMP-1的阳性表达率为19.1%(9/47),提示Rb患儿TIMP-1的阳性表达率明显低于VEGF、MMP-9(P<0.05)。见图2。
2.3 VEGF、MMP-9及TIMP-1的阳性表达与Rb组织分化程度的关系分化型Rb组织内VEGF、MMP-9的阳性表达率明显低于未分化型(P<0.05);分化型与未分化型Rb组织内的TIMP-1阳性表达率无明显统计学差异(P>0.05)。见表1。

表1 VEGF、MMP-9及TIMP-1的阳性表达与Rb组织分化程度的关系
2.4 VEGF、MMP-9及TIMP-1阳性表达与Rb组织视神经浸润的关系存在视神经浸润者的VEGF及MMP-9阳性率明显较无视神经浸润者高(P<0.05);视神经浸润者与无视神经浸润者的TIMP-1阳性率无明显统计学差异(P>0.05)。见表2。

表2 VEGF、MMP-9及TIMP-1阳性表达与Rb组织视神经浸润的关系
2.5 Rb组织内VEGF、MMP-9及TIMP-1的关系相关性分析结果显示,Rb组织内TIMP-1与VEGF、MMP-9表达无显著相关性(r=0.234,0.147;P>0.05);VEGF与MMP-9存在显著正相关性(r=0.561;P<0.05)。见表3。

表3 Rb组织内VEGF、MMP-9及TIMP-1的关系
3 讨论
目前我国Rb患儿发生率呈显著上升趋势,严重影响了我国婴幼儿的身体健康及生命安全[12-13]。VEGF在所有血管生成促进因子中表现得最为突出,对血管内皮细胞生长及血管渗透性增强均具有促进作用,很多恶性肿瘤患者体内均存在VEGF表达,VEGF在肿瘤的发生发展及其浸润转移过程中均具有极其重要的促进作用[14]。Rb的侵袭转移过程较为复杂,癌细胞及其原发病灶脱落后必须突破细胞外基质(ECM)屏障,方可进入淋巴系统及血循环体系内向远处转移或向周围组织浸润[15]。基质金属蛋白酶(MMPs)为内源性蛋白水解酶,可降解ECM内各类蛋白成分,对肿瘤周围突破ECM屏障具有显著地促进作用,与肿瘤组织的转移及浸润关系密切[16]。金属蛋白酶组织抑制因子(TIMPs)为MMPs特异性抑制物,可有效阻碍MMPs降解ECM过程,对肿瘤组织的转移及侵袭具有明显地抑制作用。在ECM代谢过程中MMPs与TIMPs的相互作用在肿瘤细胞的转移及侵袭过程中扮演了重要角色[17]。
据报道,翼状胬肉组织内TIMP-1与MMP-2、MMP-9呈明显高表达状,特别是直接与Bowman层相邻的上皮细胞,其免疫染色能力更强[18]。另有学者发现,MMPs参与了糖尿病角膜的病变过程[19]。相关研究结果显示,Rb肿瘤组织内TIMPs表达下调、MMPs表达上调,所有细胞的TIMP-1与TIMP-2染色基本均呈阴性,大量肿瘤细胞内MMP-2、MMP-7、MMP-9染色均为阳性[20]。本研究结果显示,分化型Rb组织内MMP-9的阳性表达率明显低于未分化型(P<0.05);分化型与未分化型Rb组织内的TIMP-1阳性表达率无明显统计学差异(P>0.05),考虑原因可能是MMP-9可降解细胞外基质中的Ⅳ及Ⅴ型胶原等成分,打破基底膜,并清除细胞瘤浸润及转移中的首要障碍,且视网膜母细胞瘤侵袭及转移过程中MMP-9与TIMP-1具有拮抗作用。此外,存在视神经浸润者的MMP-9阳性率明显较无视神经浸润者高(P<0.05);视神经浸润者与无视神经浸润者的TIMP-1阳性率无明显统计学差异(P>0.05),Rb组织内TIMP-1与VEGF、MMP-9表达无显著相关性(P>0.05),说明Rb肿瘤细胞内TIMP-1与MMP-9表达失衡,在Rb组织的分化及肿瘤浸润过程中高表达的MMP-9具有重要的促进作用,Rb组织内的新生血管的生成与TIMP-1无关。此外,分化型Rb组织内VEGF的阳性表达率明显低于未分化型(P<0.05),存在视神经浸润者的VEGF阳性率明显较无视神经浸润者高(P<0.05),Rb组织内VEGF与MMP-9存在显著正相关性(P<0.05),说明MMP-9可以上调VEGF阳性表达,VEGF对肿瘤新血管的形成具有明显地促进作用,有助于Rb组织内形成新生血管,在细胞瘤的生长转移过程中发挥了重要作用。
总之,高表达状的VEGF与MMP-9在Rb患儿肿瘤细胞的分化及其视神经浸润过程中发挥了重要作用,且对其新生血管的形成起一定的促进作用,为临床Rb患儿的诊治提供了一定的理论依据。
