环磷酰胺对乳腺癌增殖、迁移和凋亡的影响及其机制
2020-04-28张腊梅李子涛刘建廷李彩娟
张腊梅,李 竹,李子涛,袁 琳,刘建廷,李彩娟
(1.牡丹江医学院;2.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011)
乳腺癌是一个日益严重的公共卫生问题,虽然早期治疗能够有效降低乳腺癌死亡率,但转移仍是癌症相关死亡的重要原因[1-2]。乳腺癌转移是由多重化学变化引起的,如组织固有性降低、细胞外基质和基底膜结构下降,蛋白水解增加等[3]。MMP9的表达与乳腺癌的侵袭和转移相关[4]。本研究分析CTX对乳腺癌MCF-7细胞的增殖、迁移及细胞凋亡的影响,并进一步研究CTX对MMP9表达的影响,为深入研究乳腺癌治疗的分子机制奠定基础。
1 材料和方法
1.1 材料CTX购自于Sigma公司(C0768MSDS);DMEM培养基、胰蛋白酶-EDTA消化液、购自于美国hyclone公司;胎牛血清购自于杭州四季青公司;Trizol ReagenT购自于Invitrogen公司;MMP9、β-actin引物由南京abm公司合成;反转录试剂盒、2×Taq PCR MasterMix、琼脂糖购自于北京阳光思特生物科技有限公司;TUNEL细胞凋亡检测试剂盒购自碧云天生物技术有限公司。
1.2 数据库资料MMP9基因的表达数据来自GEPIA数据库,该数据库中的肿瘤和正常样品来自于癌症基因组图谱(TCGA)和基因型组织表达(GTEx)项目,包含9736种肿瘤样本和33种癌症类型。通过GEPIA数据库分析MMP9在癌中的表达差异;Kaplan-Merier数据库分析MMP9与乳腺癌总生存率相关性。
1.3 细胞培养及药物处理人乳腺癌细胞MCF-7受赠于哈尔滨医科大学(细胞源于美国ATCC细胞库),培养于含体积分数10%FBS(胎牛血清)的DMEM高糖培养基中,置于湿度95%、5%CO2、37℃细胞培养箱中培养。细胞融合度达80%~90%,且状态良好,即可进行传代培养。根据CTX浓度设为1个对照组(0mmol/L),3个实验组(5mmol/L、10mmol/L、15mmol/L)。
1.4 MTT检测MCF-7细胞增值活性将MCF-7细胞按5×103个细胞/mL接种于96孔板,每孔100L,设5个重复孔。细胞铺满后,弃去旧培养基,实验孔加入不同浓度CTX(5mmol/L、10mmol/L、15mmol/L)的细胞培养液100μL,同时设置调零孔、对照组,分别培养24h、36h、48h后每孔分别加入20μL MTT溶液(5mg/mL),继续培养4h。每孔分别加入150μL DMSO,震荡器震荡10min。在酶标仪上选择490nm波长测定光密度(OD)值。
1.5 细胞划痕修复实验MCF-7细胞接种于6孔板,待细胞密度达到80%~90%后,在6孔板内垂直划痕,PBS冲洗细胞表面3次,分别加入含不同浓度CTX的培养液继续培养24h。对照组给予同等不含药物的完全培养基。分别在划痕后0h、24h于显微镜下观察划痕区的变化,标记并拍照。计算划痕愈合率%=[划痕宽度(初始时间)-划痕宽度(检测时间)]/划痕宽度(初始时间)×100%。
1.6 RT-PCR检测MMP9基因表达情况收集4组MCF-7细胞后,Trizol试剂盒提取细胞总RNA,检测细胞浓度和纯度后,按照反转录试剂盒说明书合成cDNA。MMP9上游引物5’-TGTACCGCTATGGTTACACTCG-3’,长度22bp;下游引物5’-GGCAGGGACAGTTGCTTCT-3’,长度19bp;β-actin内参上游引物5’-GATTCCTATGTGGGCGAC-3’,长度18bp;内参下游引物5’-TTGTAGAAGGTGTGGTGCC-3’,长度19bp。扩增反应条件:94℃预变性3min;94℃变性30s,60℃退火30s,72℃延伸30s,共35个循环;最后72℃终延伸10min。取5μL PCR终产物行1%琼脂糖凝胶电泳,检测基因相对表达量。
1.7 TUNEL法检测细胞凋亡率MCF-7细胞长满到90%,胰酶消化细胞,收集于15 mL离心管,离心5min,加入培养基使细胞被吹打成细胞悬液,每孔1mL,接种于铺有爬片的6孔板内,放5%CO2培养箱培养。贴壁细胞融合度达到80%~90%时,给予不同浓度CTX,继续孵育24h。参照Tunel试剂盒进行固定、漂洗、Tunel反应液及染色。用激光共聚焦显微镜进行拍照。每张切片随机选取5个视野(×100),计数凋亡细胞和总细胞,计算细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.8 统计学方法实验数据进行统计学分析,计量资料经正态性检验符合正态分布,以“均数±标准差”表示,采用t检验,组间比较用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 MMP9基因表达规律及预后分析MMP9基因在乳腺癌(BRCA)中高表达,见图1A。Kaplan-Meier分析表明,MMP9基因高表达组患者的总体生存率低于MMP9低表达组,见图1B。

图1 MMP9基因表达和预后情况
注:图1A:MMP9在乳腺癌中的表达情况;图1B:MMP9高表达的乳腺癌患者总体生存率低于MMP9低表达患者

图2 MTT检测CTX对MCF-7细胞增殖活性的影响
2.2 MTT法筛选出药物浓度及其对细胞增殖的影响MTT结果显示,与对照组(0mmol/L)相比,CTX(5mmol/L、10mmol/L、15mmol/L)处理MCF-7细胞24h、36h、48h后均能显著抑制细胞的增殖水平,且随着时间的增加而呈剂量依赖性,见图2。
2.3 CTX对MCF-7细胞迁移能力的影响CTX作用于MCF-7细胞0h、24h后,在倒置显微镜下观察细胞的迁移情况。显微镜下结果显示,与对照组相比,实验组(5mmol/L、10mmol/L、15mmol/L)的迁移能力随着药物剂量的增加而降低,见图3。

图3 划痕实验检测CTX对MCF-7细胞迁移的影响(×100)
2.4 CTX对MCF-7增殖和凋亡的影响激光共聚焦显微镜结果显示,细胞凋亡率对药物剂量增加而增加,见图4。

图4 TUNEL实验检测CTX对MCF-7细胞增殖凋亡的影响(×100)
2.5 CTX对MMP9mRNA表达的影响RT-PCR结果显示,MMP9的表达水平随着CTX剂量的增加而降低,且差异有统计学意义(P<0.01),见图5。
3 讨论
乳腺癌是女性最常见的恶性肿瘤。尽管积极的治疗策略和早期发现方法取得了进步,但肿瘤复发[5]仍然是乳腺癌患者与癌症相关的死亡的主要原因。通常复发的肿瘤通常更具侵袭性,具有高转移潜力,并且会对其治疗产生耐受性,最终导致不良的预后。因此有效识别与这些现象相关的生物学事件和分子靶标将有助于改善治疗和预后[6]。
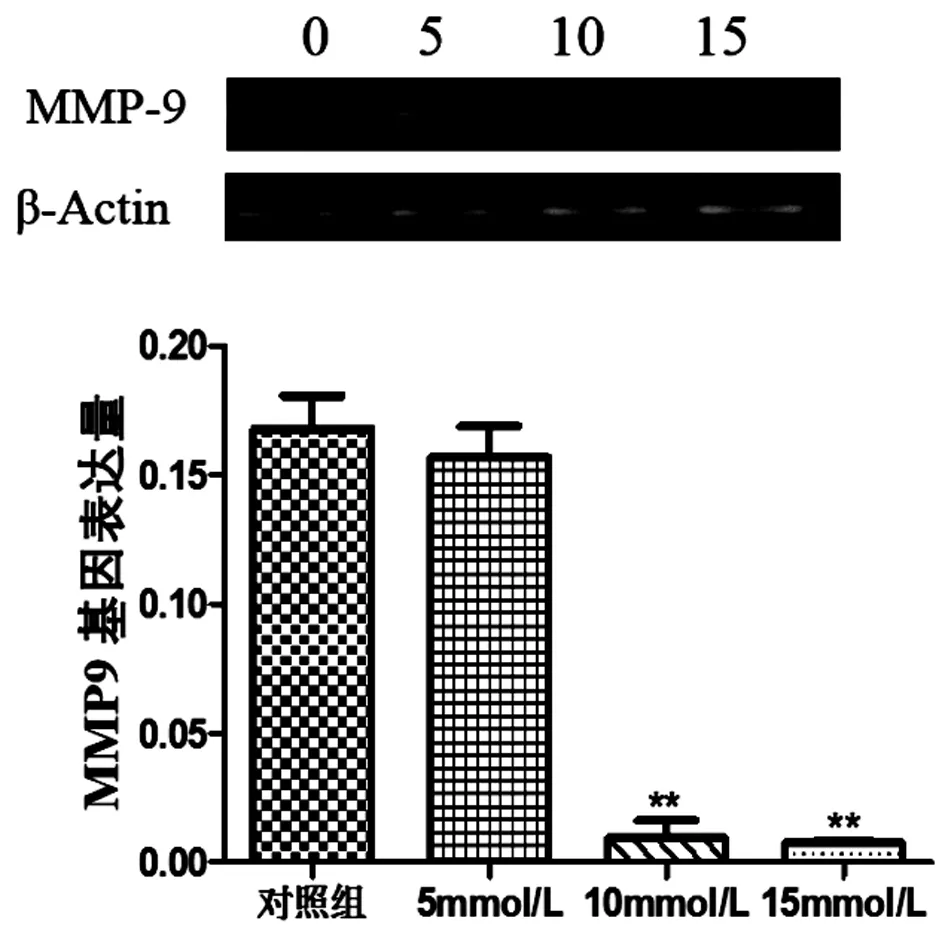
图5 RT-PCR检测CTX对MCF-7细胞的影响
MMP9常在不同的恶性肿瘤中表达。许多研究已经探索了MMP9作为不同类型癌症的生物标志物。MMP9主要通过细胞外基质(ECM)的降解(例如,I型、II型和IV型胶原)、上皮细胞向间充质细胞的转化和侵袭而导致多种肿瘤类型的细胞过程[7]。MMP9表达的增加与侵袭性表型和乳腺癌[8]、卵巢癌[9]、鼻咽癌[10]和胃癌[11]预后不良有关。MMP9在肿瘤细胞中的高表达与较高的淋巴结转移率[12-13]和远处转移率[14]以及较差的无复发生存率[15-16]有关。这表明,MMP9的表达具有肿瘤和组织特异性,可在不同的肿瘤类型中发挥不同的功能。基于GEPIA数据库结果提示,乳腺癌中MMP9的表达明显高于正常组织中的表达。与乳腺癌癌旁组织相比,MMP9高表达的乳腺癌患者预后有着较短的生存率,这与前面一些学者的研究结果相一致。为进一步阐述CTX在乳腺癌治疗中的作用机制,用不同浓度CTX处理MCF-7细胞后,采用MTT法、TUNEL法分别检测MCF-7细胞生长活性、凋亡。结果表明,CTX能够抑制MCF-7细胞生长并促进细胞凋亡,且随着药物剂量的增大,抑制效果加强。这说明CTX在乳腺癌细胞生长进程中,和促进细胞凋亡方面发挥着抑制作用。
致癌的几个重要过程,包括侵袭、转移和血管生成与细胞外微环境有关,MMP9降解细胞外基质蛋白、改变细胞间与细胞外基质的连接、裂解细胞表面蛋白和细胞外环境,促进乳腺癌侵袭和转移[17-20],本研究探索了CTX在乳腺癌迁移中的作用,用划痕实验检测MCF-7细胞迁移情况,结果显示,实验组的MCF-7迁移细胞量低于对照组的细胞量,提示CTX能够抑制乳腺癌的迁移。通过PCR检测MMP9mRNA的表达变化,结果发现,与对照组相比,实验组的MMP9mRNA的表达低于对照组,提示CTX可以下调MMP9的表达水平。因此,我们推测CTX可能通过下调MMP9,发挥抑制MCF-7细胞的迁移的作用。
综上所述,CTX能够抑制MCF-7细胞增殖、迁移,促进细胞凋亡,并且抑制MMP9基因在乳腺癌中的表达,改善患者的预后。但CTX具有一定的毒副作用,在乳腺癌治疗中的具体分子机制有待进一步的深入研究。
