抑癌基因ID4、WT1、GLIPR1启动子区异常甲基化在白血病患者中的表现
2020-04-28刘晓丹
刘晓丹,陈 琛
(滨州医学院附属医院1.血液科;2.心内科,山东 滨州 256600)
甲基化是蛋白质和核酸的一种重要的修饰,调节基因的表达和关闭,也是表观遗传研究的前沿领域。研究显示[1]:脱氧核糖核酸(deoxyribonucleic,DNA)异常甲基化与肿瘤发生密切相关,尤其抑癌基因启动子异常高甲基化及DNA的广泛低甲基化可能为血液系恶性肿瘤发生的重要分子机制。本研究选择ID4、WT1、GLIPR1三个白血病抑癌基因,着重于研究ID4、WT1、GLIPR1抑癌基因甲基化及基因表达水平并分析抑癌基因ID4、WT1、GLIPR1启动子区异常甲基化在白血病发病的作用机制,为白血病基因水平的防治提供临床指导。
1 资料与方法
1.1 研究对象选取2016年1月至2019年1月本院确诊为初发白血病患者67例作为本次研究的白血病组,其中男44例,女23例,年龄17~46岁,平均(31.3±8.5)岁,包括:急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)27例、急性髓系白血病(Acute myeloid leukemia,AML)19例以及慢性粒细胞白血病(Chronic myeloid leukemia,CML)21例,白血病诊断及分型符合FAB诊断及标准;以同期43例非肿瘤性疾病自愿者为对照组,男28例,女15例,年龄15~45岁,平均(33.1±10.7)岁,包括:巨幼细胞性贫血13例、缺铁性贫血20例,血小板减少性紫癜10例。两组研究对象在性别、年龄构成具有可比性(P>0.05),受试者均签署知情同意书,享有知情权。
1.2 研究方法
1.2.1 材料准备 受试者肝素抗凝于髂前上棘取骨髓液3mL,对单个核细胞行基因组DNA提取、纯化,试剂使用日本宝生物公司产品,分光光度计鉴定提取质量,稀释物理剪切,加NaOH 37℃孵育25min,加氢醌及亚硫酸氢钠混合均匀55℃孵育16h后纯化备用。
1.2.2 PCR方法 抑癌基因ID4、WT1、GLIPR1启动子区甲基化状态采用甲基化特异性PCR(Methylation-specific PCR,MS-PCR)检测,甲基化特异性引物:
ID4-MF:5'-TTTTATAAATATAGTTGCGCGGC-3’;ID4-MR:5'-GAATATCCTAATCACTCCCTTCGA-3’;
WTl-MF:5'-TTTGGGTTAAGTTAGGCGTCGTCG-3’:WTl-MR:5’-ACACTACTCCTCGTACGACTCCG-3’;
GLIPRl-MF:5’-TAATTATATTTTTAGAAATTGCGGC-3’:GLIPRl-MR:5'-ACTATTAATTTCACCTCTAATCGAA-3’;
RT-PCR扩增反应条件如下:ID4:94℃预变性4min;94℃(30s)→45℃(30s)→72℃(45s)共30个循环,72℃延伸(7min);WTl:94℃预变性4min;94℃(45s)→58℃(30s)→72℃(45s)共40个循环,72℃延伸7min;GLIPRI:94℃预变性5min;94℃(30s)→45℃(30s)→72℃(45s)共30个循环,72℃延伸(7min)。
抑癌基因mRNA的表达检测采用RT-QPCR检测,RT逆转录试剂盒使用宝生物工程有限公司,从珠江医院购买人急性髓系细胞白血病细胞株HL-60及慢性粒细胞白血病细胞株K562,RPMI1640培养液37℃,5%CO2培养传代,取对数生长期细胞用于实验。使用日本宝生物公司RNAiso PLUS试剂盒提取RNA,行紫外分光光度计检测OD值,RT-QPCR定量检测抑癌基因mRNA表达情况。
ID4:上游引物:5'-TCACTGCGCTCA ACACCGACCC-3’;下游引物:5'-TTCCCCCT CCCTCTCTAGTGCTCCTG-3’;WTl:上游引物:5'-GATAACCACACA ACGCCCATC-3’;下游引物:5’-CACACGTCGCACATCCTG AAT-3’;GLIPRI:上游引物:5’-AATAGCCTGGATGGTTTCTT-3’;下游引物:5’-CATAGTCCTGGATTTCGTCA-3’;反应条件:ID4扩增反应条件:94℃预变性(4min)进入循环→94℃(30s)→60℃(30s)→72℃(45s)共40个循环;72℃延伸(7min);WTl扩增反应条件:94℃预变性(4min)进入循环→94℃(45s)→55℃(45s)→72℃(45s)共30个循环;72℃延伸(7min);GLIPRI扩增反应条件:94℃预变性(5min)进入循环→94℃(30s)→49℃(30s)→72℃(45s)共30个循环;72℃延伸(8min)。
1.3 统计学处理采用统计学软件SPSS 22.0对研究数据进行统计学分析,使用卡方检验比较抑癌基因ID4、WT1、GLIPR1基因启动子区甲基化百分比、率,抑癌基因mRNA表达以2-▲Ct表示,抑癌基因mRNA均值比较采用方差分析,组间两两比较采用SNK法分析,以P<0.05有统计学意义。
2 结果
2.1 两组抑癌基因ID4、WT1、GLIPR1启动子区甲基化情况两组抑癌基因ID4、WT1、GLIPR1启动子区甲基化经卡方检验分析均有统计学差异(P<0.05),白血病组ID4、GLIPR1基因启动子区甲基化程度均高于对照组,抑癌基因WT1低于于对照组,差异均有统计学意义(P<0.05)。见表1。
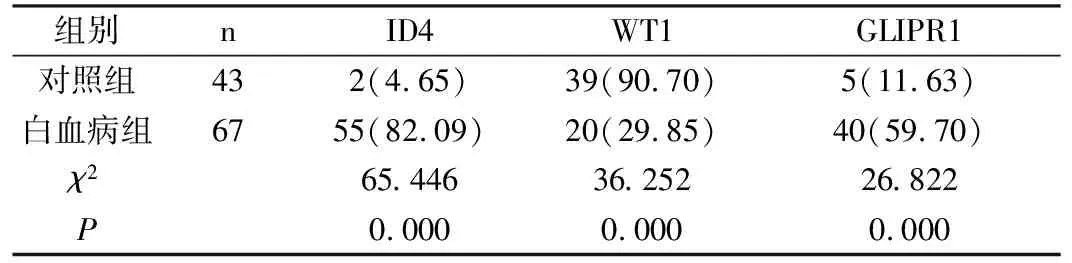
表1 两组抑癌基因ID4、WT1、GLIPR1启动子区甲基化情况[n(%)]
2.2 AML、ALL、CML与对照组抑癌基因ID4、WT1、GLIPR1 mRNA表达比较AML、ALL、CML与对照组抑癌基因ID4、WT1、GLIPR1 mRNA表达比较经方差分析均有统计学差异(P<0.05),AML、ALL、CML抑癌基因ID4、GLIPR1mRNA表达均低于对照组,抑癌基因WT1mRNA表达高于对照组,差异均有统计学意义(P<0.05),AML、ALL、CML三组抑癌基因ID4、WT1 mRNA表达组间比较,无统计学差异(P>0.05),GLIPR1mRNA表达任意组间均有统计学差异(P<0.05)。见表2。

表2 AML、ALL、CML与对照组抑癌基因ID4、WT1、GLIPR1 mRNA表达比较
3 讨论
随着现代表观遗传学的发展,人们对肿瘤发生机制有了新的认识。一些表观遗传修饰虽未影响DNA双链序列,但其基因的表达发生了较大程度改变。表观遗传的调控方式常见包括:组蛋白共价修饰,DNA甲基化,染色质的高级结构。DNA甲基化在表观遗传调控机制研究较早,也较为深入。DNA序列上特定的碱基在DNA甲基转移酶(DNMT)的催化作用下,以共价键结合甲基供体s-腺苷甲硫氨酸(SAM)。研究发现[2]:细胞中DNA高甲基化出现在抑癌基因的启动子区可抑制抑癌基因的表达,致使细胞生长调控失衡从而导致肿瘤的发生。也有临床研究证明[3]:在肿瘤细胞中普遍存在DNA甲基化酶活性过高的情况。作为血液系常见的恶性肿瘤,白血病源于造血干细胞恶性克隆。增殖失控、分化障碍、凋亡受阻的病变细胞在骨髓和其他造血组织中大量累积、浸润抑制正常造血。研究白血病发病的分子机制与抑癌基因甲基化的关系具有重要的临床意义,其为白血病的去甲基化治疗新思路提供了理论基础。
抑癌基因ID4又称分化抑制因子4,位于人染色体6p 21.3~22,为碱性螺旋环螺旋转录因子的抑制因子,可抑制碱性转录因子活性,ID4可抑制细胞的分化及DNA结合,参与细胞分化、增殖、凋亡,另有研究发现其与肿瘤形成、侵袭及转移有关[4]。WT1基因最初分离于Wilms瘤细胞,定位于人染色体11p13,其编码产物对细胞G0及G1期转入S期有较强的抑制作用[5]。GLIPR1基因克隆于人胶质细胞瘤为髓系单核细胞分化的标志,其功能涉及细胞凋亡与免疫防御,研究发现[6-7]:GLIPR1基因过表达可诱导肺癌、结直肠癌及前列腺癌细胞凋亡,具有抑制肿瘤细胞作用,为机体的抑瘤基因。有学者认为[8]:GLIPR1基因为AML的甲基化沉默基因,对其mRNA蛋白表达水平的监测及患者的临床疗效的评价具有指导作用。本研究数据显示:AML、ALL、CML抑癌基因ID4、GLIPR1基因启动子区甲基化程度及其mRNA表达均低于对照组,而抑癌基因WT1则在AML、ALL及CML中呈现低甲基化,其编码产物mRNA呈现高表达,与对照组比较差异均具有统计学意义,考虑原因主要是DNA甲基化是基因表达调控的重要机制之一,该项检测对肿瘤恶性程度的判断具有重要意义,低甲基化伴随mRNA表达增高,可以有效反应肿瘤恶性程度及进展情况,具有重要的临床意义,且抑癌基因WT1在白血病的发生发展过程中起着非常重要的作用。基因甲基化导致转录沉默缺失是多种肿瘤发生的分子机制[9]。基因启动子区甲基化可负性调控相关mRNA的表达,甲基化状态与mRNA蛋白表达水平呈现一定的负相关[10]。本研究数据支持上述观点,抑癌基因启动子区甲基化程度也是监测白血病病情严重程度的一个可能观察指标[11]。
抑癌基因启动子区甲基化为抑癌基因表达下调及缺失的重要机制,同时也是可能引起白血病发生的重要机制之一,目前基于抑癌基因启动子区甲基化的白血病基因诊断、治疗仍处于起步阶段[12],抑癌基因启动子区甲基化及其蛋白表达的研究对白血病发病的分子机制研究开辟了新的领域,在基因水平为白血病的治疗及预后评估提供了新的发展方向。
