透骨消痛胶囊对膝骨关节炎大鼠软骨下骨Wnt/β-catenin信号通路的影响
2020-04-27闫沛春陈长兴陈剑丁怀利李民
闫沛春 陈长兴 陈剑 丁怀利 李民


【摘 要】目的:探讨透骨消痛胶囊对膝骨关节炎大鼠软骨下骨Wnt/β-catenin信号通路表达的影响。方法:将60只SD大鼠随机分为空白对照组、模型对照组、透骨消痛胶囊组,每组20只。除空白对照组外,其余大鼠采用改良Hulth法建造膝骨关节炎模型。空白对照组、模型对照组给予生理盐水灌胃,透骨消痛胶囊组给予10 mg·mL-1透骨消痛胶囊溶液灌胃。干预后,置于麻醉下取材,经RT-PCR、Western Blot分别检测软骨下骨中Wnt4、GSK-3β、β-catenin mRNA与蛋白含量变化。结果:RT-PCR、Western Blot结果显示,与空白对照组比较,模型对照组大鼠软骨下骨中Wnt4、GSK-3β、β-catenin mRNA与蛋白含量表达显著升高(P < 0.01);与模型对照组比较,透骨消痛胶囊组大鼠软骨下骨中Wnt4、GSK-3β、β-catenin mRNA与蛋白含量表达显著降低(P < 0.01或P < 0.05)。结论:透骨消痛胶囊可通过调控改良Hulth法制备的膝骨关节炎大鼠模型软骨下骨中Wnt4、GSK-3β、β-catenin mRNA与蛋白含量表达,从而延缓膝骨关节炎软骨下骨硬化。
【关键词】 骨关节炎,膝;软骨下骨;透骨消痛胶囊;Wnt/β-catenin信号通路;大鼠
【ABSTRACT】Objective:To investigate the effect of Tougu Xiaotong Jiaonang(透骨消痛胶囊)on the expression of signal molecules related to Wnt/β-catenin pathway in subchondral bone of knee osteoarthritis rats.Methods:Sixty SD rats were randomly divided into a blank control group,a model control group and a Tougu Xiaotong Jiaonang group,with 20 rats in each group.The knee osteoarthritis rat models were established with rats other than the blank control group with the modified Hulth method.Rats in the blank control group and the model control group were given normal saline,while those in the Tougu Xiaotong Jiaonang group were given 10 mg·mL-1 of Tougu Xiaotong Jiaonang solution.After intervention,the samples were taken under anesthesia.The content of Wnt4,GSK-3β,β-catenin mRNA and protein in subchondral bone were detected by RT-PCR and Western Blot.Results:RT-PCR and Western Blot showed that compared with the blank control group,the expression of Wnt4,GSK-3β,β-catenin mRNA and protein in the subchondral bone of the model control group was significantly increased(P < 0.01);while those in the the model control group was significantly decreased(P < 0.01 or P < 0.05).Conclusion: Tougu Xiaotong Jiaonang can regulate the expression of Wnt4,GSK-3β,β-catenin mRNA and protein in subchondral bone of knee osteoarthritis rat model prepared by modified Hulth method,so as to delay the subchondral osteosclerosis of knee osteoarthritis.
膝骨關节炎(knee osteoarthritis,KOA)是一种多发于中老年患者的慢性关节疾病,其主要特征包括膝关节软骨退行性改变、关节间隙变小、软骨下骨厚度增加、骨赘形成、滑液成分改变等表现[1]。其中促使关节退变加剧主要是生物因素和力学因素的异常改变[2],两者的共同作用导致了软骨细胞、细胞外基质、软骨下基质三者降解和合成失衡,最终形成一种慢性、进展性的关节疾病[3]。KOA发病的危险因素包括年龄、性别、体质量等[4],但具体发病机制目前尚未完全阐明。当前研究显示,软骨下骨的异常变化与软骨下骨的硬化及KOA的发生、发展具有重要相关性[5]。而KOA软骨下骨硬化,属于中医学“膝骨痹”范畴,其最主要的病机是“本痿标痹”“本虚标实”,故其治则为温肾补阳柔肝、活血祛风除湿[6]。透骨消痛胶囊是福建中医药大学附属第二人民医院的院内制剂(批准文号:闽制字Z20100006),由巴戟天、杭白芍、川芎和肿节风组成,具有温补肾阳、养血敛肝、活血行血、化湿祛风的功效,临床上治疗KOA具有较好的效果[7-8]。从药物功效来看,巴戟天补肾助阳、祛风除湿,白芍缓急止痛、养血柔肝,川芎、肿节风祛风通络。诸药合用,使邪去痹除,肝肾同健,气血充养,邪正兼顾,发挥了“从本治痿,从标治痹”作用,切中KOA的病因病机,对其治疗具有一定疗效。
2.4 Western Blot 检测软骨下骨中Wnt4、GSK-3β、β-catenin蛋白含量表达 取出待检各组大鼠软骨下骨组织,提取各组总蛋白,BCA法进行蛋白定量,精确添加相关试剂。首先配制体积分数为12%的下层胶(分离胶),利用蒸馏水重力施压胶面确保同水平面后,待其凝固后吸净上层蒸馏水;再配制体积分数为5%的上层胶(浓缩胶)予以灌板,同时迅速插入梳子,待其完全凝固拔出梳子备用;然后以每孔20 μg进行上样,后依次经电泳(前10 min调至20 V电压,后于50 V电压下运行30 min,然后设置100 V电压跑至胶底)、转膜(电流为1.3 A、电压25 V)、封闭;再将各条膜放入提前配制完毕的Wnt4(1 μg·mL-1)、GSK-3β(1∶5000)、β-catenin (1∶4000)、β-actin(1∶1000)待检指标的一抗反应袋中,转移至低温环境(4 ℃),在振荡摇床匀速作用下,反应过夜,进行充分一抗孵育;后转移至二抗(羊抗兔,浓度为1∶5000)反应袋中,使其发生抗体结合反应,标记并扩大一抗信号;后将各条待检膜带置于高敏ECL显影液中反应,经曝光成像(凝胶成像仪),得出数据进行保存、分析。
2.5 统计学方法 采用SPSS 19.0软件进行统计分析。计量资料以表示,2组间比较采用t检验与单因素方差分析;计数资料采用χ2检验。以P < 0.05为差异有统计学意义。
3 结 果
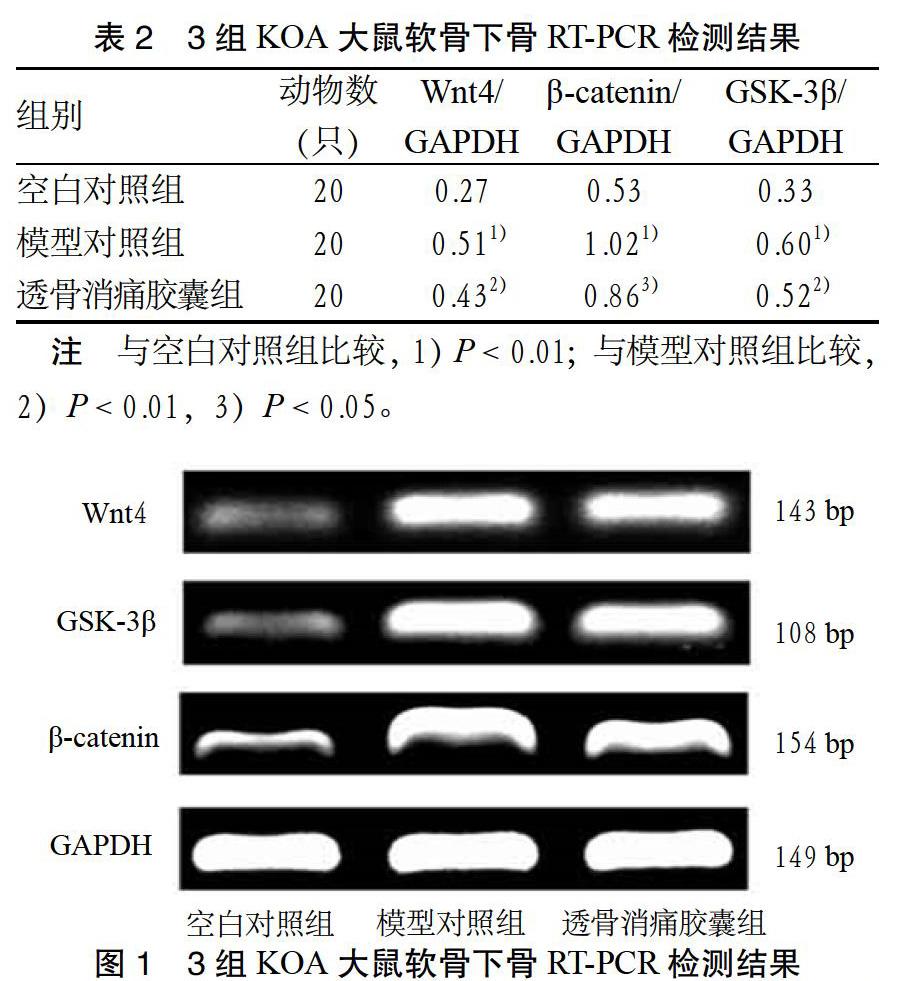
3.1 RT-PCR检测结果 RT-PCR结果显示,透骨消痛胶囊作用于KOA大鼠软骨下骨后,可下调Wnt4、GSK-3β、β-catenin mRNA含量表达。与空白对照组比较,模型对照组Wnt4、GSK-3β、β-catenin mRNA含量表达显著升高,差异有统计学意义(P < 0.01),提示KOA大鼠关节软骨下骨发生一定程度的退变。与模型对照组比较,透骨消痛胶囊组Wnt4、GSK-3β、β-catenin mRNA含量呈下降趋势,差异有统计学意义(P < 0.05或P < 0.01),提示透骨消痛胶囊可通过调控KOA大鼠关节软骨下骨中Wnt4、GSK-3β、β-catenin mRNA表达,在一定程度上抑制KOA病理进程。见表2、图1。
3.2 Western Blot检测结果 Western Blot结果显示,透骨消痛胶囊作用于KOA大鼠软骨下骨后,可下调Wnt4、GSK-3β、β-catenin蛋白含量表达。与空白对照组比较,模型对照组Wnt4、GSK-3β、β-catenin蛋白含量表达显著升高,差异有统计学意义(P < 0.01),提示KOA大鼠关节软骨下骨发生一定程度的退变。与模型对照组比较,透骨消痛胶囊组Wnt4、GSK-3β、β-catenin蛋白含量呈下降趋势,差异有统计学意义(P < 0.05或P < 0.01),提示透骨消痛胶囊可通过调控KOA大鼠关节软骨下骨中Wnt4、GSK-3β、β-catenin蛋白含量表达,在一定程度上抑制KOA病理进程。见表3、图2。
4 讨 论
关节软骨和软骨下骨在解剖结构、生理功能及病理反应上是相互联系、相互作用的,是不可分割的统一整体。软骨和软骨下骨被认为是OA进展的复合关键结构,关节软骨的磨损会随着关节炎的不断加重而越来越严重,同时软骨下骨也会因为软骨的变化,发生相应的力学变化,软骨下骨的刚度增加,进一步导致关节软骨的力学缓冲下降,加重力学的损伤[12],从而加重KOA症状。研究发现,引起或加重关节软骨结构的改变、加剧KOA软骨退变的主要原因是软骨下骨骨量和厚度发生变化,从而改变组织的生物力学特点所致[13]。一些研究认为,KOA软骨下骨的变化主要是骨重塑,尤其在KOA早期阶段的骨重塑是以骨形成为主[14-15]。但亦有研究表明,KOA早期的骨重塑以骨吸收为主[16-17],软骨下骨的骨吸收增加后导致暂时性骨量减少是OA的主要特点[18],且有较多研究表明,减少关节疼痛,延缓软骨退变的方式是抑制或改善软骨下骨的异常改变[1]。
Wnt信号通路分为经典和非经典信号通路,其依据为是否依赖β-catenin的参与。在骨的生长发育及代谢方面,经典Wnt信号通路(即Wnt/β-catenin通路)是骨细胞作用的研究热点。研究发现,Wnt信号通路在维持关节稳态中起重要作用,且参与、调节关节内软骨下骨和软骨的生长发育和代谢,在OA的发展过程中,Wnt通路活性的改变影响软骨下骨生长板破骨细胞活性,从而导致软骨下骨硬化或关节边缘骨赘形成[19];其能够调节软骨、骨以及关节的形成,在软骨生成、调节软骨细胞表型及维持基质的完整性方面发挥重要作用;并且可以延长软骨细胞生命周期,抑制其分化為肥大细胞[20]。
动物实验证明,Wnt/β-catenin通路对骨密度和骨矿化程度的调节较为重要[21]。另有研究表明,Wnt/β-catenin通路在参与关节的胚胎发育、维持成人骨骼稳定方面发挥着重要作用,是软骨在胚胎发育、关节形成过程中不可或缺的重要调控机制[22]。因此,导致软骨组织发生结构性破坏主要是与软骨细胞发生肥大增生、细胞外基质分泌停止有关,而软骨组织表面β-catenin的增加是造成软骨细胞及细胞外基质发生改变的重要原因,最终加重OA的发展[23]。有文献显示,一旦抑制GSK-3β的活性,则可促进β-catenin聚集在细胞内,表明GSK-3β对Wnt通路具有负调节作用,从而减缓软骨骨化的进程与恶化[24]。
课题组前期实验研究表明,在KOA发病过程中,加速关节软骨退变的因素是软骨下骨重塑后造成的硬化和结构紊乱,而透骨消痛胶囊则可通过调整c-fos、c-jun、Cyclin D1 mRNA的表达,降低软骨下骨重塑速率;降低RANKL mRNA表达,减少OA发病早期软骨下骨吸收,抑制OA发病中后期软骨下骨形成,从而改善软骨下骨形态,延缓关节软骨的退变[25-26]。本研究基于Wnt/β-catenin信号通路,采用Western Blot、RT-PCR技术多层面、多角度从Wnt/β-catenin信号通路探讨OA软骨下骨硬化的机制及透骨消痛胶囊的干预作用,结果表明,透骨消痛胶囊作用于KOA大鼠软骨下骨后,可下调Wnt4、GSK-3β、β-catenin mRNA与蛋白含量表达,进而延缓KOA病理进程。今后可从微观层面如miRNAs角度,进一步探讨透骨消痛胶囊对于软骨下骨的发育成长与代谢等方面作用影响,以利于进一步阐明其作用机制。
参考文献
[1] 刘静,孙智路,周君,等.机械应力失衡对大鼠软骨及软骨下骨的影响[J].风湿病与关节炎,2019,8(6):5-8,16.
[2] CHEN WH,LIU XX,TONG PJ,et al.Diagnosis and management of knee osteoarthritis Chinese medicine expert consensus(2015)[J].Chin J Integr Med,2016,22(2):150-153.
[3] 葉大林,谢平金,魏合伟,等.补肾活血方调控膝骨性关节炎大鼠软骨下骨的作用机制研究[J].中国骨质疏松杂志,2018,24(12):71-76.
[4] 王伟,王坤正,党小谦,等.中老年膝骨关节炎发病的相关因素[J].中国组织工程研究,2006,10(44):15-18.
[5] MACKAY JW,GODLEY KC,TOMS AP.MRI signal-based quantification of subchondral bone at the tibial plateau:a population study[J].Skeletal Radiol,2014,43(11):1567-1575.
[6] 贾良良,许丽梅,陈达,等.筋骨失衡与膝骨关节炎疼痛的相关性探讨[J].风湿病与关节炎,2017,6(12):54-57,66.
[7] 陈赛楠,黄云梅,陈文列,等.透骨消痛胶囊干预兔膝骨关节炎蛋白多糖与 MMP-2、MMP-13表达的实验研究[J].风湿病与关节炎,2015,4(7):5-10,60.
[8] 林木南,刘献祥.透骨消痛方治疗膝骨性关节炎
30例[J].福建中医药,2005,36(4):15-16.
[9] SMOLDERS LA,MEIJ BP,R IEMERS FM,et al.Canonical Wnt signaling in the Notochordal cell is upregulated in early intervertebral disk degeneration[J].J Orthop Res,2012,30(6):950-957.
[10] 隋利强,陈星强,陈春蓉,等.基于Wnt/β-catenin信号通路探讨透骨消痛胶囊含药血清对经TNF-α诱导的软骨细胞多靶点保护作用[J].中华临床医师杂志(电子版),2015,9(18):52-55.
[11] 刘献祥,李西海,周江涛.改良Hulth造模法复制膝骨性关节炎的实验研究[J].中国中西医结合杂志,2005,25(12):1104-1108.
[12] BERTUGLIA A,LACOURT M,GIRARD C,et al.Osteoclasts are recruited to the subchondral bone in naturally occurring post-traumatic equine carpal osteoarthritis and may contribute to cartilage degradation[J].Osteoarthritis Cartilage,2016,24(3):555-566.
[13] RADIN EL,ROSE RM.Role of subchondral bone in the initiation and progression cartilage damage[J].Clin Orthop,1986(213):34-40.
[14] MATSUI H,SHIMIZU M,TSUJI H.Cartilage and subchondral bone interaction osteoarthrosis of human knee joint:a histological and histomorphometric study[J]. Microsc Res Tech,1997,37(4):333-342.
[15] DEDRICK DK,GOLDSTEIN SA,BRANDT KD,et al.
A longitudinal study of subchondral plate and trabecular bone in cruciate-deficient dogs with osteoarthritis followed up for 54 months[J].Arthritis Rheum,1993,36(10):1460-1467.
[16] HAYAMI T,PICKARSKI M,WESOLOWSKI GA,et al.
Alendronate inhibits osteophyt formation and partially protects cartilage deterioration in the rat anterior crucia ligament transection model of osteoarthritis[J].Ann Rheum Dis,2003,62(Suppl 1):110.
[17] WATSON PJ,HALL LD,MALCOLM A,et al.Degenerative joint disease in the guinea pig Use of magnetic resonance imaging to monitor progression of bone pathology[J].Arthritis Rheum,1996,39(8):1327-1337.
[18] WU L,GUO H,SUN K,et al.Sclerostin expression in the subchondral bone of patients with knee osteoarthritis[J].Int J Mol Med,2016,38(5):1395-1402.
[19] 吴追乐,曾建伟,陈星强,等.从Wnt/β-catenin信号通路探讨透骨消痛胶囊对关节软骨的保护作用[J].风湿病与关节炎,2015,4(12):5-7,31.
[20] ZHANG Y,PIZZUTE T,PEI M.A review of crosstalk between MAPK and Wnt signals and its impact on cartilage regeneration[J].Cell Tissue Res,2014,358(3):633-649.
[21] GOLOVCHENKO S,HATTORI T,HARTMANN C,et al.
Deletion of beta catenin in hypertrophic growth plate chondrocytes impairs trabecular bone formation[J].Bone,2013,55(1):102-112.
[22] 王文标,张保荣,斯琴.骨关节病软骨细胞Wnt/β-catenin信号通路的研究进展[J].中华临床医师杂志(电子版),2012,6(7):102-104.
[23] BLOM AB,BROCKBANK SM,VAN LENT PL,et al.
Involvement of the Wnt signaling pathway in experimental and human osteoarthritis:prominent role of Wnt-induced signaling protein 1[J].Arthritis Rheum,2009,60(2):501-512.
[24] 高宁阳,曹月龙,刘婷,等.Wnt信号通路与骨关节炎[J].中国骨伤,2010,23(4):320-323.
[25] ZHENG CS,YE HZ,XU XJ,et al.Computational Pharmacology study of tougu xiaotong granule inPreventing and treating knee osteoarthritis[J].Chin J Integr Med,2009,15(5):371-376.
[26] 张佳慧,李函,陈文列,等.透骨消痛膠囊干预骨质疏松性骨关节炎模型骨重建与炎症因子变化的研究[J].风湿病与关节炎,2019,8(3):5-10.
收稿日期:2019-07-10;修回日期:2019-08-23
