冠心病合并终末期肾病治疗决策的选择研究
2020-04-27张筠婷郑金刚
张筠婷 ,郑金刚 *
冠心病是目前全球主要致死疾病之一,而透析患者又极大增加了全因死亡的风险,当冠心病患者合并终末期肾病(end stage renal disease,ESRD)无疑雪上加霜,据不完全统计,冠心病合并ESRD患者心血管全因死亡风险高达44%,相对于急性心肌梗死的全因死亡风险为20%[1]。
虽然冠心病是透析患者发病和死亡的主要原因,但目前很难把握透析患者行冠状动脉造影的切入点,原因就在于透析患者常没有典型的冠心病症状[2],待出现症状时冠状动脉血管已出现重度狭窄并钙化,增加了手术难度及风险,属于心内科医师触碰的“礁点”。目前国内外关于透析患者合并冠心病的研究资料有限,对于这类人群,怎样的治疗策略才是最佳方案呢?选择血运重建是否优于药物保守治疗呢?目前众说纷纭,未成定论。由于大部分临床研究将这类患者排除在外,冠状动脉旁路移植术(coronary artery bypass grafting,CABG)和经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)等血运重建方法对于此类患者疗效方面的资料不够充分[3],且由于冠心病合并ESRD患者常合并重度钙化,血管扭曲,血运重建治疗难度高,临床相关研究较少。本研究旨在分析中日友好医院对于冠心病合并ESRD患者的临床治疗决策的选择。
1 资料与方法
1.1 临床资料 选取2012—2018年中日友好医院收治的100例冠心病合并ESRD患者为研究对象。冠心病根据冠状动脉造影明确诊断,ESRD诊断标准:各种原因引起肾小球滤过率(GFR)<15 ml/min且下降超过3个月。排除标准:不配合治疗者,严重精神病患者。
1.2 分组 根据冠状动脉造影结果结合心内科和心外科手术医生判断以及患者的意愿,分为CABG组20例、PCI组44例和药物治疗组36例。原则上冠状动脉造影狭窄<75%首选药物治疗,冠状动脉造影狭窄≥75%首选血运重建治疗,血运重建方案分为CABG和PCI两种方案,最终治疗方案的选择需结合手术医生判断以及患者意愿。本研究符合《赫尔辛基宣言》原则,患者或家属均知情同意并签署知情同意书。
三组患者性别、年龄、合并高血压、糖尿病、血脂异常比例、透析病程、心率、收缩压、舒张压、左心室射血分数、冠状动脉病变及支数比较,差异均无统计学意义(P>0.05,见表1)。
1.3 方法 CABG:患者均行气管内插管、静脉复合麻醉,在胸骨正中处作切口,给予1 mg/kg的肝素静脉注射,并将左侧乳内动脉和/或大隐静脉游离备用;升主动脉近端吻合口,使用端吻合装置或侧壁钳隔离无血进行术野操作,打孔完成后,使用6-0聚丙烯缝线将大隐静脉与主动脉吻合口缝合;暴露心脏表面靶血管,使用心表组织固定器固定靶血管,令靶血管血流阻断,于靶血管和桥血管将相应大小的吻合口分别切口,并使用7-0聚丙烯缝线进行缝合,之后开放靶血管和桥血管;使用流量仪对桥血管流量进行测量,若有流量不满意者,则再次进行吻合。
PCI:在进行充分双联血小板治疗后,入导管室行冠状动脉造影,常规消毒,铺巾,1%利多卡因局麻下,经桡动脉采用Seldinger技术穿刺,仔细分析冠状动脉造影结果后,若左主干、左前降支、左回旋支或右冠状动脉管腔内径减少≥50%,判定为有意义病变;记录支架置入的血管部位、病变性质(弥漫病变、慢性完全闭塞、分叉)、支架数量、长度及直径等;原支架内或支架两端5 mm内狭窄程度≥50%判定为支架内再狭窄(ISR),当ISR≥75%且合并临床症状时,则再次进行血运重建(通常再次置入支架)。
药物治疗组:阿司匹林、氯吡格雷双联抗血小板,他汀调脂稳定斑块,血管紧张素转化酶抑制剂(ACEI)改善心室重构,β-受体阻滞剂抑制交感兴奋预防猝死等。
1.4 观察指标 主要观察住院期间和出院后门诊随访相关情况。记录住院期间并发症(包括心力衰竭、心律失常、急性心肌梗死)发生率、病死率。所有患者术后通过电话、门诊或邮件方式随访,随访时间6个月~5年,随访截至2019-06-30,随访内容包括全因死亡、心源性死亡、主要不良心血管事件(MACE)发生情况等。
1.5 统计学方法 采用SPSS 21.0统计学软件包进行数据处理,计量资料符合正态分布以(±s)表示,多组间比较采用单因素方差分析;计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组住院期间情况比较 三组患者住院期间并发症发生率、病死率比较,差异均无统计学意义(P>0.05,见表2)。
2.2 三组出院随访结果比较 三组患者随访期间全因死亡率、心源性死亡率、MACE发生率比较,差异均无统计学意义(P>0.05,见表3)。
3 讨论
本研究结果显示,对于冠心病合并ESRD患者,选择CABG或PCI等血运重建治疗,虽然能短期改善患者症状,但其住院期间病死率、随访期间全因死亡率、心源性死亡率、MACE发生率等与药物治疗组并无明显差异,且药物治疗组不存在手术风险及围术期并发症等风险,综上所述得出结论,血运重建治疗相对于药物保守治疗而言,在预后上并无明显生存优势。
近年来,冠心病合并ESRD的人群发病率逐渐增高,已经严重威胁到了人类健康,ESRD患者被认为是冠心病的高危人群[4],心血管疾病是其最常见的致死原因。截至2010年世界范围内需要透析的患者约26万[5],到2030年可能达到54万[6],而慢性透析患者发生冠心病的概率为30%~60%[7]。由于透析患者钙磷代谢失调加速了血管内膜、中膜的钙化[8],从病理学角度来看,透析者相对比于非透析者更容易出现血管钙化[9],重度钙化及血管扭曲加大了手术难度,围术期合并症多,对于这类患者是选择CABG,还是PCI,抑或是药物保守治疗,一直是学术界争论的话题,并无定论,且由于手术难度高,术后死亡率及复发率高,以及疾病本身进展导致其他心源性和非心源性死亡等,为此类人群研究的薄弱点,研究对象偏少,尤其从长期预后来做对比,国内外鲜有报道。
IVENS等[10]首次研究报道了冠心病合并ESRD患者血运重建的最佳策略治疗,其做了一项回顾性调研,旨在对比冠心病合并ESRD患者在经皮冠状动脉腔内血管成形术(PTCA)或CABG后出现再发心绞痛、心肌梗死、二次介入率和心血管死亡率的差别,研究入选了杜塞尔多夫大学医院1982—1994年所有行血运重建的冠心病合并ESRD患者,其中40例接受PTCA,65例接受CABG。研究结果表明CABG组围术期死亡率为4.8%,PTCA组围术期死亡率为0,术后12、24个月的生存率PTCA组分别为95%、82%,CABG组分别为93%、86%。两组之间总死亡率无差别。为此IVENS等[10]得出结论,虽然接受CABG的患者冠状动脉病变更严重,但其术后的总死亡率和PTCA组并无差别,且患者的临床症状和心功能有所改善。该研究结果更倾向于血运重建的治疗获益。
随后,REDDAN等[11]研究了1995—2000年在杜克医科大学的冠心病合并慢性肾脏病(CKD)患者。研究结果表明,无论对于肾功能正常的冠心病患者还是合并CKD的冠心病患者,CABG组比药物治疗组更有生存获益。虽然对于肾功能正常的冠心病患者CABG并不比PCI更有生存获益,但是对于合并CKD的冠心病患者,CABG更能改善生存率。另一方面,对于肾功能正常、轻度和中度CKD患者,PCI比药物治疗更具有生存获益;对于重度CKD患者,PCI并不能改善生存率,但CABG比PCI更能降低死亡率。
基于上述两项研究,血运重建似乎更受广大医务工作者们青睐,传统观念也认为血运重建对缓解患者的症状,改善生活质量有一定优势。后续也有研究证实,与药物治疗相比,血运重建治疗仍然能改善ESRD患者的生存率,尽管这种获益要小于普通人群[12]。那么PCI和CABG这两种血运重建策略孰优孰劣呢?

表1 三组冠心病合并ESRD患者一般资料比较Table 1 Comparison of baseline characteristics of patients with CHD and ESRD in three groups
一项荟萃分析研究了1977—2002年冠心病合并ESRD患者,结果显示,与PCI组相比,CABG组患者的死亡率〔RR=0.93,95%CI(0.88,0.98)〕、心脏事件风险〔RR=0.50,95%CI(0.37,0.68)〕、心肌梗死风险〔RR=0.62,95%CI(0.51,0.75)〕和靶血管再次血运重建风险〔RR=0.21,95%CI(0.13,0.35)〕均较低[13]。另一项荟萃分析显示,PCI组患者早期死亡率低于CABG组,晚期死亡率高于CABG组,PCI组再发心肌梗死和靶血管再次血运重建风险高于CABG组,脑卒中发生率低于CABG组[14]。可见,无论是荟萃分析,还是调查研究,现有的研究对于血运重建策略的选择可以说PCI和CABG各有所长,应结合其他临床情况,不能统一论之。

表2 三组住院期间情况比较〔n(%)〕Table 2 Comparison of outcomes of patients in three groups during hospitalization
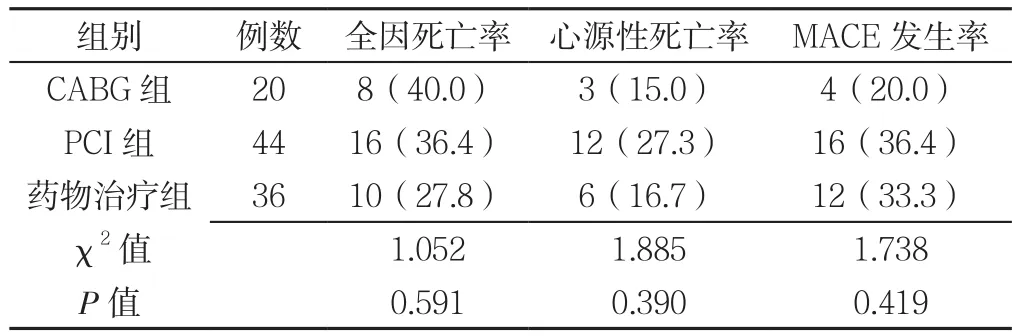
表3 三组出院随访结果比较〔n(%)〕Table 3 Comparison of discharge follow-up results of patients in three groups
以上均提示血运重建术后短期内(2年内)在一定程度上能改善冠心病合并ESRD患者的生存率,那么从长期预后来看,CABG、PCI和非血运重建治疗谁能拔得头筹呢?
HEMMELGARN 等[15]对比研究了 CABG、PCI或非血运重建3种治疗策略对各类肾功能不全患者8年生存率的影响,结果表明CABG、PCI、非血运重建组的8年生存率分别为85.5%、80.4%、72.3%,校正后的生存率在非透析患者中分别为45.9%、32.7%、29.7%,在透析患者中分别为44.8%、41.2%、30.4%。HEMMELGARN等[15]得出结论:在各类肾功能不全患者中,相对于非血运重建治疗,从长期预后来看,CABG组均有更好的存活率。在透析患者中PCI组相对于非血运重建组死亡风险更低,但在非透析患者中并无此优势。
HERZOG等[1]做了一项回顾性研究,目的是对比透析冠心病患者PTCA、PCI、CABG后的长期生存率,研究结果表明,CABG组全因死亡及心源性死亡的RR值分别为0.80〔95%CI(0.76,0.84),P<0.000 1〕和 0.72〔95%CI(0.67,0.77),P<0.000 1〕,PCI组全因死亡及心源性死亡的RR值分别为0.94〔95%CI(0.88,0.99),P<0.05〕和0.92〔95%CI(0.85,0.99),P=0.03〕。得出结论,对于美国的冠心病合并ESRD患者行CABG比PCI有更好的长期生存率,但对于合并糖尿病的患者PCI后的长期生存率更差。
但是,2010年DE LIMA等[16]提出了新的观点,其评估了冠心病合并CKD患者非侵入性治疗后心血管事件和死亡的长期预后,分析了519例冠心病合并CKD患者,其中230例冠状动脉造影显示严重狭窄>70%,分别分为药物治疗组184例,血运重建组30例(PCI或CABG),其中16例拒绝介入治疗但接受后期随访。药物治疗组12、36、60个月的无事件生存率分别为86%、71%、57%,总生存率分别为89%、71%、50%。拒绝介入治疗的患者比接受介入治疗的预后更差。为此得出结论,冠心病合并CKD且血管严重狭窄患者,药物治疗在一定程度上提高了远期无事件生存率,但当需要介入治疗而拒绝接受时能极大地增强心血管事件和死亡的风险。该研究刷新了传统的血运重建与药物治疗观念,强调了药物保守治疗对长期生存率的获益,且药物保守治疗不存在围术期风险和术后并发症等,利于临床实施,更易于为广大患者所接受。同时,DE LIMA等[16]还报道,药物治疗组在1、3、4年的生存率分别为91%、71%、59%,血运重建组分别为93%、67%、57%,二者并无差异。PILMORE等[17]也报道,血运重建组相对比于药物治疗组在长期预后上并无明显生存优势。
本研究结果也表明,血运重建和药物治疗相比,在生存率、MACE发生率上并无优势。这一点和上述研究正好不谋而合。此项新的视点为临床研究打开了新的思路,也提示更应关注这类人群的长期预后,为后续研究奠定了基础。
本研究为回顾性研究,主要的局限性在于分组并不是随机分组,但是也难以通过调整入选病例或通过现有统计方法把所有的混杂因素去除。因此,存在选择偏倚是本研究最大的不足之处,目前国内尚缺少关于冠心病合并ESRD患者大样本多中心的前瞻随机对照性研究或回顾性研究,本研究是本院冠心病合并ESRD患者PCI、CABG以及药物治疗的中长期预后随访研究,在今后的研究工作中将扩大研究范围,由单中心扩大到多中心,旨在研究北京市多中心医院冠心病合并ESRD患者的现状。
综上所述,对于冠心病合并ESRD患者,血运重建和药物治疗各有优劣势,对于短期预后而言血运重建尤其是CABG更占优势,但对于长期预后来说,药物保守治疗更能提高患者的远期生存率。虽然药物保守治疗相对风险较低,EISENSTEIN等[18]研究发现,合并CKD的左主干病变、双支病变和部分三支病变,CABG治疗比药物治疗更具有经济效益。因此,尽管手术风险高,预后相对较差,但对于符合适应证的患者,仍然推荐进行血运重建。
总体而言,与PCI相比,CABG的远期生存率或许更高,但由于相关研究均是回顾性的并且存在选择偏倚,难以得出确定的结论。本研究分析了本院此类血运重建和药物治疗的风险及预后,有助于提高透析患者的长期存活率和生活质量,并提出了新的视点,以期为患者谋求最佳治疗方案。
作者贡献:张筠婷进行文章的构思与设计,数据收集、整理,统计学处理,结果的分析与解释,撰写论文,论文的修订;张筠婷、郑金刚进行研究的实施与可行性分析,对文章整体负责,监督管理;郑金刚负责文章的质量控制及审校。
本文无利益冲突。
