蒟子的化学成分研究
2020-04-27张潘华罗吉凤夏梦媛龙春林王跃虎
张潘华,杨 珺,罗吉凤,夏梦媛,龙春林,王 俐,王跃虎*
1中国科学院昆明植物研究所 资源植物与生物技术重点实验室及云南省野生资源植物研发重点实验室,昆明 650201;2中央民族大学 民族医药教育部重点实验室,北京 100081;3云南农业大学园林园艺学院,昆明650201
胡椒科(Piperaceae)胡椒属(PiperLinn.)植物全球约2000种;中国分布60余种,其中约30种为药用植物[1,2]。部分胡椒属植物在民间用于治疗癌症,目前已从胡椒属植物中发现具有细胞毒活性的酰胺、木脂素、链烯基苯酚(alkenylphenols)、查尔酮、胡椒内酯(piperolides)等类型成分[1]。
蒟子(PiperyunnanenseTseng),别名大麻疙瘩,产于云南南部、西南部和西北部。生于林中或湿润地,海拔1 100~2 000 m[2]。蒟子全株入药,有舒筋活络、温经行湿、行气止痛的功能,用于风湿、跌打损伤、胃痛和月经不调等[3]。2012年6月,我们在云南省西双版纳州基诺乡进行了调查时发现,当地基诺族人将蒟子的根捣碎包敷,用于治疗跌打损伤;傣族人将蒟子的根泡水,当作饮料饮用。但是,至今为止,尚无人报道该药用植物的化学成分。我们对采集于当地的蒟子全株进行化学成分研究,发现4个新的酰胺成分及6个已知化合物(图1),本文报道这4个新化合物的结构解析及其细胞毒活性测试结果。
1 仪器与材料
旋光由JASCO P-1020旋光仪(Jasco Corp.,Tokyo,Japan)测定;紫外光谱(UV)由Shimadzu UV-2401 PC紫外分光光度仪(Shimadzu,Kyoto,Japan)测定;ECD谱由Chirascan圆二色谱仪(Applied Photophysics Ltd.,Leatherhead,UK)测定;红外光谱(IR)由Bruker Tensor 27 FTIR红外光谱仪(Bruker Corp.,Ettlingen,Germany)测定(KBr压片);1H和13C NMR波谱由Bruker DRX-500核磁共振仪(Bruker Bio-Spin GmbH,Rheinstetten,Germany)测定(TMS为内标);电喷雾电离质谱(ESI-MS)由API Qstar Pulsar1质谱仪(Applied Biosystems/MDS Sciex,Foster City,CA,USA)测定;高分辨电子轰击质谱(HR-EI-MS)由Waters AutoSpec Premier p776三扇型双聚焦磁质谱仪(Waters,Millford,MA,USA)测定;柱层析用材料包括正相硅胶G(100~200目、300~400目)、H型硅胶(10~40 μm)和硅胶G245(青岛海洋化工厂),反相硅胶RP-C18(40~75 μm,日本Fuji Silysia 化学公司),D101大孔吸附树脂(青岛海洋化工厂),以及凝胶Sephadax LH-20(GE Healthcare Bio-Sciences AB)。化合物半制备采用Agilent 1200型高效液相色谱(HPLC)仪,配备色谱柱为Agilent Zorbax SB-C18(9.4×250 mm,5 μm)和Waters XBridge prep C18(10×250 mm,5 μm)。化合物显色剂为5%H2SO4-乙醇溶液。
蒟子全株于2012年6月,采自云南省西双版纳州景洪市基诺乡,由本文作者龙春林教授和杨珺实验师鉴定为PiperyunnanenseTseng,标本(2012083)保存于中国科学院昆明植物研究所资源植物与生物技术重点实验室。
2 实验方法
2.1 提取与分离
将蒟子的全株(5.7 kg)干燥后粉碎,用甲醇常温浸渍法提取4次,每次7天。滤液回收溶剂后,得粗提物(410 g)。加入水制备成混悬液,依次用石油醚和氯仿萃取后得到石油醚部分(0.7 g)和氯仿部分(18.0 g)。通过薄层色谱检测后发现,水相还有大量的改良碘化铋钾显色的成分,因此,将水相部分用D101大孔吸附树脂进行柱色谱分离,水洗脱部分弃去,90%乙醇洗脱部分浓缩后得醇洗脱部位(24.1 g)。将醇洗脱部位用正相硅胶柱层析划段(氯仿-甲醇,5∶1→1∶1,V/V),最终得到5个部分(A~E)。
A部分(9.1 g)经RP-18反相硅胶柱层析(甲醇-水,5∶95→90∶10)洗脱,取50%甲醇洗脱部分经Sephadex LX-20凝胶(甲醇)柱层析,得到4个组分样品(A1~A4)。A1经正相硅胶柱层析(石油醚-乙酸乙酯,3∶1)后,用半制备HPLC(Agilent Zorbax SB-C18柱,流速v=2 mL/min;乙腈-水,39∶61)纯化,得到化合物1(tR=29.427 min,3.2 mg)和2(tR=43.065 min,3.4 mg)。A2经正相硅胶柱层析(氯仿-丙酮,3∶1和1∶1)后,用半制备HPLC(Agilent Zorbax SB-C18柱,流速v=2 mL/min;乙腈-水,43∶57;tR=22.570 min)纯化,得化合物3(8.3 mg)。A3经正相硅胶层析(氯仿-乙酸乙酯,5∶1和3∶1)和Sephadex LX-20凝胶柱层析(甲醇)后,用半制备HPLC(Agilent Zorbax SB-C18柱,流速v=2 mL/min;乙腈-水,43∶57;tR=16.570 min)纯化,得到化合物4(3.7 mg)。A4经正相硅胶(氯仿-乙酸乙酯,5∶1和3∶1)后,用半制备HPLC(Agilent Zorbax SB-C18柱,流速v=2 mL/min;甲醇-水,55∶45)分离,得到化合物10(tR=14.341 min,3.7 mg)、8(tR=20.896 min,3.4 mg)和9(tR=28.876 min,4.2 mg)。
D部分(2.4 g)经RP-18反相硅胶柱层析(甲醇-水,5∶95→90∶10)后,取50%甲醇洗脱部分,进行Sephadex LX-20凝胶柱(甲醇)和正相硅胶柱(氯仿-甲醇,5∶1)层析,最后经过半制备HPLC [Waters XBridge prep C18柱,流速v=2 mL/min;甲醇-水(含0.05%三氟醋酸),65∶35]分离,得化合物5(tR=15.535 min,10.0 mg)、7(tR=19.828 min,12.2 mg)和6(tR=25.963 min,6.1 mg)。
2.2 细胞毒活性测试
细胞毒活性评价采用MTS法,根据文献中提供的方法进行癌细胞生长活性测试[4,5]。MTS为MTT类似物,全称为3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)- 2-(4-sulfopheny)-2H-tetrazolium。活细胞线粒体中琥珀酸脱氢酶能够代谢还原MTS,生成可溶性的甲臜(formazan)化合物,该化合物的光密度OD(490 nM)值与活细胞数目成正比。应用两点法(Reed and Muench法)计算化合物的IC50值。顺铂和紫杉醇为阳性对照。
3 结果与讨论
3.1 结构鉴定

表1 化合物1的核磁共振氢谱和碳谱数据(500 MHz 和125 MHz,CDCl3,δ in ppm,J in Hz,下同)
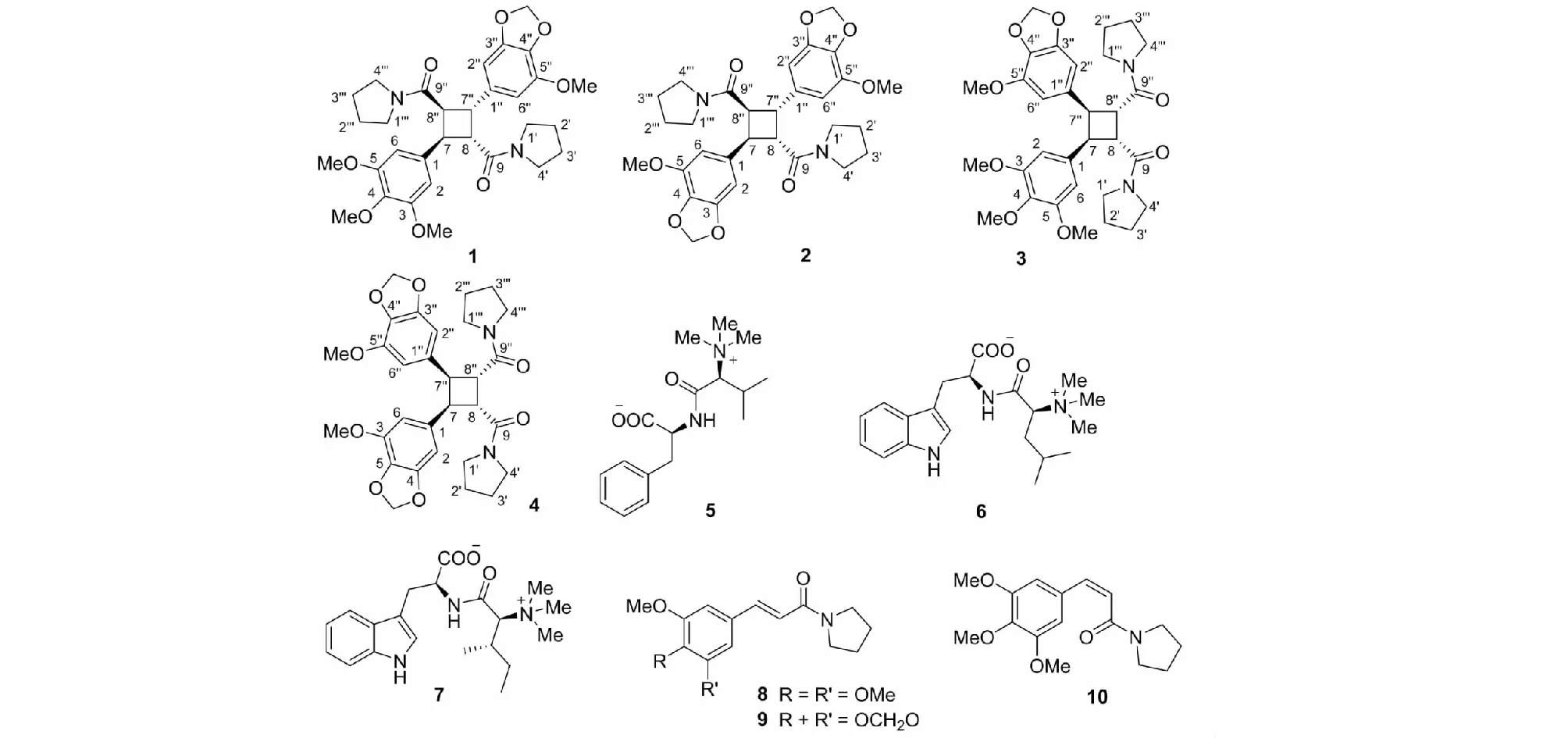
图1 蒟子中化合物1~10的化学结构式Fig.1 Chemical structures of compounds 1-10 from P.yunnanense
化合物1的高分辨质谱(HR-EI-MS)显示出[M]+峰m/z566.262 6(calcd for C31H38N2O8,566.262 8),推断其分子式为C31H38N2O8,不饱和度14。1H NMR谱(表1)中显示有4个甲氧基[δH3.91(3H,s)、3.87(6H,s)和3.80(3H,s)],1个亚甲二氧基[δH5.94(1H,d,J= 1.3 Hz)和5.93(1H,d,J= 1.3 Hz)],以及两个四取代苯环[δH6.66(2H,s)、6.65(d,J= 1.3 Hz)和6.62(d,J= 1.3 Hz)]的信号。13C NMR谱(表1)显示该化合物存在2个酰胺羰基(δC169.4和169.3),4个甲氧基,1个亚甲二氧基,两个苯环,两个四氢吡咯片段,以及4个次甲基(δC49.4、49.2、41.8和41.6)。
通过分析以上波谱特征,并把化合物1的NMR数据跟已知化合物(E)-N-(3,4,5-三甲氧基肉桂酰基)四氢吡咯[(E)-N-(3,4,5-trimethoxycinnamoyl)pyrrolidine,8][6]和(E)-N-(5-甲氧基-3,4-亚甲二氧基肉桂酰基)四氢吡咯[(E)-N-(5-methoxy-3,4-methylenedioxycinnamoyl)pyrrolidine,9][7]的NMR数据进行对比,推测化合物1很可能是化合物8与9通过[2+2]光环合加成的产物。从化合物1的EI-MS谱碎片离子峰(图2)推测,该化合物是头对尾的[2+2]加成产物。其平面结构通过COSY和HMBC相关(图3)得到确认。在HMBC谱中,H-2和H-6跟C-7,以及H-7跟C-2和C-6有相关,说明3,4,5-三甲氧基苯基连接在C-7上;H-2′′和H-6′′跟C-7′′,以及H-7′′跟C-2′′和C-6′′有相关,说明5-甲氧基-3,4-亚甲二氧基连接在C-7′′上,进一步确证了化合物1是头对尾的[2+2]加成产物。

图2 化合物1~4的EI-MS裂解碎片Fig.2 EI-MS fragments of compounds 1-4 注:括号中为相对丰度。Note:Relative intensities in brackets.
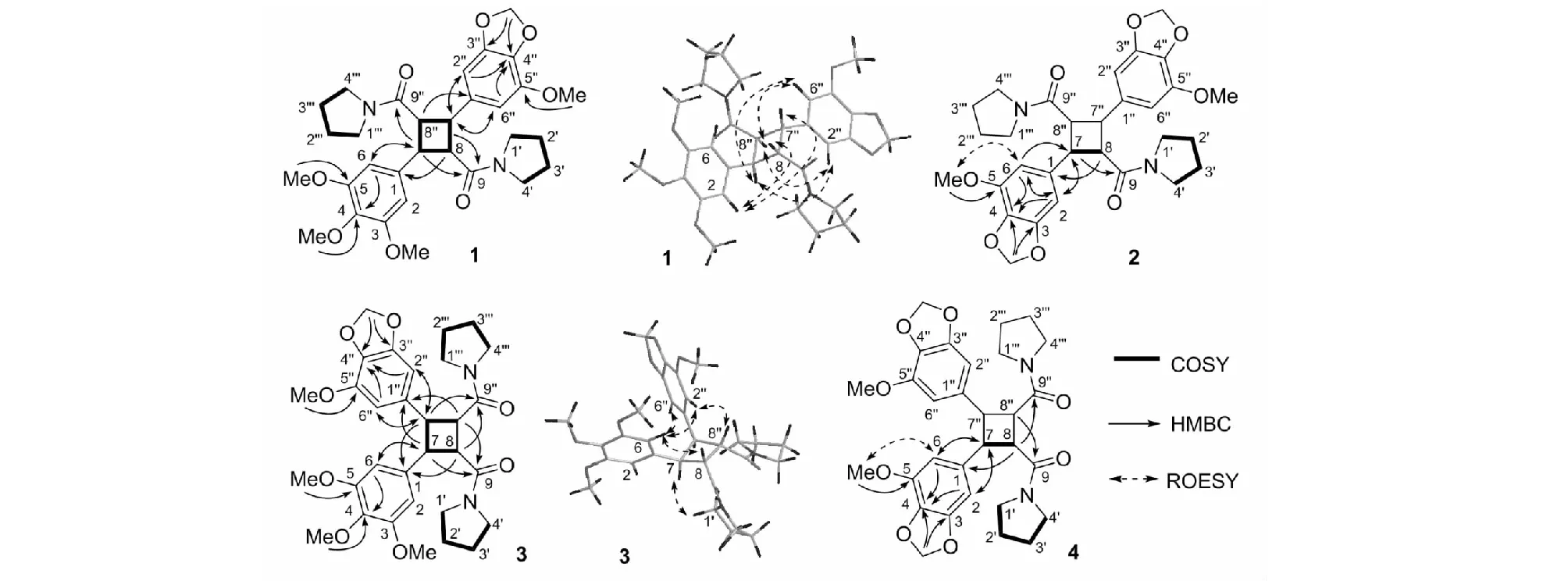
图3 化合物1~4关键的2D NMR相关Fig.3 2D NMR correlations of compounds 1-4
根据ROESY相关(图3)来判断化合物1的相对构型,H-7与H-8′′跟H-2′′和H-6′′有相关,表明这些氢原子均位于平面的一侧;而H-8与H-7′′跟H-2和H-6有相关,表明这些氢原子位于平面的另一侧。这样,化合物1的相对构型得以确定,命名为蒟子酰胺A(piperinamide A)。由于该化合物的圆二色谱(CD)无信号,推测为消旋体。我们尝试进行手性拆分,但没有成功。
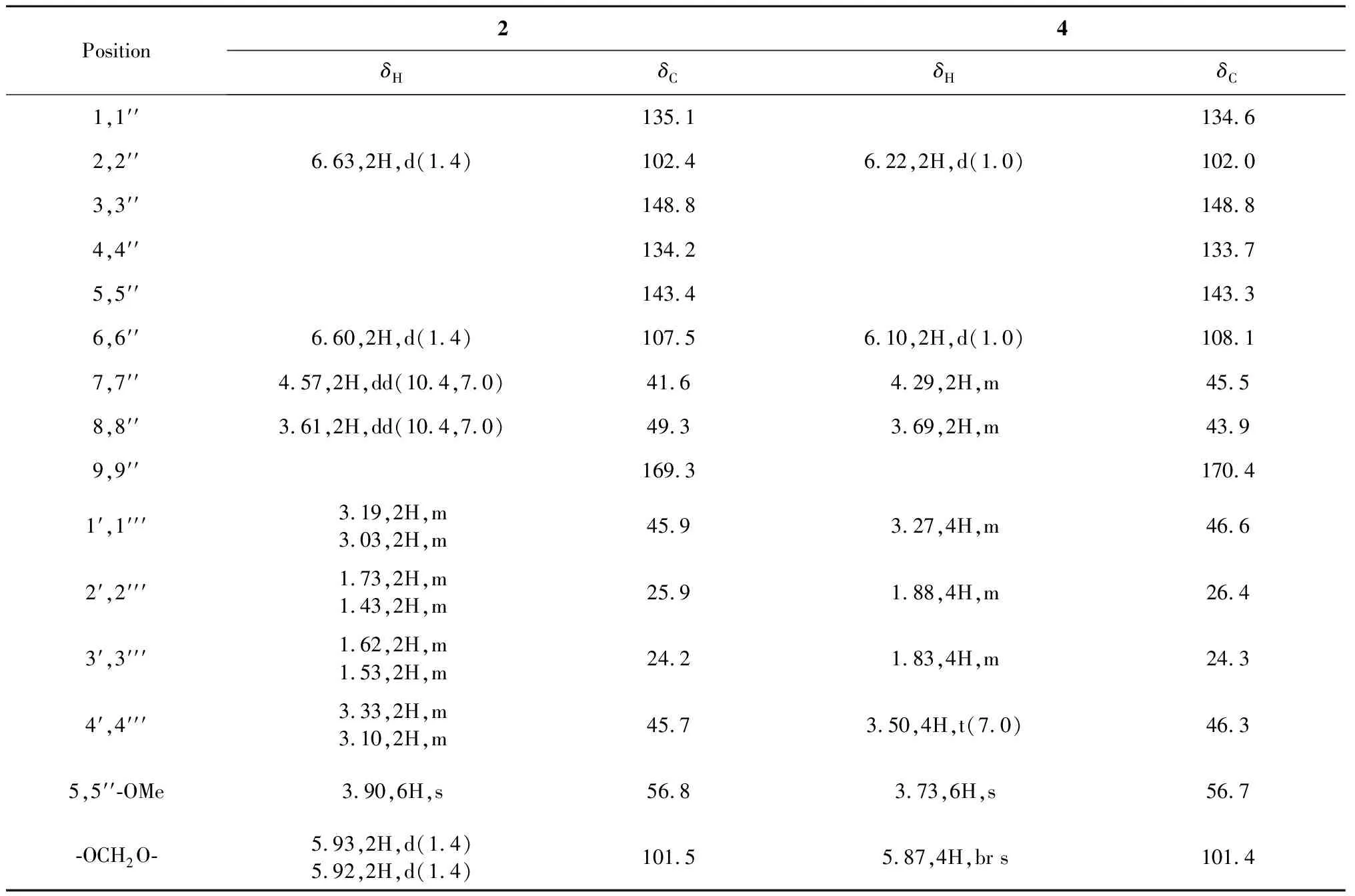
表2 化合物2和4的核磁共振氢谱和碳谱数据
化合物2的高分辨EI质谱显示出[M]+峰m/z550.231 0(calcd for C30H34N2O8,550.231 5),推断其分子式为C30H34N2O8,不饱和度15。从分子式来看,该化合物应该有30个碳,但其13C NMR谱(表2)中只能看到15个信号(1个苯环,1个甲氧基,1个亚甲二氧基,1个羰基,1个四氢吡咯基,以及2个高场次甲基),推测其具有分子内对称结构。将该化合物的NMR数据(表2)跟化合物1及已知化合物(E)-N-(5-甲氧基-3,4-亚甲二氧基肉桂酰基)四氢吡咯(9)的NMR数据进行对比,并结合EI-MS裂解碎片分析(图2),推测化合物2是由两分子(E)-N-(5-甲氧基-3,4-亚甲二氧基肉桂酰基)四氢吡咯的头对尾[2+2]光环合加成的产物。化合物2的H-7和H-7′′(δH4.57,2H,dd,J= 10.4,7.0 Hz),以及H-8和H-8′′(δH3.61,2H,dd,J= 10.4,7.0 Hz)的化学位移及偶合常数跟1这几个氢的数据(表1)基本一致,因此,推测其相对构型跟1的一致。把化合物2命名为蒟子酰胺B(piperunnamide B)。
化合物3的高分辨EI质谱显示出[M]+峰m/z566.262 8(calcd for C31H38N2O8,566.262 8),推断其分子式为C31H38N2O8,不饱和度14,其分子式跟蒟子酰胺A(1)完全一样,是后者的同分异构体。跟蒟子酰胺A一样,化合物3的13C NMR谱(表3)也显示该化合物存在2个酰胺羰基(δC170.5和170.4),4个甲氧基,1个亚甲二氧基,两个四氢吡咯,以及4个高场次甲基(δC45.7、45.7、43.9和43.8)。结合化合物3的EI-MS谱碎片离子峰(图2)推测,该化合物是化合物8和9头对头的[2+2]加成产物。HMBC相关中(图3),可以看到H-2和H-6跟C-7,以及H-7跟C-2和C-6的相关,说明3,4,5-三甲氧基苯基连接在C-7位;H-2′′和H-6′′跟C-7′′,以及H-7′′跟C-2′′和C-6′′的相关,说明5-甲氧基-3,4-亚甲二氧基连接在C-7′′上,进一步确证了化合物3是头对头的[2+2]加成产物。

表3 化合物3的核磁共振氢谱和碳谱数据
根据ROESY相关(图3)可判断化合物3的相对构型,H-2、H-6、H-8和H-8′′跟H-2′′和H-6′′有相关,表明这些氢原子均位于平面的一侧;而H-7与H-7′′跟H2-1′和H2-1′′′有相关,表明这些氢原子位于平面的另一侧。这样,化合物3的相对构型得以确定,给俗名蒟子酰胺C(piperunnamide C)。
化合物4的高分辨EI质谱显示出[M]+峰m/z550.229 8(calcd for C30H34N2O8,550.231 5),推断其分子式为C30H34N2O8,不饱和度15,是化合物2的同分异构体。从分子式来看,该化合物应该有30个碳,但其13C NMR谱(表2)中只能看到15个信号(1个苯环,1个甲氧基,1个亚甲二氧基,1个羰基,1个四氢吡咯基,以及2个高场次甲基),推测其具有分子内对称结构。将该化合物的NMR数据(表2)跟化合物3及化合物9的NMR数据进行对比,结合EI-MS裂解碎片分析(图2),推测化合物4是两分子(E)-N-(5-甲氧基-3,4-亚甲二氧基肉桂酰基) 四氢吡咯的头对头[2+2]光环合加成的产物。化合物4的H-7和 H-7′′(δH4.29,2H,m),C-7和C-7′′(δC45.5),H-8和H-8′′(δH3.69,2H,m),以及C-8和C-8′′(δC43.9)的化学位移跟3这几个位置氢和碳的数据(表3)基本一致,因此,推测其相对构型跟3的一致。把化合物4命名为蒟子酰胺D(piperunnamide D)。
通过跟文献中的化合物对比波谱数据,已知化合物分别鉴定为短蒟酰胺C(pipermullamide C,5)[8],短蒟酰胺D(pipermullamide D,6)[8],短蒟酰胺E(pipermullamide E,7)[8],(E)-N-(3,4,5-三甲氧基肉桂酰基)四氢吡咯[(E)-N-(3,4,5-trimethoxycinnamoyl)pyrrolidine,8][6],(E)-N-(5-甲氧基-3,4-亚甲二氧基肉桂酰基)四氢吡咯[(E)-N-(5-methoxy-3,4-methylenedioxycinnamoyl)pyrrolidine,9][7],以及(Z)-N-(3,4,5-三甲氧基肉桂酰基) 四氢吡咯[(Z)-N-(3,4,5-trimethoxycinnamoyl)pyrrolidine,10][9]。
3.2 化合物的物理常数
蒟子酰胺A(piperunnamide A,1) 白色粉末(CHCl3);UV(CH3OH)λmax(logε)275(2.81),240(3.39),207(4.08)nm;IR(KBr)νmax1 631,1 452,1 383,1 049 cm-1;1H NMR和13C NMR数据见表1;EI-M:m/z(rel.int.)566 [M]+(38),468(19),291(100),275(17),221(67),205(47);ESI-MS:m/z589 [M + Na]+;HR-EI-MSm/z:566.262 6 [M]+(calcd for C31H38N2O8,566.262 8)。
蒟子酰胺B(piperunnamide B,2) 白色粉末(CHCl3);UV(CH3OH)λmax(logε)276(3.68),245(4.17),210(4.87)nm;IR(KBr)νmax1 632,1 511,1 448,1 439,1 383,1 197,1 133,1 093,1 045 cm-1;1H NMR和13C NMR数据见表2;EI-MS:m/z(rel.int.)550 [M]+(68),305(100),275(91),206(80);ESI-MS:m/z573 [M + Na]+,HR-EI-MS:m/z550.231 9 [M]+(calcd for C30H34N2O8,550.231 5)。
蒟子酰胺C(piperunnamide C,3) 白色粉末(CHCl3);UV(CH3OH)λmax(logε)274(3.37),240(4.08),206(4.88)nm;IR(KBr)νmax1 632,1 511,1 451,1 126,1 094,1 045 cm-1;1H NMR和13C NMR数据见表3;EI-MS:m/z(rel.int.)566 [M]+(15),344(6),291(100),275(16),222(62);ESI-MS:m/z589 [M + Na]+,HR-EI-MS:m/z566.262 8 [M]+(calcd for C31H38N2O8,566.262 8)。
蒟子酰胺D(piperunnamide D,4) 白色粉末(CHCl3);UV(CH3OH)λmax(logε)280(3.49),244(4.03),208(4.84)nm;IR(KBr)νmax1 631,1 512,1 451,1 384,1 199,1 131,1 092,1 046 cm-1;1H NMR和13C NMR数据见表2;EI-MS:m/z(rel.int.) 550 [M]+(10),328(10),275(88),223(8),206(100);ESI-MS:m/z573 [M + Na]+,HR-EI-MS:m/z550.229 8 [M]+(calcd for C30H34N2O8,550.231 5)。化合物1~4的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
3.3 细胞毒活性测试结果
测试了4个新化合物对5种肿瘤细胞株的体外细胞毒活性,结果见表4。蒟子酰胺A(1)对人白血病HL-60细胞(IC50=10.99 μM)、人肝癌SMMC-7721细胞(IC50=17.10 μM)、人肺癌A-549细胞株(IC50=7.93 μM)、乳腺癌MCF-7细胞(IC50=16.63 μM)和结肠癌SW480细胞(IC50=9.16 μM)的生长有抑制活性。其余3个化合物没有活性(IC50>40 μM)。
在此前的研究中,我们注意到,胡椒属植物中的酰胺类成分,如果其分子结构中具有3,4,5-三甲氧基苯基片段,该化合物可能会显示出较好的细胞毒活性,比如荜拔明碱(piperlongumine)[1]。我们也因此合成了一些含有这种结构片段的酰胺类成分[10]。化合物1和3含有3,4,5-三甲氧基苯基片段,化合物2和4没有这种结构片段。化合物1具有细胞毒活性,符合上述构效关系(structure-activity relationship)的预测;化合物3没有活性,可能是由于其立体构型的差异造成的。

表4 蒟子中化合物1~4对5株肿瘤细胞生长抑制作用
注:每个试验重复3次;IC50值是根据3次试验所得抑制率的平均值计算出来的;顺铂和紫杉醇为阳性对照。
Note:All experiments were repeated three times;IC50values were calculated from the mean inhibition value at each concentration;Cisplatin and paclitaxel are positive control.
4 结论
从蒟子全株中分离、鉴定出了10个化合物,其中4个为新的酰胺类成分,所有化合物均是首次从该植物中发现。蒟子酰胺A(1)对人白血病HL-60细胞、人肝癌SMMC-7721细胞、人肺癌A-549细胞株、人乳腺癌MCF-7细胞和人结肠癌SW480细胞的生长有抑制活性。为了更好地开发利用这个药用植物,有必要对其开展更深入的化学成分研究和药理活性评价。
致谢:在云南省西双版纳州景洪市基诺乡调查时,得到基诺族村民阿妹和周布鲁的帮助;同时,刘洪新和谭英也参与了此次调查,在此一并致谢。