阿里红多糖组分对APP/PS1双转基因模型小鼠海马区AKT/GSK3β/Tau/P-tau蛋白表达的影响
2020-04-27丛媛媛阿依江哈拜克帕丽达阿不力孜
李 珍,丛媛媛,阿依江·哈拜克,帕丽达·阿不力孜
新疆医科大学药学院,乌鲁木齐 830011
阿尔茨海默病(Alzheimer’s disease,AD) 是一种发生于老年期或老年前期的以进行性认知功能减退为典型表现的神经退行性疾病,同时伴有精神行为异常、人格障碍等临床症状。近年来,对于阿尔茨海默病流行病学和基因学的研究,进一步阐明了其致病因素、遗传的复杂性以及病理变化[1,2]。AD典型临床特征主要是神经纤维缠结(neurofibrillary tangles,NFTs)和老年斑(senile plaque,SP),其重要病理变化主要有两方面:β淀粉样蛋白(amyloid-β,Aβ)以及高度磷酸化Tau蛋白共同构成的神经纤维缠结NFTs。神经纤维缠结的主要成分是微管相关蛋白Tau。AD患者脑中Tau蛋白过度磷酸化导致其与微管结合能力降低,磷酸化的Tau蛋白聚集形成细胞内的神经纤维缠结,干扰神经元的正常功能,并最终导致神经元的变性与死亡[3,4]。
阿里红为多孔菌科大型真菌阿里红(FomesofficinalisAmes)的子实体,主要分布在我国西北和东北,其中在新疆主要分布于阿勒泰地区。阿里红多糖是阿里红中除三萜酸、甾醇类、黄酮类等之外的又一重要生物活性物质,具有免疫调节及抗衰老活性作用[5]。前期研究已证实,阿里红多糖在传统方法构建的AD模型中均表现出明显的拮抗AD作用,具有一定的防治神经退行性疾病的作用[6]。阿里红多糖组分FOPS-a、FOPS-b是经过阿里红粗多糖纯化后得到的两个组分[7],目前尚未见有关FOPS-a和FOPS-b抗AD的文献报道。本试验拟以FOPS-a、FOPS-b为研究对象,应用APP/PS1双转基因AD模型小鼠[8,9],采用跳台、旷场实验、尼氏染色法、RT-PCR、Western-blot等实验手段,从行为学、组织病理学、分子生物学角度初步探讨阿里红多糖组分FOPS-a和FOPS-b对APP/PS1双转基因小鼠脑部海马区AKT/GSK3β/Tau/P-tau蛋白表达的影响,为阿里红多糖类成分防治AD的作用提供参考数据。
1 试药与仪器
1.1 试药
阿里红多糖组分FOPS-a与FOPS-b由课题组自制;盐酸多奈哌齐(批号1704021,卫材药业有限公司);Total RNA提取试剂(批号AI21584A,日本TAKARA公司)、荧光定量试剂(批号AJ11523A,日本TAKARA公司)、逆转录试剂(批号AJ12435A),日本TAKARA公司);SDS-PAGE凝胶制备试剂盒(批号20181218,北京索莱宝有限公司)。20×TBST(批号20190605,北京索莱宝有限公司);脱脂奶粉(批号EZ3456D330,);吐温20(批号308P013, 北京索莱宝有限公司)。AKT兔抗单克隆抗体(批号GR3235334-3,abcam公司);GSK3β兔抗单克隆抗体(批号GR312697-15,abcam公司);Tau兔抗单克隆抗体(批号GR64/32-4,abcam公司);P-tau兔抗单克隆抗体(批号GR303639-20,abcam公司);HRP 标记山羊抗兔二抗(批号 20190321,CST公司)。
1.2 动物
64只APP/PS1双转基因小鼠,雄性,3月龄,体重25±5 g,购买于北京华阜康实验动物有限公司,许可证号:SCXK(京)2014-0004。同月龄同背景的C57BL/6J小鼠8只,购自新疆医科大学动物实验中心,使用许可证编号:SYXK(新)2016-0002。小鼠全部饲养于新疆医科大学动物实验中心SPF级动物房4-6室,单笼单只饲养,每周换一次垫料和水。室温20-25℃,湿度40%-60%,适应性饲养1周后开始实验,实验过程中动物自由摄食与饮水。
1.3 仪器
DT-200小鼠跳台测试仪(成都泰盟科技有限公司);OFT-100大小鼠开场活动实验系统(成都泰盟科技有限公司);TP-114电子天平(北京Sartorius公司);匀浆机(上海博讯公司);低温冷冻高速离心机(美国Thermo Scientific公司),全波长酶标仪(美国Thermo Scientific公司);CO2恒温培养箱(美国thermo公司);RM2016病理切片机(德国Leica公司);凝胶电泳及转膜设备(美国BIO-RAD公司);DM4000荧光倒置显微镜(德国Leica公司)。
2 方法
2.1 动物分组及给药
64只APP/PS1 双转基因小鼠随机分为模型组、多奈哌齐组(每日灌胃剂量为0.65 mg/kg)、阿里红多糖组分(FOPS-a和FOPS-b)高、中、低剂量组(每日灌胃剂量分别为60、30、15 mg/kg)每组8只。8只C57BL/6J小鼠作为正常对照组,模型组和正常对照组给予等体积的生理盐水灌胃。与3月龄时对各组小鼠实施灌胃治疗,每天上午灌胃1次,连续灌胃90天。
2.2 跳台行为学实验
小鼠跳台装置为一个长方形反射箱,大小为 20 cm×20 cm×30 cm,用黑色塑料板分隔成为6间。底面铺以间距为5 mm可通交流电的铜栅。每间左后放置一高3.2 cm、直径4.5 cm的绝缘橡胶站台[10,11]。小鼠位于站台上可免受电击,当小鼠跳下站台时,则遭受到 24 V电击刺激。本实验连续进行两天,第一天为适应学习阶段,首先将小鼠放入跳箱中熟悉周围环境自由活动3 min,随后通24 V的交流电,持续5 min。小鼠受到电击后其正常反应是跳上站台以躲避伤害性刺激,多数动物可能会再次或多次跳至网栅上,受到电击后又迅速跳回站台。记录每只小鼠第一次跳下站台的时间(即潜伏期)和受到电击的次数(即错误次数)。第2天为实验阶段,即记忆保持阶段。(实验前无需再适应)直接将小鼠放置于站台上,同时通电观察,记录小鼠第一次跳下站台的潜伏期和5 min内的错误次数。
2.3 旷场实验
旷场实验以实验动物在新奇的环境中某些行为学的发生频率和持续时间为指标,反应实验动物在陌生环境中的自主和探究行为[12,13]。旷场实验装置为长50 cm,宽50 cm,高40 cm的实验箱,箱底部由外向内化分为边缘区、中间区、中心区三部分:边缘区距离旷场边缘8 cm,中心区占总区域面积的16%,剩余为中间区。摄像头置于中心区正上方。实验时将小鼠背靠箱壁投放于固定边缘区,实验人员远离旷场箱,小鼠自主活动同时进行摄像5 min。记录小鼠在旷场中的站立次数(即两前肢离地1 cm的次数),水平运动距离。实验室保持安静,光线均匀。
2.4 脑组织取材及石蜡包埋
行为学实验结束后,使用10%水合氯醛麻醉小鼠将其固定在泡沫板上。用消毒后镊子和小剪刀打开胸腔暴露出心脏和肝脏,先用装有生理盐水注射器的针头小心插入小鼠左心室进行灌注,同时去除肝脏使血液流出,待小鼠舌头变白再用4%多聚甲醛灌流固定完全后迅速取出全脑。在冰袋上分离左右脑,一半脑浸在甲醛固定液中,一半脑分离出海马放入冻存管中,液氮迅速冷冻后移入-80℃冰箱冻存,用于Western blot等分子生物学指标检测。石蜡包埋前取出固定液中脑组织,用刀片剔除海马区周围多余组织,制作厚度为0.5 cm的海马冠状切片放入包埋盒。流水清洗30 min→蒸馏水清洗3遍(每遍3-5 min)→75%乙醇浸泡(过夜)→95%乙醇Ⅰ(1 h)→95%乙醇Ⅱ(1 h)→无水乙醇Ⅰ(1 h)→无水乙醇Ⅱ(1 h)→二甲苯透明液Ⅰ(15 min)→二甲苯透明液Ⅱ(15 min)→浸蜡Ⅰ(1 h)→浸蜡Ⅱ(1 h)。包埋后连续在海马冠状区切片。切下的薄片容易皱折,需放到热水中烫平后再贴到载玻片上,置于45 ℃恒温箱中烘干,常温保存,用于病理学检测。
2.5 尼氏染色
尼氏染色前需将选取的每组切片脱蜡。于45 ℃烘箱干燥1 h后,将切片放入二甲苯脱去切片中石蜡,再经由无水乙醇(5 s)→95%乙醇Ⅰ(5 s)→95%乙醇Ⅱ(5 s)→80%乙醇(5 s)→蒸馏水清洗(3~5次),使用尼氏染色试剂盒染色,染色后的切片由无水乙醇脱水后,再经二甲苯透明滴上中性树胶,盖上盖玻片封固,置光镜下观察[14]。
2.6 RT-PCR分析mRNA表达
自-80 ℃冰箱中取出海马组织块,置经冰预冷的研钵中。按0.1 g∶1 mL 比例加入Trizol溶液,迅速研磨,将海马粉末加入无菌的1.5 mL离心管中按试剂盒说明书操作提取。酶标仪测定经稀释的RNA提取物的A值和浓度、RNA的体外反转与RT-PCR。反应条件为95 ℃预变性30 s,95 ℃变性5 s,60 ℃延伸34 s,扩增40个循环,以β-actin为内参[15]。

表1 引物序列
2.7 Western-blot法检测小鼠海马区AKT、GSK3β、Tau、P-tau蛋白表达
用镊子取出冻存管中海马组织并移入预冷研钵里,迅速倒入少许液氮冷冻组织成块,按1∶5比例加入混合裂解液(RIPA裂解液、蛋白酶抑制剂、磷酸酶抑制剂)快速研磨组织,期间可加入2~3次液氮,保证低温环境。直至组织全部融于裂解液中,从研钵中吸取研磨混合液至1.5 mL EP管,放入冰盒静置15 min,使组织充分裂解。4 ℃ 12 000 rpm低温离心30 min,取上清液按照BCA蛋白定量试剂盒测定蛋白提取含量[16-18]。根据蛋白浓度按照1∶4比例加入4×上样缓冲液(loading buffer),加入水补充至终体积,混匀后煮蛋白(100 ℃,10 min)。冷却室温后放置-20 ℃冰箱保存。检测时,经SDS-PAGE凝胶试剂盒制胶→上样→加入电泳液(4块胶电泳液加满电泳槽,2块胶可加1/2电泳液)→放置冰盒中电泳(浓缩胶80 V,30 min,分离胶120 V,90 min)→转膜(300 mA,70 min)→1×TBST(洗膜液)10 min,3次→脱脂牛奶封闭(2 h)→1×TBST(洗膜液)10 min,3次→一抗孵育(于4 ℃冰箱摇床上,过夜)→1×TBST(洗膜液)10 min,3次→二抗孵育(2 h)→1×TBST(洗膜液)10 min,3次→滴加显色液→曝光(凝胶成像分析系统扫描),用Image J软件定量分析目的蛋白条带,进行灰度分析[16]。结果以(目的蛋白灰度值/内参灰度值)×100%表示。其中AKT、GSK3β、Tau、P-tau、β-actin抗体稀释浓度分别为1∶10 000、1∶5 000、1∶8 000、1∶8 000、1∶5 000,二抗稀释浓度为1∶5 000。
2.8 数据统计学分析
3 实验结果
3.1 跳台行为学实验结果
各组小鼠跳台实验潜伏期和错误次数比较结果如表2所示,与模型组相比,FOPS-a高、中剂量组和FOPS-b高剂量组小鼠的反应期明显缩短,潜伏期明显延长,错误次数明显减少,有显著的统计学意义(P<0.01);FOPS-b中(30 mg/kg)剂量组反应期缩短,潜伏期延长,错误次数减少有统计学意义(P<0.05)。结果提示FOPS-a与FOPS-b组分对AD模型小鼠学习记忆能力有一定的改善作用。
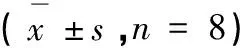
表2 FOPS-a与FOPS-b对跳台实验结果的影响
注:与正常组比较,##P<0.01,#P<0.05;与模型组比较**P<0.01,*P<0.05。
Note:Compared with normal,##P<0.01,#P<0.05;Compared with model,**P<0.01,*P<0.05.
3.2 旷场实验检测结果
由表3可知,与正常组比较,模型组水平运动距离与站立次数显著减少(P<0.01);与模型组小鼠相比,FOPS-a与FOPS-b高(60 mg/kg)、中(30 mg/kg)剂量组水平运动距离和站立次数明显增多,有显著的统计学意义(P<0.01),低剂量组(15 mg/kg)有统计学差异(P<0.05)。表明FOPS-a与FOPS-b能够提高小鼠的运动及空间探索能力,并具有一定的剂量依赖性。

表3 FOPS-a与FOPS-b对旷场实验的影响
注:与对照组比较,##P<0.01,#P<0.05;与模型组比较**P<0.01,*P<0.05。
Note:Compared with normal,##P<0.01,#P<0.05;Compared with model,**P<0.01,*P<0.05.
3.3 尼氏染色实验结果
尼氏染色结果可见正常组的神经元数目较多,排列紧凑有序,细胞结构形态正常,结构清晰,胞质中尼氏体丰富、细胞核淡蓝色,背景略呈浅蓝色,核仁清晰可见。模型组小鼠神经元水肿,细胞数量明显减少,细胞间隙增大,排列稀疏且分布紊乱、松散,无明显层次,细胞体积减小萎缩,胞浆内尼氏体减少,分界不清,核固缩,使得着色加深。与模型组相比较,多奈哌齐组、FOPS-a与FOPS-b药物高、中、低各剂量组的小鼠海马区神经细胞形态有不同程度的改善,神经元水肿减轻,细胞数量相对增多,排量较为整齐,分界清晰。
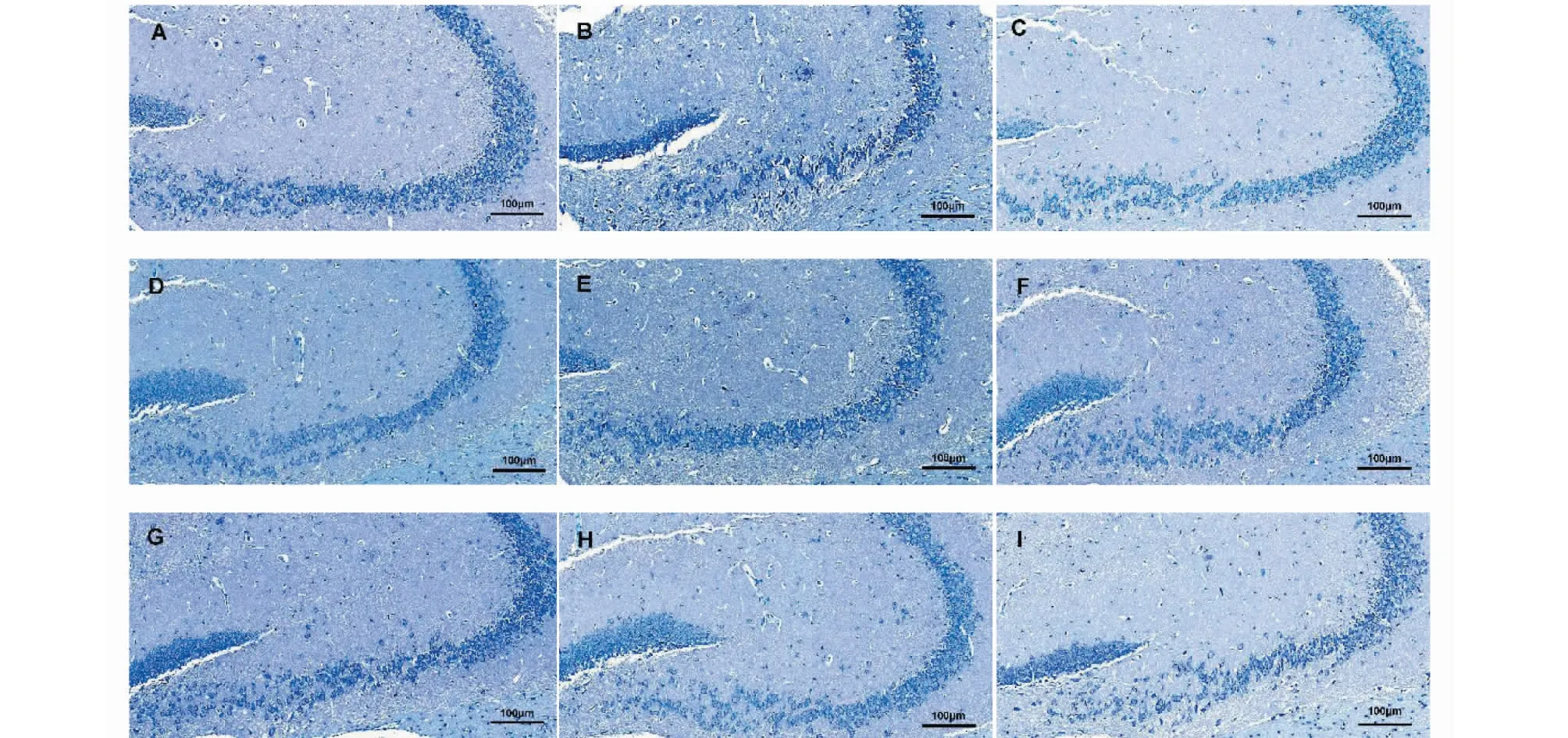
图1 组小鼠海马区神经元尼氏染色(×20.0)Fig.1 Nissl staining of hippocampus in each group of mice(×20.0)注:A正常组,B模型组,C多奈哌齐组,D阿里红多糖a组分高剂量组,E阿里红多糖a组分中剂量组,F阿里红多糖a组分低剂量组,G阿里红多糖b组分高剂量组,H阿里红多糖b组分中剂量组,I阿里红多糖b组分低剂量组。下同。Note:A is normal,B is model,C is Donepezil,D is FOPS-a-H,E is FOPS-a-M,F is FOPS-a-L,G is FOPS-b-H,H is FOPS-b-M,I is FOPS-b-L,the same below.
3.4 RT-PCR检测结果
RT-PCR法检测小鼠海马区相关mRNA转录水平的结果表明,与对照组比较,模型组GSK3β、Tau mRNA表达均升高(P<0.01),AKT mRNA表达降低(P<0.01);与模型组相比,多奈哌齐剂量组、FOPS-a与FOPS-b高(60 mg/kg)剂量组GSK3β、Tau mRNA的表达量均降低(P<0.01,P<0.05),AKT mRNA表达量升高(P<0.01,P<0.05); 结果表明FOPS-a与FOPS-b可提高AKT的表达量并抑制GSK3β、Tau mRNA的表达。

表4 FOPS-a与FOPS-b对海马区AKT、GSK3β、Tau mRNA表达的影响
注:与对照组比较,##P<0.01,#P<0.05;与模型组比较,**P<0.01,*P<0.05。
Note:Compared with normal,##P<0.01,#P<0.05;Compared with model,**P<0.01,*P<0.05.
3.5 Western-blot检测结果
Western-blot法检测结果表明,与对照组比较,模型组小鼠海马区GSK3β、Tau、P-tau蛋白的表达量均上调(P<0.01),AKT蛋白表达显著下调(P<0.01);与模型组比较,FOPS-a与FOPS-b高(60 mg/kg)、中(30 mg/kg)剂量组小鼠海马GSK3β、Tau、P-tau蛋白的表达量均明显下调(P<0.01),AKT蛋白表达显著上调(P<0.01)。提示FOPS-a与FOPS-b能够提高上游蛋白AKT的表达量,阻碍下游GSK3β、Tau、P-tau蛋白的表达,拮抗AD的发展。
4 讨论
AD是一种以智力缓慢进行性丧失为特征的神经退行性疾病,是发生在中枢神经的一种病因复杂的原发性疾病。主要临床表现为认知功能障碍和记忆功能减退。由于 AD 的发病机制较复杂,研究者形成了众多不同的假说,其中Aβ淀粉样学说和Tau蛋白学说是目前比较公认的AD发病机制[19]。而 APP/PS1转基因小鼠模型是经典的 AD 转基因动物模型之一,能够较好的模拟AD患者早期病理和行为特征[20]。
本研究观察了FOPS-a与FOPS-b对 APP/PS1转基因小鼠学习记忆改善作用。在实验中,对小鼠认知功能的评估,我们采取了跳台实验和旷场实验。跳台实验是一种抑制性被动回避实验,在记忆研究中,动物模型最重要的特点是抑制模仿活动或学习习惯。被动回避实验通过动物学会去掉某种特定的行为而逃避某种厌恶的事情。跳台实验中,转基因对照组小鼠第一次穿越原平台的时间较野生型小鼠明显延长(P<0.05),而穿越平台次数比野生型小鼠明显减少(P<0.01),FOPS-a与FOPS-b高、中(60和30 mg/kg)剂量组与模型组相比,学习与记忆成绩有不同程度提高。由于啮齿类动物具体有趋触性,指小鼠畏惧开阔、未知、可能存在潜在危险的场所,因而行为表现出“贴墙”活动的特性。旷场测试结果表明,模型组小鼠自主活动以四角和边缘探索为主,而FOPS-a与FOPS-b高剂量组较模型组相比,表现为多以向中心探索为主。
海马是研究人类和动物学习记忆功能的重要脑区,AD患者的主要临床症状是陈述性记忆受损,这与患者海马神经元结构改变密切相关。尼氏体是神经元的特征性结构,在正常的生理情况下,尼氏体大而多,在神经细胞中合成蛋白的功能较强,在病理情况下,由于神经元的损伤,尼氏体数量减少甚至消失。尼氏染色结果表明,模型组小鼠的神经细胞受损严重,甚至变形萎缩。FOPS-a与FOPS-b不同剂量组相比于模型组对抑制神经元损伤有不同程度的改善作用。
Tau及P-tau蛋白是目前了解AD发病机制的热点靶标之一。研究发现与P-tau的形成最为相关的是参与调节Tau蛋白异常磷酸化的激酶:糖原合成激酶3β(GSK-3β)。其异常激活会导致 Tau 蛋白过度磷酸化[21,22]。AKT蛋白是参与调控GSK3β的活性的主要蛋白,当AKT蛋白合成障碍时,对GSK3β抑制作用下降,GSK3β失去控制被激活促使Tau蛋白异常磷酸化聚集成螺旋丝最终形成纤维缠结。RT-PCR与Western-blot法检测AKT、GSK3β、Tau、P-tau蛋白的结果表明:FOPS-a与FOPS-b能明显下调GSK3β、Tau、P-tau的表达量,上调AKT蛋白表达,通过减少神经元的受损,拮抗AD的发展过程。
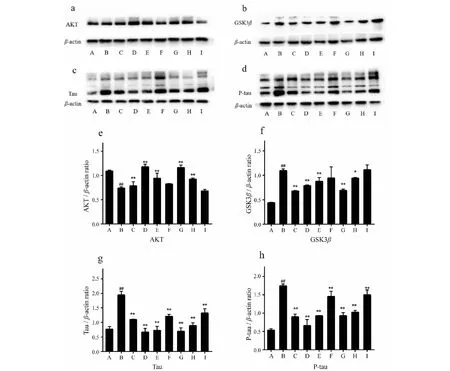
图2 FOPS-a与FOPS-b对海马区AKT、GSK3β、Tau、P-tau蛋白表达的影响Fig.2 Effects of FOP component on expression of AKT、GSK3β、Tau、P-tau protein in hippocampus注:与对照组比较,##P<0.01,#P<0.05;与模型组比较,**P<0.01,*P<0.05;a和e是AKT的蛋白表达,b和f是GSK3β蛋白的表达,c和g是Tau蛋白的表达,d和h是P-tau蛋白的表达。Note:Compared with normal,##P<0.01,#P<0.05;Compared with model,**P<0.01,*P<0.05;a and e are AKT protein expressions,b and f are GSK3β protein expressions,c and g are Tau protein expressions,d and h are P-tau protein expressions.
综上所述,经阿里红多糖组分(FOPS-a、FOPS-b)干预后,能有效改善APP/PS1转基因小鼠学习与记忆障碍,降低Tau蛋白的磷酸化,减少神经原纤维缠结,其机制可能是与抑制GSK3β信号通路相关蛋白表达有关。
