N-乙酰半胱氨酸对乙醇诱导张氏肝细胞损伤的保护作用
2020-04-27谢丽丽崔慧娴赵文红
陈 苏,谢丽丽,崔慧娴,赵文红
酒精性肝病(alcoholic liver disease,ALD),又称酒精性肝损伤。ALD是由于长期过量摄入乙醇导致的一种慢性疾病,其危害极大。由于长期过量饮酒后,超过肝脏代偿能力,从而导致肝脏的脂肪变、纤维变甚至最后造成的肝硬化,是现代世界范围严重的公共卫生问题之一。据统计,由于饮酒导致的肝硬化居我国肝硬化病因的次位[1]。众所周知,现嗜酒者数量迅速增加,ALD的患病率现在也是急剧上升,ALD的患病率的增加给国家社会和家庭各方面都带来严重负担[2]。然而目前对于ALD并没有特别有效的防治方法,因此探索发现有效并且机制明确的防治ALD的物质迫在眉睫。
N-乙酰半胱氨酸(NAC)是还原型谷胱甘肽的前体物质,是一种含有硫基的具有抗氧化性的乙酰基衍生物,广泛存在于真核生物体内[3],我们在日常饮食中即可补充,特别是洋葱类[4]这种富含有机硫化物的食物中含量比较丰富。NAC在临床上在呼吸系统和肝脏解毒方面已有应用,随着近年来大量的研究证明,NAC由于具有抗氧化性等广泛的生物活性,且在非酒精性脂肪肝[5]、阻塞性肺疾病(COPD)[6]及精神类疾病[7]治疗方面均有较好效果。
本研究对象人张氏肝细胞是来源于人体非恶性肝组织的一类细胞株,细胞株状态相对稳定,已经在很多实验中得到了广泛应用[9-11]。体外细胞实验一方面具有成本低、周期短等优点,另一方面,在无法进行人体实验以及尊重实验动物的原则之下,可以选择来源于人的正常肝细胞进行体外培养获得相关资料。现阶段并没有关于在细胞水平上探究NAC对乙醇诱导肝细胞损伤保护作用的研究,因此选取此细胞株探究NAC对于乙醇诱导人正常肝细胞损伤是否具有保护作用。
1 材料与方法
1.1 试剂 人张氏肝细胞购自武汉博士德生物工程有限公司;乙醇购自天津市购于精细化工有限公司,纯度>99%;RPMI 1640培养液购自Gibco公司;南美洲胎牛血清购自ExCell;双抗购自Biosharp;NAC、胰酶消化液、活性氧检测试剂盒购自碧云天生物科技研究所;MTT试剂购自Biofoxx生物科技公司。天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)购自南京建成生物工程有限公司;肿瘤坏死因子(TNF-α)、白细胞介素(IL-6)ELISA检测试剂盒购自上海酶联生物科技有限公司。
1.2 仪器设备 细胞培养箱(美国Thermo公司);酶标仪(美国BioTek公司);超声细胞破碎仪(美国Sonics公司);超高速冷冻离心机(美国SIGMA公司),倒置显微镜(日本OLYMPUS公司)。
1.3 方法
1.3.1 细胞培养与分组 将张氏肝细胞使用RPMI1640培养液(含10%胎牛血清,1%双抗)于细胞培养箱进行培养。待细胞数量达到80%~90%时,将细胞消化下来并进行分组,分为对照组(不做任何处理);乙醇损伤组(Hurt组:使用400 mmol/L的乙醇对肝细胞损伤24 h)和NAC预处理保护组[NAC低、中、高剂量组(NAC-L、NAC-M、NAC-H)终浓度分别为1 mmol/L、2 mmol/L和5 mmol/L的NAC进行预处理30 min后,加入乙醇使其终浓度为400 mmol/L并继续干预24 h]。
1.3.2 MTT法测定细胞存活率 待细胞长满培养皿的80%~90%后,用PBS清洗1~2次后将细胞消化下来,细胞(每孔1×105)接种于96孔板中,每孔200 μL,待细胞完全贴壁后,各组按照方法“1.3.1”进行处理,每组设置3个复孔,培养后移除培养液,每孔加入50 μL的MTT,继续培养4 h后,弃去上清液,每孔加入200 μL二甲基亚砜,置于平板摇床上水平摇晃15 min,随后使用酶标仪在490 nm波长处测定吸光度,并计算每组存活率,细胞存活率的计算公式如下:
细胞存活率=样品组吸光度/对照组吸光度× 100%
1.3.3 AST、ALT的测定 收集细胞:1 000 r/min离心10 min,弃上清,留细胞沉淀,加入PBS,冰水浴条件下超声破碎,匀浆液配好混匀后立即测试活性,根据试剂盒说明书步骤操作,测定每个样本的吸光度,最后根据AST、ALT的标准曲线计算出各样本酶活性。
1.3.4 ELISA法测定TNF-α、IL-6水平 按照“1.3.1”项下方法处理细胞后,收集上清液,用超高速冷冻离心机3 000 r/min离心20~30 min,收集离心后的上清液,按照试剂盒说明书要求测定TNF-α、IL-6水平,每组设置3个复孔。
1.3.5 细胞ROS测定 按“1.3.1”项下方法处理细胞后,按照将1∶1 000用无血清培养基进行稀释后安装终浓度为10 mmol/L探针DCFH-DA。 37 ℃孵育20 min后用无血清细胞培养液洗涤细胞3次。用酶标仪在488 nm激发光及525 nm发射光检测每组细胞内的ROS水平。细胞内相对ROS水平=实验组吸OD值/对照组OD值×100%
1.3.6 细胞上清液中LDH的检测 将细胞按照"1.3.1"项下方法处理后收集上清液;将收集到的细胞上清液按照12 000 r,10 min进行离心并且取上清液。按照说明书步骤及所提供试剂测定各样品吸光度,并根据说明书步骤及提供的标准品制作LDH的标准曲线,将测得吸光度带入制作的标准曲线后得到各样品中的LDH水平。
1.3.7 乙醇诱导肝细胞损伤模型的建立 根据不同浓度乙醇损伤肝细胞24 h后细胞的存活率和细胞上清液中LDH含量,并参照相关文献建立损伤模型的方法建立乙醇诱导肝细胞损伤模型。
1.4 统计学方法 采用方差分析和q检验。
2 结果
2.1 肝细胞损伤组乙醇浓度的筛选 本次浓度筛选共设置4组,分别为control组(不作任何处理);乙醇损伤组(各组浓度分别为200 mmol/L、400 mmol/L、500 mmol/L)。当乙醇浓度为400 mmol/L时,乙醇损伤24 h后细胞活力约在75% 左右(P<0.01)。并且在此浓度干预24 h时LDH浓度最高(P<0.01)(见表1),参照刘吉云等[12-13]建立乙醇诱导肝细胞损伤模型的方法,选取乙醇浓度400 mmol/L,作用24 h来建立乙醇诱导肝细胞损伤模型。
2.2 NAC预处理对乙醇诱导的肝细胞存活率的影响 采用MTT检测细胞存活率,不同处理方法处理张氏肝细胞24 h后,预加入NAC的细胞存活率都相对高于Hurt组细胞存活率 (P<0.05~P<0.01),1~5 mmol/L的NAC对乙醇诱导损伤组的细胞存活率都有提高作用(见表2)。
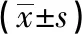

分组n细胞存活率/%LDH/(U/L)对照组3100.00±2.36 182.25±11.91Hurt组 200mmol/L 3100.03±1.11##185.31±12.29## 400 mmol/L375.63±2.84∗∗321.71±9.19∗∗ 500 mmol/L345.16±3.26∗∗##264.19±4.81∗∗## F—319.12135.62 P—<0.01<0.01 MS组内—6.384100.122
q检验:与对照组比较**P<0.01;与400 mmol/L组比较##P<0.01
2.3 细胞形态学变化观察 各组细胞于倒置显微镜下观察,对照组细胞呈椭圆形或多角形,明显可见突触,贴壁生长。经乙醇处理后,可见一些细胞开始变圆,边界遮光性差,贴壁状态差有细胞出现漂浮死亡。NAC处理组可见细胞死亡变圆细胞减少,存活细胞增多(见图1)。
2.4 NAC预处理对肝细胞中AST、ALT含量的影响 NAC干预组与Hurt组相比细胞AST、ALT含量均下降(P<0.05),说明NAC在1~5 mmol/L的范围内均可以降低AST和ALT的含量(见表2)。
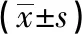
表2 各组细胞存活率及细胞内AST、ALT含量
q检验:与对照组比较*P<0.05,**P<0.01;与Hurt组比较#P<0.05,##P<0.01
2.5 NAC预处理对细胞中TNF-α、IL-6水平的影响 NAC干预组细胞上清液中TNF-α、IL-6含量均低于Hurt组(P<0.05),说明NAC在1~5 mmol/L的范围内都可以降低上清液中TNF-α和IL-6的含量,TNF-α、IL-6随NAC浓度的增高而降低(见表3)。
2.6 细胞内ROS的水平 NAC干预后的各组细胞内ROS水平均低于Hurt组 (P<0.05),NAC在1~5 mmol/L的范围内都可以降低细胞中由于乙醇损伤导致的ROS,随NAC剂量的升高,细胞内ROS的水平逐渐减少(P<0.01)(见表3)。
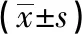

分组nTNF-α/(ng/L) IL-6/(ng/L) 相对ROS水平/% 对照组351.58±1.59 132.36±3.87 100.00±9.83 Hurt组383.33±5.82∗∗210.56±7.03∗∗535.36±28.27∗∗NAC-L组364.76±3.74∗∗##194.04±14.42∗∗#343.73±40.64∗∗##NAC-M组361.67±1.38∗∗##163.06±5.90∗∗##138.02±15.68##NAC-H组354.17±1.76##158.06±7.50∗∗##117.87±18.82##F—42.45 39.40 204.70 P—<0.01 <0.01 <0.01 MS组内—11.071 72.672 516.580
q检验:与对照组比较**P<0.01;与Hurt组比较#P<0.01,##P<0.01
3 讨论
肝脏是人体最大的代谢场所,所以肝脏的健康状态对于人体健康有着至关重要的影响,探索不同物质对各种类型肝脏损伤的保护作用及机制一直是世界性的热点问题,也是一直以来的难题。ALD是一种由于长期或者少次大量饮酒造成的一种代谢类疾病,饮酒对于肝脏造成的损伤极大,可以由脂肪肝、肝纤维化发展到肝硬化,严重大量酗酒甚至可以造成肝衰竭[14]。目前已知ALD的发生机制较为复杂,现在对于其机制的研究已经涉及氧化应激机制、免疫机制、营养机制等,但是却没有找到明确的防治营养素或者药物对ALD有特别疗效。2016年,全球1 100万死亡病例中,约有40万例是由乙醇引起的,同时,乙醇会增加肝硬化和胰腺炎的风险[15],估计有63.7万人死于消化系统疾病,其中由于酒精性肝硬化死亡60.7万人[16]。
肝脏酶学指标可反映肝脏的基本情况,常用来评价肝脏损伤发生情况,而在肝脏酶学指标中,通常使用ALT和AST反映肝细胞损伤程度,现在也有很多研究在探究两者比值对于评价肝损伤是否更加敏感,在临床应用时是否对肝损伤程度反映更加敏感。ALT主要存在肝细胞胞质内,而绝大部分的AST分布在线粒体中[17]。所以本研究采用将细胞破裂并制作成匀浆的方式,检测细胞内的AST、ALT水平。本研究结果表明,在乙醇损伤肝细胞模型中,AST和ALT水平都出现明显的升高,加入NAC干预后,AST和ALT明显下降,说明NAC对乙醇诱导的肝细胞的损伤有较好的保护作用,这与的KISAOGLU等[18-20]的研究“补充NAC可以明显减低由于如脂多糖、氨基酚类化合物等物质导致的AST、ALT的升高”相一致。炎症因子可以评价肝脏受到损伤后的炎症反映水平。长期接触乙醇对诱发和促进酒精性肝损伤有促进作用。它可以激活先天免疫和产生促炎细胞因子TNF-α[21]。肝脏受到损伤后炎症因子TNF-α敏感度相对较高[22],并且对细胞的炎症状态有着非常重要的影响。一方面,乙醇刺激肝脏后可以产生促炎因子TNF-α等,其可以通过多种方式调节细胞的激活和增殖、细胞毒性、细胞凋亡等生理活动[23];另一方面TNF-α可以直接激活NF-κB信号通路,促进IL-6等促炎因子的产生[24-25],进一步加重机体炎症反应。促炎因子IL-6也与肝脏的损伤程度有着密切的关系。根据本研究发现,经过乙醇损伤的肝细胞TNF-α和IL-6的水平都显著上升,但经过NAC干预后两个指标都出现了显著的下降,说明NAC能在一定程度上改善乙醇诱导肝细胞损伤后的炎症状态,这与ASLAN等[26-27]的研究“体内体外实验NAC可以在一定程度上可以改善肝脏损伤的炎症状态,NAC通过减轻氧化应激损伤来缓解炎症反应等”相一致。氧化应激反应是多种肝脏疾病的共同病理基础,在正常条件下,人体氧化系统和抗氧化系统维持在平衡状态,但当肝脏长期摄入乙醇时,导致肝脏内氧化系统和抗氧化系统遭到破坏,体内的ROS和活性氮堆积造成肝脏损伤[28],还可以进一步造成脂质过氧化进一步加重肝脏损伤[29]。ROS代表是反应氧化应激的重要指标,ROS在肝脏中过量累积会造成肝脏中谷胱甘肽、超氧化物歧化酶等抗氧化物含量的下降,氧自由基的增加[30],以及会诱导以TNF-α为主的细胞因子的产生加重炎症反应[31]。本研究表明,NAC可以有效的抑制和减少由于乙醇诱导肝细胞损伤所产生的ROS。经NAC干预后,细胞的存活率出现了明显的增加,说明NAC可能通过抑制细胞凋亡来保护乙醇诱导的肝细胞损伤。
综上所述,NAC可能通过减轻乙醇诱导肝细胞炎症反应,减轻氧化应激和抑制乙醇诱导的肝细胞凋亡,从而起到对乙醇诱导的肝细胞损伤的保护作用。目前,对ALD并没有明确有效的防治方法,其最根本的方法还是戒酒,此研究在细胞水平上探究了NAC可能通过减轻炎症反应,降低氧化应激水平和阻止细胞凋亡这几个方面起到对肝细胞的保护作用,为以后的相关研究提供佐证,但其具体的分子机制还需要进一步的探究。
