酒地黄炮制过程中4种活性成分含量变化
2020-04-26朱逸超任娟仇雪呼木吉勒图蔡宝昌郑艳萍
朱逸超 任娟 仇雪 呼木吉勒图 蔡宝昌 郑艳萍


摘要:目的 建立地黃“九蒸九晒”过程中4种活性成分HPLC检测方法,探索酒地黄炮制过程中活性成分的含量变化。方法 采用YMC-Pack ODS-A色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.1%磷酸水溶液为流动相,梯度洗脱,流速1 mL/min,检测波长203、334 nm,柱温35 ℃,测定酒地黄炮制过程中梓醇、毛蕊花糖苷、地黄苷D和益母草苷含量。结果 建立了地黄“九蒸九晒”过程中4种活性成分HPLC检测方法;梓醇、毛蕊花糖苷、地黄苷D和益母草苷在各自范围内线性关系良好(r均大于0.999),精密度、稳定性、重复性良好(RSD均小于2.5%),平均加样回收率为97%~101%(RSD<2%)。梓醇、地黄苷D和益母草苷含量随蒸制次数增加而不同程度下降。结论 本研究初步探索了地黄炮制过程中4种活性成分的变化过程,所建立的方法稳定可靠。
关键词:熟地黄;梓醇;毛蕊花糖苷;地黄苷D;益母草苷;炮制;高效液相色谱法
中图分类号:R284.1 文献标识码:A 文章编号:1005-5304(2020)02-0048-05
DOI:10.3969/j.issn.1005-5304.201903351 开放科学(资源服务)标识码(OSID):
Changes of Contents of Four Active Components in Processing of
Rehmanniae Radix Roasting with Wine
ZHU Yichao1, REN Juan1, QIU Xue1, Humujiletu2, CAI Baochang3, ZHENG Yanping3
1. Jiangsu Provincial Hospital of Traditional Chinese Medicine, Nanjing 210000, China;
2. Inner Mongolia Academy of Forestry, Huhehaote 010010, China;
3. Nanjing Haichang Chinese Medicine Group Co., Ltd., Nanjing 210061, China
Abstract: Objective To establish an HPLC method for the content determination of four active components in the processing of “nine steaming and nine drying” for Rehmanniae Radix; To explore the changes of active components in the processing of Rehmanniae Radix roasting with wine. Methods YMC-Pack ODS-A column (4.6 mm × 250 mm, 5 μm) was used; the mobile phase was eluted with a gradient of acetonitrile-0.1% phosphoric acid; the flow rate was 1 mL/min; the detection wavelength was 203 and 334 nm; the column temperature was 35 ℃. The contents of sterol, verbascoside, rehmannioside D and motherwort in the processing of Rehmanniae Radix roasting with wine were analyzed. Results The HPLC method for the determination of four active components in the processing of “nine steaming and nine drying” was built; the linear relationship of sterol, verbascoside, rehmannioside D and motherwort in respective range was good (r was greater than 0.999); the precision, stability and repeatability were good (RSD was all less than 2.5%), and the average sample recovery was 97% to 101% (RSD<2%). The contents of sterol, rehmannioside D and motherwort decreased in different degree with increase of steaming times. Conclusion The method is stable and reliable, and initially explores the changing process of four active components in the processing of Radix Rehmanniae roasting with wine.
Keywords: Rehmanniae Radix Praeparata; sterols; verbascoside; rehmannioside D; motherwort; processing; HPLC
地黄为玄参科植物地黄Rehmannia glutinosa Libosch.的新鲜或干燥块根[1],生地黄炮制后药性由寒转温,作用由清转补,味由苦转甜。生地黄清热凉血、养阴生津,熟地黄滋阴补血。汉代有蒸后取汁法,南北朝有蒸焙,隋唐时期有酒拌蒸、蒸爆九遍、酒炒等法,宋代有炒炭、醋炒、生姜同炒等法[2]。酒制是地黄传统炮制方法之一,依据古法记载,需“九蒸九晒”才能得到质量上乘的熟地黄[3-4]。由于现代炮制设备的改进,提高蒸制温度和控制真空度,地黄炮制工艺简化,产品控制多以“黑如漆,甜如饴”等笼统性状变化作为达到炮制终点的判断标准,缺乏客观检测指标[5-6]。本课题组在地黄“九蒸九晒”炮制过程中的不同时间点进行取样,采用HPLC对地黄炮制过程中样品的4种活性成分梓醇、毛蕊花糖苷、地黄苷D和益母草苷进行含量测定,辅以感官判断,探索地黄酒制过程中的活性成分变化。
1 仪器与试药
Shimadzu LC-20AB高效液相色谱系统,包括在线脱气机、Prominence SIL-20A自动进样器、SPD-M20A二极管阵列检测器和CTO-20A柱温箱,日本岛津公司;ME204E十万分之一电子分析天平,梅特勒-托利多国际股份有限公司;BSM220.4万分之一分析天平,上海卓精公司;DSX-18L高压灭菌锅,上海申安器材有限公司;GVS型超声波清洗器,深圳市够威科技有限公司;DY-20流水式中药打粉机,温岭市奥力中药器械有限公司;DHG-9140A型立式电热恒温鼓风干燥箱,上海精宏器材有限公司。
对照品毛蕊花糖苷(批号61276-17-3,纯度≥98%)、益母草苷(批号52949-83-4,纯度≥98%)、地黄苷D(批号81720-08-3,纯度≥98%)、梓醇(批号2415-24-9,纯度≥98%),南京森贝伽生物科技有限公司。3批生地黄样品分别购自河南省永鑫堂中药饮片科技有限公司、安徽沪谯中药有限公司和浙江桐君堂中药饮片有限公司,经南京海源中药饮片有限公司中药师丁斐鉴定为玄参科植物地黄Rehmannia glutinosa Libosch.的干燥块根。GB/T 13662黄酒,浙江古越龙山绍兴酒股份有限公司。乙腈、甲醇均为色谱纯,水为超纯水,磷酸为分析纯。
2 方法与结果
2.1 不同蒸晒次数样品制备
第1日:3批样品各取2 kg,洗净外表泥沙,晒干备用;称取0.4 kg黄酒,拌匀,装罐,密封闷润24 h。第2日:将3批样品分别入锅隔水蒸8 h,设置水温为100 ℃。第3日:将3批样品分别置于日光下放晾晒干,以此为“一蒸一晒”。如此反复8次,共16 d,闷润过程以1 d计,合计17 d。第18日将3批样品入锅隔水蒸制8 h,取出放晾晒干,即为地黄“九蒸九晒”炮制全过程。3批样品炮制期间每“一蒸一晒”分别称取50 g留样,编号为S1~S9[7-9]。
2.2 色谱条件
采用Kromasil 100-5C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈(A)-0.1%磷酸水(B),梯度洗脫(0~5 min,2%A;5~20 min,20%A;20~25 min,30%A;25~40 min,30%A;40~45 min,2%A;45~50 min,2%A),检测波长203、334 nm,柱温35 ℃,进样量20 μL。
2.3 溶液制备
2.3.1 对照品溶液
分别取毛蕊花糖苷、梓醇、地黄苷D、益母草苷对照品适量,精密称定,置于10 mL容量瓶中,加甲醇配成浓度分别为498、494、486、650 μg/mL的对照品贮备液,置4 ℃冰箱保存备用。分别精密吸取上述对照品溶液适量,加甲醇定容至10 mL,制成每1 mL含毛蕊花糖苷、梓醇、地黄苷D、益母草苷分别为49.80、98.80、97.20、130.00 μg的混合对照品溶液。
2.3.2 供试品溶液
取炮制过程中不同时间点的样品(S1~S9)各50 g,置于80 ℃烘箱中干燥8 h,放入干燥器内冷却,打粉,过24目筛,备用。精密称取粗粉2.0 g,置于50 mL具塞锥形瓶中,加入精密量取的50%甲醇25 mL,超声(功率300 W,频率40 Hz)处理1 h,取出,放至室温,再次称定质量,用50%甲醇补足减失的质量,取上清液5 mL,8000 r/min离心10 min,用0.45 μm微孔滤膜过滤,即得供试品溶液,置4 ℃冰箱保存备用。
2.4 系统适用性试验
取混合对照品溶液和供试品溶液,按“2.2”项下色谱条件分别进样20 μL,各成分色谱峰分离良好,色谱图见图1。
2.5 线性关系考察
精密吸取含毛蕊花糖苷(49.80 μg/mL)、梓醇(98.80 μg/mL)、地黄苷D(97.20 μg/mL)和益母草苷(130.00 μg/mL)的混合对照品溶液2、5、10、15、20、25 μL,按“2.2”项下色谱条件测定,记录峰面积,以峰面积对进样量进行线性回归,结果显示各成分在各自范围内线性关系良好,见表1。
2.6 精密度试验
精密吸取上述混合对照品溶液,按“2.2”项下色谱条件连续进样6次,记录峰面积,测得毛蕊花糖苷、梓醇、地黄苷D、益母草苷峰面积RSD分别为0.27%、0.55%、1.07%、0.77%,表明仪器精密度良好。
2.7 重复性试验
精密称取同一批熟地黄样品粉末6份,按“2.3.2”项下方法制备供试品溶液,分别测定,记录色谱图,结果毛蕊花糖苷、梓醇、地黄苷D、益母草苷RSD分别为1.29%、1.15%、1.88%、2.44%,表明本试验方法重复性良好。
2.8 稳定性试验
精密吸取同一供试品溶液,分别于制备后0、2、4、8、12、24 h进样,记录峰面积,结果毛蕊花糖苷、梓醇、地黄苷D、益母草苷RSD分别为2.36%、0.95%、1.78%、2.48%,表明供试品溶液在24 h内稳定。
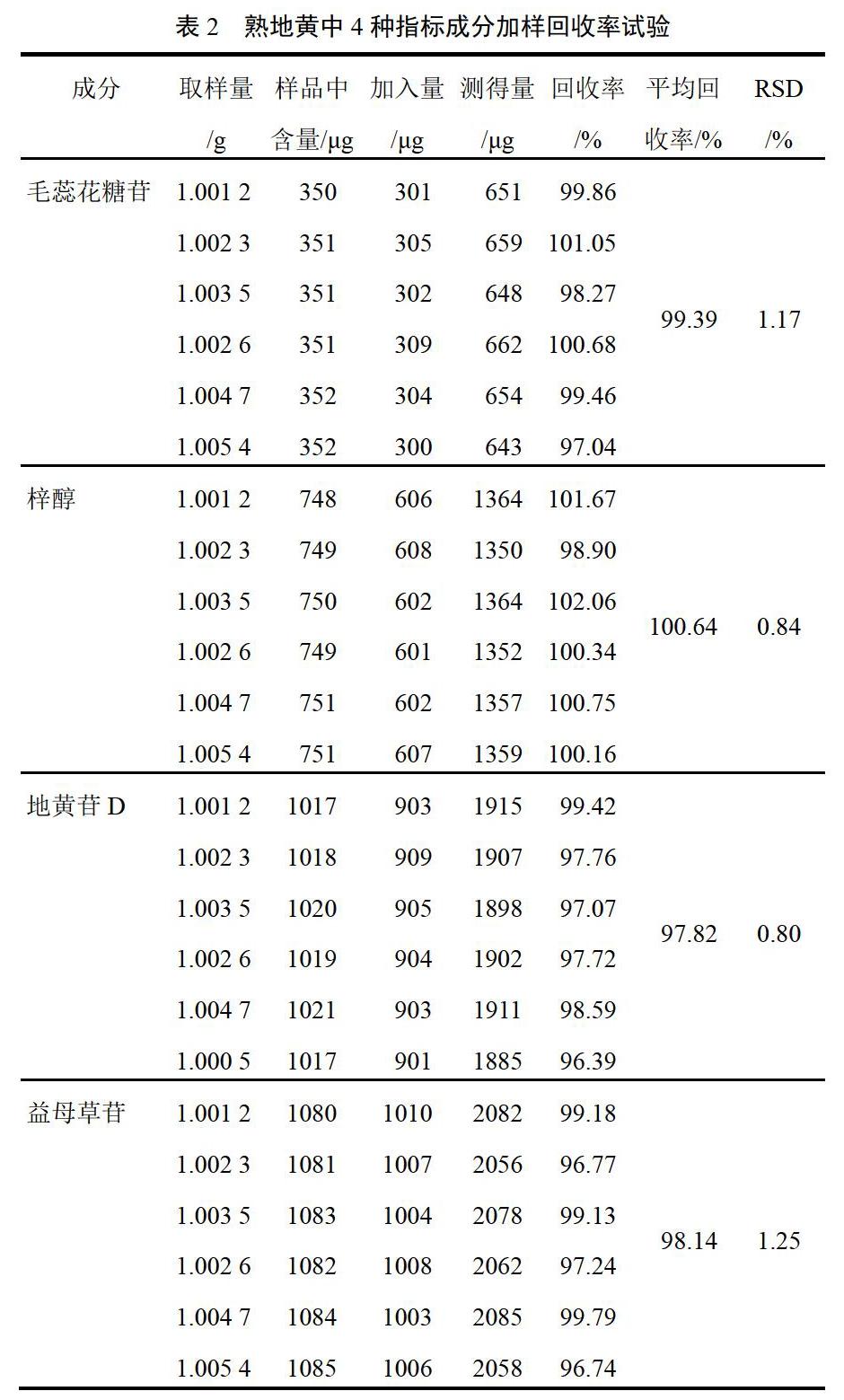
2.9 加样回收率试验
分别精密称取同一批熟地黄样品粉末6份,各1.0 g,分别置于锥形瓶中,精密加入毛蕊花糖苷0.3 mg、梓醇0.6 mg、地黄苷D 0.9 mg、益母草苷1.0 mg,按“2.3.2”项下方法制备供试品溶液,按“2.2”项下色谱条件测定,计算各成分的平均回收率及RSD,结果见表2。
2.10 样品测定
取不同来源地黄的不同蒸晒次数炮制样品(编号S1~S9分别对应“一蒸一晒”至“九蒸九晒”样品)及生地黄样品(编号S0)粉末,分别称取2 g,精密称定,按“2.3.2”项下方法制备供试品溶液,按“2.2”项下色谱条件进样测定,计算各样品中毛蕊花糖苷、梓醇、地黄苷D、益母草苷含量。3批地黄不同蒸晒次数炮制样品中指标成分含量比较见表3。
3 讨论
本试验在考察毛蕊花糖苷、梓醇、地黄苷D和益母草苷4种被测成分与杂质峰的分离情况时,比较了乙腈-0.1%磷酸水溶液、乙腈-0.1%甲酸水、乙腈-水为流动相的梯度洗脱效果,结果显示,以乙腈-0.1%磷酸水为流动相时峰形较好、分离度高、基线平稳,因此,最终选择乙腈-0.1%磷酸水为流动相。前期查阅文献得知,毛蕊花糖苷、梓醇、地黄苷D和益母草苷的最大吸收波长分别为334、203、203、210 nm,在预试验中发现毛蕊花糖苷含量在波长203 nm处偏低,与最大吸收波长334 nm测定结果有明显差异,且梓醇、地黄苷D和益母草苷在334 nm波长处几乎无吸收峰,益母草苷含量在最大吸收波长210 nm处与203 nm无明显差异,因此选择波长203 nm作为梓醇、地黄苷D和益母草苷3种成分的检测波长,334 nm作为毛蕊花糖苷的检测波长[10]。
在样品前处理中,本试验分别对提取方式(超声、加热回流)、提取溶剂(25%甲醇、50%甲醇、100%甲醇、乙腈)、提取时间(30、60、90 min)、取样量(0.5、1.0、2.0 g)进行了考察,结果表明,加热回流制成的供试品溶液重复性较差,初步判断误差是由蒸干程度判定不一导致的。超声操作简便,重复性好,故本研究采取超声提取方式。在对不同提取溶剂进行考察时,不同浓度甲醇提取含量差异小,而用乙腈提取时出现较多杂质峰,最终选择50%甲醇作为提取溶剂。在对提取时间进行考察時,提取30 min时化学成分提取不完全,提取60 min与90 min差异较小,故选择提取时间为60 min。在对取样量进行考察时,取样量为0.5、1.0 g时4种指标成分响应值较低,故选择取样量为2.0 g。综合几种样品前处理方法,最终选择2.0 g样品粉末中加入50%甲醇25 mL、超声处理60 min为本试验供试品溶液制备方法。
本研究结果表明,梓醇、地黄苷D及益母草苷含量随着蒸制次数的增加而出现不同程度下降。初步判断由于梓醇、地黄苷D和益母草苷均属于环烯醚萜苷类化合物,环烯醚萜类化合物普遍极性较大、易溶于水且热稳定性差[11],其在加热过程中的降解程度主要与糖的数目相关,三糖苷几乎不降解,二糖苷部分降解,而单糖苷几乎全部降解[12]。梓醇和益母草苷是单糖苷,热稳定性差,故这2种成分随着蒸制次数增加,含量明显下降且幅度较大。地黄苷D含量随蒸制次数增加虽有下降,但在“五蒸五晒”后趋于稳定[13]。毛蕊花糖苷属于苯乙醇苷类化合物,其在“六蒸六晒”时含量达到最大值,之后随蒸制次数增加,含量有所下降。
本研究对古法炮制不同时间的地黄化学成分进行研究,对“九蒸九晒”炮制过程中毛蕊花糖苷、梓醇、地黄苷D和益母草苷4种活性成分的含量变化进行了较为系统的对比研究,可为地黄炮制工艺研究提供参考依据。
参考文献:
[1] 黄石.熟地黄的炮制及应用价值探讨[J].中医临床研究,2011,3(15):85-86.
[2] 杨飞飞,李胜男,郭怀忠,等.古法炮制地黄与市售地黄成分的比较[J].河北大学学报(自然科学版),2017,37(1):47-55.
[3] 曹建军,梁宗锁,杨东风,等.地黄HPLC-DAD多波长指纹图谱的建立及其在熟地黄炮制中的应用[J].中草药,2014,45(2):265-270.
[4] 刘明,李更生,王慧森,等.地黄九蒸九晒炮制过程中益母草苷的含量测定及其动态变化[J].中国药学杂志,2009,44(9):658-660.
[5] ZENG Y, JIA Z P, ZHANG R X. The progress in studies on chemical constituents and pharmacology of Rehmanniae Radix[J]. Chin Tradit Pat Med,2006,28(4):609-611.
[6] LIU W X, LU Y W, DU H T, et al. Pharmacological actions of Rdix Rehmanniae and its active components research advances[J]. J Inter Pharm Res,2009,36(4):277-280.
[7] 邱建国.熟地黄炮制的渊源及炮制终点判断依据研究进展[J].中草药, 2012,43(8):1656-1660.
[8] 蔡瑞利,刘高胜,龚千锋.地黄炮制的历史沿革及现代研究[J].江西中医药大学学报,2006,18(3):40-41.
[9] 赵丹,张振凌,韩宁宁,等.酒炖炮制时间对熟地黄质量的影响[J].中医学报,2017,32(7):1231-1235.
[10] 陈天朝,翟来超.HPLC同时测定地黄中梓醇与毛蕊花糖苷的含量[J].中国实验方剂学杂志,2011,17(5):105-107.
[11] ZHAO Y, WEN X S, WU W H. Current situation of thecontents of catalpol in different preparations of Radix Rehmanniae[J]. Chin Pharm J,2007,42(7):486-488,553.
[12] 李军,张丽萍,张振凌.地黄研究进展[J].河南中医学院学报, 2005,20(6):79-83.
[13] 岳超,高杰,石上梅,等.HPLC测定地黄炮制前后3种苷类物质的含量[J].中国实验方剂学杂志,2015,21(4):71-74.
(收稿日期:2019-03-27)
(修回日期:2019-05-06;编辑:陈静)
基金项目:国家中医药管理局公益性行业专项(201507002-2);国家中药标准化项目(ZYY-2017-062)
通讯作者:郑艳萍,E-mail:zyp611@163.com
