终板下椎体缺血诱导兔椎间盘退行性变模型的建立及终板中内皮素1的表达
2020-04-26周小小郭胜洋吴佳俊
袁 维,周小小,蔡 攀,陈 诚,郭胜洋,吴佳俊,钱 明
1.同济大学附属上海市第四人民医院骨科,上海 200081
2.上海健康医学院附属周浦医院骨科,上海 201318
3.海军军医大学附属长征医院骨科,上海 200003
椎间盘是人体最大的无血管组织,其营养供应通过终板和纤维环扩散入椎间盘内。椎体终板通路是椎间盘营养供应的主要途径,正常椎间盘营养的75%来自椎体终板的渗透,终板发生退行性变引起椎间盘营养物质供应减少是导致椎间盘发生退行性变的始动因素[1]。抗终板退行性变为防治椎间盘退行性变提供了新的思路。修复椎间盘退行性变的研究前提是建立合适的动物模型。目前,较常用的模型建立方法是纤维环穿刺或穿刺结合髓核抽吸[2-4],穿刺损伤模型操作较简单、重复性好,且退行性变发展缓慢、便于观察及干预,但穿刺针的型号、进针的深度需要进行精确计算,其最大的缺点是髓核组织丢失,导致发生退行性变的过程与自然退行性变有较大的差别,不能全面反映椎间盘退行性变机制。
终板退行性变包含一系列复杂的病理变化,如炎性递质释放、营养供应下降等[5]。发生退行性变的软骨终板组织内ET-1 呈高表达,并且退行性变的软骨终板细胞自身能表达ET-1,ET-1 作用于软骨终板细胞促使其分泌基质金属蛋白酶1(MMP-1)、MMP-13 和一氧化氮(NO),导致终板细胞外基质蛋白聚糖和Ⅱ型胶原降解,进而引起终板退行性变[6]。因此,ET-1 在椎间盘终板退行性变中起着重要作用,可能成为该病治疗的新靶点。
本研究旨在探索一种建立椎间盘退行性变模型的新方法,从营养供应障碍方面着手,通过终板下注入医用无水乙醇阻断椎间盘营养供应,模拟椎间盘退行性变的自然过程。无水乙醇作为微循环破坏试剂,具有去血管化作用,可使椎体内骨髓血管内皮细胞迅速脱水、蛋白质变性凝固、小血管闭塞,从而造成微循环破坏[7-8]。本研究组前期实验也证实无水乙醇注射到鼠尾终板下椎体内可阻断椎间盘的主要营养途径,导致椎间盘退行性变的发生[9]。本研究选用新西兰大白兔,将无水乙醇注射到椎体内终板下,使滋养血管栓塞缺血、导致椎间盘营养物质供给障碍,进而导致椎间盘退行性变,并观察在终板退行性变过程中ET-1 的表达情况,为后期终板退行性变的修复提供切入点及理论基础。
1 材料与方法
1.1 实验动物及主要材料、仪器
健康4 月龄新西兰兔由上海中医药大学附属岳阳中西医结合医院实验动物中心提供[动物许可证号:SYXK(沪)2018-0040],雌雄不限,体质量(3 000±20)g,经腰椎X 线和MRI 检查排除脊柱的先天性疾病和椎间盘退行性变后纳入实验。腰椎骨穿刺针(天津金兴达实业有限公司,中国),医用无水乙醇(国药集团化学试剂有限公司,中国),氯胺酮、地西泮(福建古田药业有限公司,中国),ET-1 抗体(Thermo Scientific,美国)。光学显微镜(Olympus,日本),数字化计算机成像X 线机和3.0 T医用超导型磁共振扫描仪(Philips,荷兰)。
1.2 建模方法
将32 只兔随机分为4 组,每组8 只,选取L5,6椎体(对应L4/L5及L5/L6椎间盘)注射300 μL无水乙醇造模,选取L4椎体(对应L3/L4椎间盘)注射磷酸盐缓冲液(PBS)作为实验对照,L7椎体(对应L6/L7椎间盘)未注入任何物质作为正常对照。按3%氯胺酮(30 mg/kg)加0.5%地西泮(2 mg/kg)进行腹腔内注射麻醉。将兔右侧卧位固定于手术台上,在左侧腰背部剃毛备皮,通过左侧腹膜后入路,利用手提式X 线透视仪,侧位透视显示14G 腰椎骨穿刺针尖位于椎体前2/5 与后3/5 交界处;正位透视下,骨穿刺针在椎体左侧中央处与椎体成45°角斜向下方刺入椎体,缓慢进针,至针尖达终板侧椎体中心,距离终板软骨约3 mm,将注射液注入椎体骨髓腔内,速率为50 μL/min,留针6 min,然后缓慢拔针。用4-0 Vicryl 可吸收线缝合切口。于术前和术毕肌内注射庆大霉素80 000 U,连续应用3 d。术后连续3 d 颈部皮下注射卡洛芬(0.2 mg,每日2 次)镇痛,口服复方新诺明抗生素药水(48 mg/mL)1 周后改用正常纯净水。术后动物自由活动。
1.3 X 线检查测量椎间隙高度
术前和术后1、3、5个月,将实验动物麻醉后行X 线检查。摄影条件:50 mA,50 kV。参照Kim 等[10]的“三中线法”测量椎间隙高度,即在兔腰椎侧位X线片上,选择最上2 个和最下2 个椎体角为标记点,经过这4 点做2 条沿脊柱纵轴方向的直线,再沿相同方向做3 条直线(A、B 及C)均分先前2 条直线间的距离。再将这3 条直线经过椎间隙长度分别标记为D、E 及F,则该节段椎间盘高度为(D+E+F)/3。采用Han 等[11]的方法进行椎间盘高度指数(DHI)计算,即将椎间盘宽度四等分,测量中点及其两侧各25%位点相邻椎体及椎间盘的高度。
1.4 椎间盘退行性变评估
术前和术后1、3、5 个月,将实验动物麻醉后行MRI 扫描。颈椎线圈通过椎间盘矢状正中切面,采用自旋回波序列(TR:3 000 ms,TE:120 ms)无间距扫描。采用改良Pfirrmann 分级系统[12]进行退行性变程度分级。所有MRI 影像资料均由3 位资深MRI 医师盲法阅片。
1.5 椎间盘组织病理学观察
术后1、3、5 个月,在X 线和MRI 检查后,各取1 组动物给予二氧化碳(CO2)吸入处死。将整个腰椎完整取出,放入10%中性甲醛溶液中浸泡48 h 后水洗20 min,然后放入脱钙液(按氯化铝7 g、浓盐酸8.5 mL 及甲酸50 mL,加蒸馏水至100 mL 配制)脱钙4 ~ 5 d,以细针刺入椎体内无阻力为宜。冲洗15 min,于正中矢状位剖开标本,放入50%无水乙醇浸泡后,常规包埋、制成蜡块。4 μm 切片,行苏木精-伊红(HE)染色。光学显微镜下观察终板及椎间盘的组织病理学变化。
1.6 终板组织ET-1表达的检测
术后1、3、5 个月,收集终板组织进行石蜡包埋,制成组织切片,进行ET-1 抗体(1∶100)免疫组织化学染色,检测PBS 对照和退行性变终板ET-1 表达情况。用Image-Pro Plus 6.0 软件对阳性结果进行平均光密度定量测定。
1.7 退行性变软骨终板细胞中ET-1表达的检测
术后1 个月时,取1 组新西兰大白兔,无菌情况下获取退行性变软骨终板组织,在超净台内借助4倍放大镜仔细剔除骨屑、髓核和纤维环残留组织,PBS 液冲洗获得较洁白的终板组织。在含有3%胎牛血清的DMEM 培养液中加入0.15%Ⅱ型胶原酶,过滤除菌后加入终板组织。在10 cm2培养皿中用眼科剪将软骨终板组织剪碎至约1 mm3大小,移入50 mL 离心管内,在37℃下200 r/min 振荡,持续消化12 h。消化后的混合物用70 μm 滤网过滤,然后以1 200 r/min(离心半径为160 mm)离心5 min;去除上清液,取沉淀细胞悬液;加入含10%胎牛血清的培养液,1 000 r/min(离心半径为160 mm)离心5 min,去除上清液,重复3 次;按细胞密度约5×105/mL 接种于底面积为25 cm2的培养瓶中。在37℃、5% CO2培养箱中培养,培养液为含10%胎牛血清的DMEM,每3 d 换液1 次,隔天用倒置显微镜观察、拍照。
将细胞接种在12 孔板内,达到80%融合时,用PBS 清洗3 次,每次2 min;然后用4%多聚甲醛固定30 min,水洗15 min,双蒸水洗5 min;室温下加入甲苯胺蓝染色4 h,再水洗;自然晾干细胞爬片后,用中性树胶封片,进行软骨终板细胞鉴定。
将已消毒的10 mm盖玻片置于12孔培养板内,按5×104/mL的密度接种于培养皿中进行细胞爬片,待细胞达到80%融合时进行ET-1 抗体(1∶100)免疫细胞组织化学染色,观察ET-1 的表达。
1.8 统计学处理
采用SPSS 20.0 软件对数据进行统计学分析。计量资料以s 表示,不同时间点的比较采用方差分析;以P < 0.05 为差异有统计学意义。
2 结 果
2.1 影像学评估椎间盘退行性变情况
X线片示注射无水乙醇后椎间隙变窄,椎间隙边缘骨赘增生(图1)。注射PBS后1、3、5个月,L3/L4DHI分别为注射前的(99.3±1.1)%、(98.8±1.6)%和(98.2±1.3)%,差异无统计学意义(P > 0.05);注射无水乙醇后1 个月,L4/L5和L5/L6DHI 为注射前的(92.1±2.8)%,3 个月时降至(72.2±6.5)%,5 个月时降至(54.3±6.0)%,差异有统计学意义(P < 0.05)。
MRI 示随观察时间延长,注射无水乙醇后L4/L5和L5/L6椎间盘信号改变明显(图2),MRI T2WI 低信号,椎间盘退行性变加剧。按改良Pfirrmann 分级,1 个月时为3 ~ 4 级,3 个月时为5 ~ 6 级,5 个月时为7 ~ 8 级。
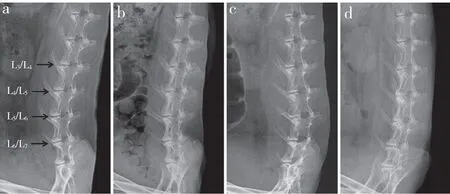
图 1 注射无水乙醇后腰椎椎间盘X线影像Fig. 1 Roentgenographs of lumbar disc after injection of absolute ethanol
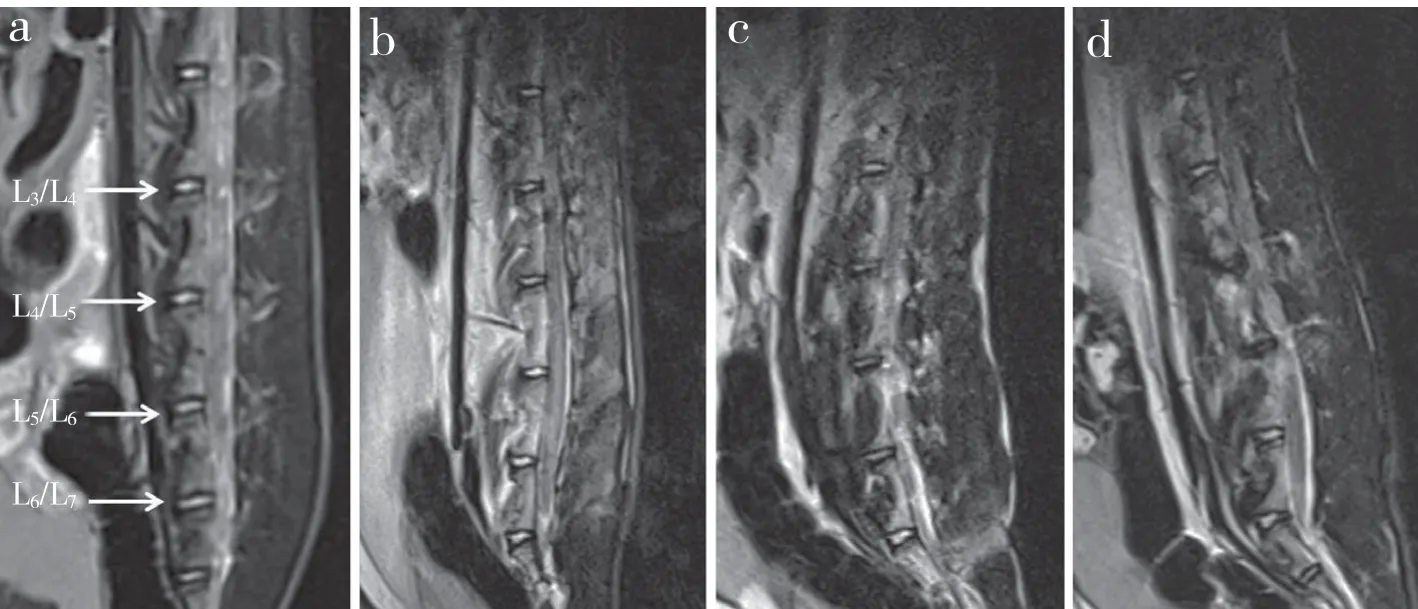
图2 注射无水乙醇后腰椎椎间盘MRI 影像Fig. 2 MRI of lumbar disc after injection of absolute ethanol
2.2 终板组织学观察
HE 染色结果显示:在无水乙醇注射后,终板逐渐出现退行性变,生长板厚度逐渐变薄,进而终板结构破损,同时软骨终板细胞退化、直至消失;髓核内以脊索细胞为主,在第1 个月时空泡状细胞增多,第3 个月后逐渐转化为以软骨样细胞为主,随着髓核纤维化进展,在第5 个月时残留在纤维组织的髓核细胞转化为纤维软骨样细胞;随着退行性变加重,纤维环出现结构排列紊乱,失去同心圆状规则排列,板层松散、断裂,纤维化程度加重。见图3。
2.3 终板组织免疫组织化学染色
免疫组织化学染色结果显示,PBS 对照近乎阴性表达(图4a,光密度为0.012 1±0.000 7)。无水乙醇注射后1 个月终板软骨细胞质内显示较强阳性ET-1 表达(图4b,光密度为0.257 3±0.024 1),3 个月时为阳性表达(图4c,光密度为0.192 2±0.015 5),随着终板退行性变加剧,软骨细胞活性降低,第5个月时ET-1 表达下降(图4d,光密度为0.086 9±0.006 1)。
2.4 软骨终板细胞ET-1 表达
提取的软骨终板细胞成功进行了原代和传代培养,倒置显微镜下可见原代细胞12 ~ 24 h贴壁,48 h后细胞开始增殖,约7 d 出现细胞集落,约14 d 铺满整个培养皿,细胞形态多样,从梭形到多边型不等(图4e);甲苯胺蓝染色可见细胞质有蓝色异染出现(图4f);免疫组织化学染色显示终板软骨细胞内ET-1 呈强表达,定位于细胞质内(图4g、h)。
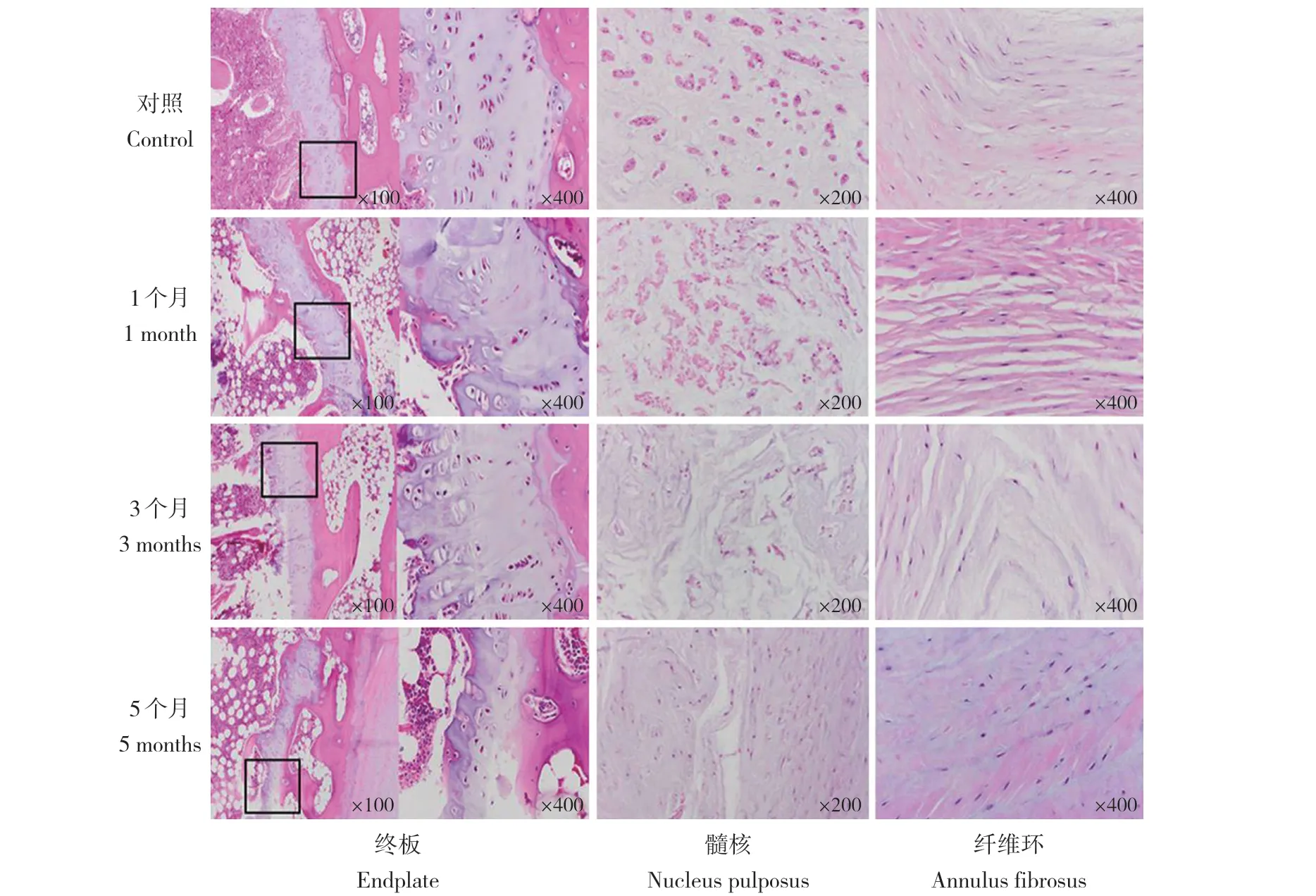
图 3 注射无水乙醇后腰椎终板、髓核和纤维环退行性变的病理学变化(HE 染色)Fig. 3 Pathological changes of lumbar endplate,nucleus pulposus and annulus fibrosus degeneration after injection of absolute ethanol(HE staining)
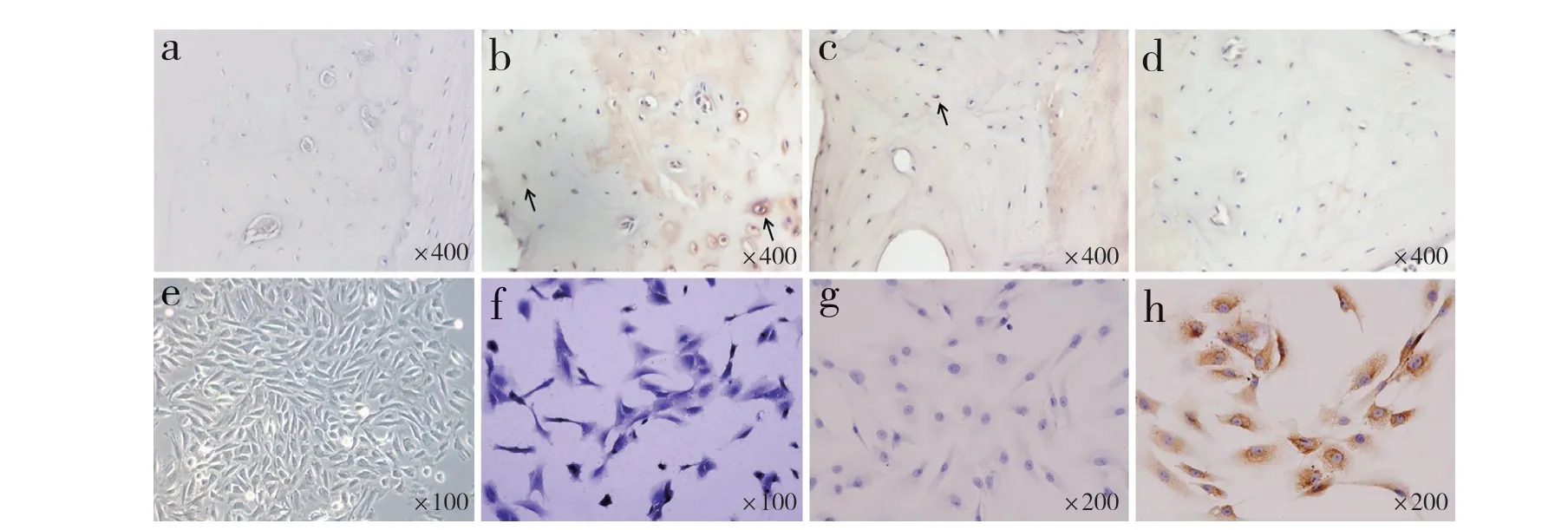
图 4 免疫组织化学染色结果Fig. 4 Immunohistochemical staining results
3 讨 论
椎间盘是脊柱运动功能单位中的关键结构,在解剖上分为终板、髓核和纤维环3 个部分,由于其解剖结构特殊,易发生退行性病变。有研究[13-15]显示,其发生机制包括椎间盘营养供应障碍,炎症介质的释放,细胞凋亡、老化和死亡,降解酶活性增高而抑制因子降低,遗传因素等。上、下终板位于髓核的两端,具有防止髓核突入椎体、控制椎间盘营养渗透和承接缓冲负荷的作用,对维持椎间盘内的正常形态和生理功能具有重要意义。营养物质供应障碍是导致椎间盘退行性变的关键因素。营养供应减少后髓核内代谢产物排出出现障碍,伴随降解基质酶活性增高,损伤髓核细胞,髓核处于酸性较高的环境,这种连锁反应导致退行性变进一步加剧。同时,椎间盘营养供应减少会导致椎间盘细胞数量下降,进而细胞外基质(蛋白多糖和Ⅱ型胶原)进行性减少,引起椎间盘退行性变[16-18]。此外,有研究显示,异常应力作用可使终板发生硬化、钙化及骨化,椎间盘营养供给被阻断,必然也造成其退行性变[19]。因此,要修复发生退行性变的椎间盘,首先要从病因学上了解退行性变过程及机制,其中最好的办法是模拟椎间盘退行性变的自然病程,从形态学、细胞学及生物化学等多角度进行相关研究,进而有的放矢地进行干预治疗。
学者们从终板损伤的角度对椎间盘退行性变模型的建立进行了一定的探索。Holm等[20]使用3.5 mm钻头损伤猪的腰椎终板,钻头尖部进入髓核内,3个月后纤维环前后部均发生退行性变,并且纤维环含水量和髓核蛋白多糖含量明显减少,证实终板损伤可致椎间盘退行性变发生。该模型的缺点是终板损伤的同时髓核暴露于机体免疫系统,可能激发一系列自身免疫反应,难以判断椎间盘退行性变是由终板损伤还是髓核损伤引起。Iwahashi 等[21]通过被动吸烟的方法诱导兔椎间盘退行性变,证实尼古丁可使椎体-终板附近血管芽的密度降低、管腔变窄,最终导致蛋白多糖和胶原的合成降低。Hutton 等[22]利用骨水泥阻断一侧或双侧软骨终板的血供建立犬腰椎椎间盘退行性变模型,但经过70 周的观察,椎间盘并未出现退行性变,分析其原因为骨水泥没有注射到合适的部位,并没有阻断椎间盘的终板营养供给途径,研究显示,阻断终板营养供应途径应选择在中央区,因为终板中央区和全部的纤维环对于小分子是渗透性的,而终板接近椎体周缘的外侧区域是非渗透性的,渗透性得益于骨性终板血管芽的存在,而在终板中央区血管芽更为密集。上述研究证实,阻碍椎体-终板营养途径可使椎间盘发生退行性变,但造模方法也存在明显的不足,不能有效推广应用。
本研究尝试通过终板下椎体内注入医用无水乙醇阻碍椎体-终板营养供应途径制作一种新的椎间盘退行性变动物模型。无水乙醇注射入椎体后导致终板下血供障碍,首先出现终板退行性变,进而影响椎间盘营养供应。组织学染色结果发现,终板的生长板逐渐变薄,生长板是软骨终板细胞密集排列的部位[23],该部位变薄表明终板退行性变加重并逐渐丧失自我修复的能力。随着终板结构的退行性变、破坏,软骨终板骨化程度增加,进而椎间盘营养供给减少,髓核内细胞数量及分泌的细胞外基质也发生变化,髓核内细胞增殖能力趋于降低,细胞也发生转化,已有报道显示髓核内细胞从脊索细胞向软骨样细胞方向转化是椎间盘退行性变的表现[24-25]。通过对造模后椎间盘进行影像学、形态学和组织学观察和检测,结果显示符合椎间盘自然退行性变过程,此模型适合于椎间盘退行性变的病因学研究,为未来临床干预治疗奠定了理论基础。
本研究还发现,ET-1 存在于发生退行性变的椎间盘终板中,并且被终板软骨细胞分泌。注射无水乙醇后1 个月时细胞质内ET-1 阳性表达,随着终板退行性变加剧,软骨终板细胞活性降低,后续ET-1表达下降。有研究[6]证实ET-1与人椎间盘终板退行性变相关。针对ET-1 在椎间盘退行性变中的作用,可尝试在椎间盘退行性变的早期阶段通过邻近终板的椎体内注射ET-1 受体阻断剂以减弱或阻断其作用,观察是否延缓或逆转椎间盘退行性变进程,这为修复退行性变椎间盘开拓了新的方向。
受实验条件所限,本研究未对兔椎间盘退行性变过程中终板钙化/骨化情况进行具体评估。后续实验将通过注射染料量化分析毛细血管闭塞情况与终板退行性变的相关性,并通过荧光标记物追踪小分子物质的渗透能力,进一步评估终板退行性变对椎间盘的影响。
