麻楝扦插生根进程中内源激素和营养物质含量的变化
2020-04-26仲崇禄魏永成孟景祥
王 青,张 捷,仲崇禄,张 勇,魏永成,孟景祥
(1.中国林业科学研究院热带林业研究所,广东 广州 510520;2.东北林业大学 园林学院,黑龙江 哈尔滨 150040)
麻楝Chukrasia tabularis为楝科Meliaceae 麻楝属Chukrasia常绿至半落叶大乔木,其干直冠阔,叶秀花香,材性优良,是我国热带和南亚热带地区园林景观绿化和珍贵乡土树种。当前,国内外针对麻楝的研究主要在化学成分和生物活性、引种筛选、育苗技术、遗传多样性及抗性等方面,与麻楝无性繁殖相关的研究还很匮乏。相关研究得出,麻楝苗茎在含不同植物激素的MS 培养基中培养,加入IBA 诱导10 d后即开始生根,且生根率超85%,并提出麻楝扦插的“幼态因素”较重[1];此外Kalinganire和Pinyopusarek 对麻楝的扦插繁殖也有所提及[2-3],但并没有系统探究;对麻楝扦插繁殖生根机理方面的研究更未见报道。
近年来大量研究发现,在插穗生根进程中,内源激素含量的动态变化比其特定发育时期的含量值更为重要,插穗体内内源激素的动态平衡调控着其不定根的发生过程[4-5]。张晓平等[6]对杂种鹅掌楸Liriodendron chinense×L.tulipifera及李朝婵等[7]对长蕊杜鹃Rhododendron stamineum研究发现生长素(IAA)促进不定根的形成,脱落酸(ABA)对根系生成则具一定抑制作用,外源激素处理可促进内源IAA的合成,抑制内源ABA的合成与运输。在长蕊杜鹃[7]和糙叶杜鹃Rhododendron scabrifolium[8]的研究中均发现赤霉素(GA)含量的升高,对插穗愈伤组织的诱导和不定根的发生有正相关性的影响;李永欣等[9]对光皮树Swida wilsoniana试验结果显示,高浓度的玉米素核苷(ZR)有益于根原基的生长发育,而低浓度的ZR 则对根原基的形成有利;董胜君等[10]对山杏Armeniaca sibirica和史锋厚等[11]对南京椴Tilia miqueliana嫩枝扦插研究均发现,植物生长调节剂处理可以影响插穗内源激素的变化,进而促进插穗生根。植物插穗内的营养物质是插穗生根前维持生命活动的重要能源,插条内所储存的可溶性糖、淀粉、可溶性蛋白以及氮素化合物等营养物质对其生根具重要影响。郭素娟等[12]对白皮松Pinus bungeana试验发现,总糖、总氮及总糖/总氮,与白皮松插穗生根存在正相关的关系,其中以总糖、总糖/总氮与插穗生根更为密切,其比值越大,插穗生根率就越高;长白落叶松Larix olgensis试验得出,可溶性糖含量与插穗生根有相关性,高含量的可溶性糖利于插穗生根,且一定的氮素含量是生根的基础[13]。
本研究通过对麻楝嫩枝扦插过程中几种主要内源激素[生长素(IAA)、脱落酸(ABA)、赤霉素(GA)、玉米素核苷(ZR)]和植物营养物质(可溶性糖、淀粉、可溶性蛋白)含量的动态变化进行研究,探讨了麻楝插穗的生根机理,为其扦插繁育提供科学的理论依据。
1 材料与方法
1.1 试验地
试验在位于广州市的中国林业科学研究院热带林业研究所苗圃温室内进行,试验期间,控制温室温度不超过30℃,室内空气相对湿度在90%以上。生理试验在热林所实验室内进行。
1.2 试验材料及处理
内源激素含量测定试验(2018年4月开始扦插)和营养物质含量测定试验(2018年9月开始扦插)的插穗来源于热带林业研究所培育的1~2年生实生苗上选取的6个月生半木质化嫩枝,剪切成10~12 cm 长,保留2 片羽状复叶中的小叶,以泥炭土+蛭石(1:1)为扦插基质,内源激素试验采用IBA 500 mg/L 处理插穗基部1 min后扦插,营养物质试验采用ABT1 500 mg/L 处理插穗基部1 min后扦插,且均以清水处理为对照(CK)。2个试验均采用随机完全区组设计,每处理60根插穗,重复3次。
扦插前取样一次,自扦插之日起,每隔10 d取一次样,每重复随机抽取4~5根插穗。将所取插条用蒸馏水冲洗干净,立即放入冰盒中带回实验室,观察记录插穗基部特征,之后迅速剥取插穗基部2~3 cm 内韧皮部并剪碎混匀,用锡箔纸包装严密,经液氮冷冻处理后,置于超低温冰箱(-80℃)保存备用。
1.3 试验方法
内源激素含量测定:称取各重复待测穗条样品0.40 g,冰浴下研磨成粉,装入10 mL 离心管中,低温保存。待全部采集完成,干冰冷冻下寄往中国农业大学化控中心,采用酶联免疫吸附法进行生长素(IAA)、脱落酸(ABA)、赤霉素(GA)、玉米素核苷(ZR)等4种内源激素含量的测定。
营养物质含量测定:各项指标称取各重复待测穗条样品0.20 g,可溶性糖、淀粉含量测定试验及计算方法参照李合生[14]等;可溶性蛋白含量测定参照试验及计算方法参照李合生[14]、郝再彬[15]等。
采用Excel和SPSS18.0 软件进行数据分析与作图。
2 结果与分析
2.1 麻楝插穗生根进程及形态变化
麻楝嫩枝扦插用于内源激素测定,取样时记录插穗的形态特征(见图1)。通过观察麻楝嫩枝扦插的生根变化,发现麻楝嫩枝插穗生根类型主要为皮部生根型,少量为愈伤组织生根型和混合生根型,其生根进程大致分为3个时期:皮孔萌动根原基诱导期(0~20 d),不定根表达发生期(20~40 d)和不定根伸长发育期(40 d 以后)。

图1 麻楝插穗生根过程中形态特征Fig.1 Morphological characteristics in rooting process of Chukrasia tabularis cuttings
0~10 d,部分插穗基部0.5 cm 范围内开始膨大,少数插穗基部皮孔突起(图1a);插穗上部叶结处开始萌芽抽稍。10~20 d,插穗基部持续膨大、开裂,根原基诱导分化,皮孔处出现白色絮状物(图1b)。20~30 d,插穗基部皮孔突起处、及插穗斜切口处开始有白色发亮不定根发出(图1c)。30~40 d,插穗不定根大量发生并伸长生长(图1d),主要发根位置:皮部切口、皮孔处;上部叶芽不断生长,羽状复叶逐渐长大(图1e)。40~50 d,插穗生根过程已基本完成,不定根逐渐伸长、增多、变粗,部分插穗不定根侧根开始生成(图1f);上部羽状复叶持续生长。50~60 d,生根插穗根系不断伸长加粗,侧根增多,插穗已基本长成完整植株。
2.2 麻楝插穗生根进程中内源激素含量及比值变化
2.2.1 IAA 含量变化
在麻楝插穗生根过程中,IBA 激素处理及对照插穗基部IAA 含量变化趋势大致相同(图2),均为“下降-上升-下降”。扦插后0~10 d,处理组与对照组均呈现出一定程度的降低,分析可能与插条脱离母体,受到切伤所致,插穗进行自我保护,枝芽产生的IAA 停止向形态学下端运输。10~20 d,对照组IAA 含量持续下降,处理组开始上升,与处理组插穗皮部萌动同时发生,可能与插条吸收外源激素后在植物体内逆转为IAA 有关。20~30 d,处理组与对照组IAA 含量均急剧升高到达峰值,此时两个处理中大多数插穗皮孔均膨大突起,以处理组居多,个别插穗有愈伤生成,两组处理均有少量不定根出现,以处理组更优;说明根原基的诱导需要高含量的内源IAA 来启动,出现峰值时期也往往伴随着不定根的发生。30 d后,处理组IAA 含量逐步下降直至趋缓,在这过程中,皮孔开裂诱导根系的过程已基本完成,IAA 不断被氧化,含量逐渐下降至趋缓;对照组IAA 在30~40 d 下降,之后趋缓,在50 d后又大幅下降,可能因为插穗不定根大规模发生及伸长时期消耗了大量IAA,同时也说明低浓度的IAA 有利于不定根伸长。观察整个生根过程不难发现,外源激素IBA 处理插穗,能在一定程度上提高插穗内IAA的含量,进而促进不定根的诱导发生。
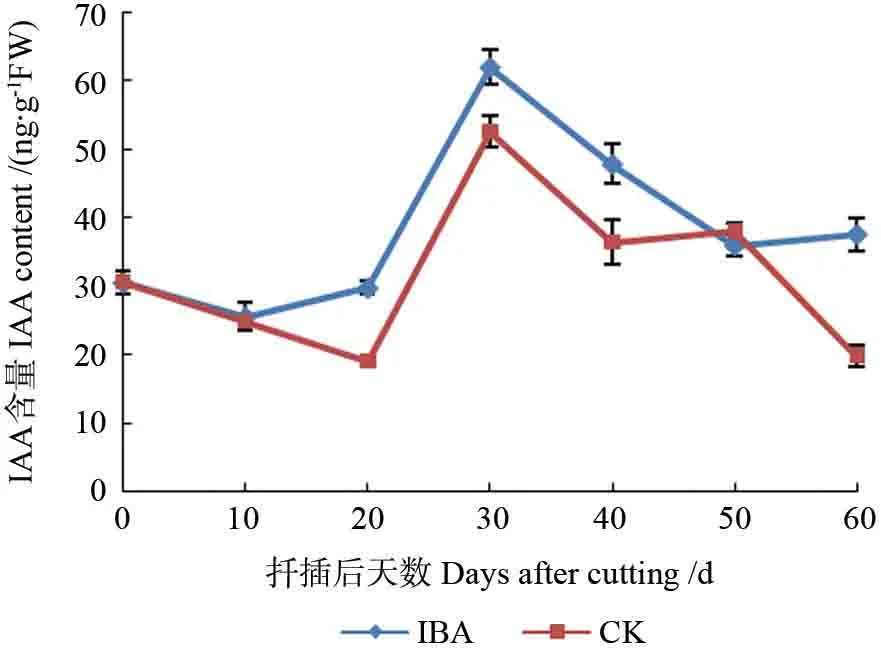
图2 麻楝插穗生根过程中IAA 含量的变化Fig.2 Changes of IAA content in Chukrasia tabularis cuttings during adventitious root formation
2.2.2 ABA 含量的变化
由图3可知,麻楝插穗内ABA 含量变化趋势基本上为“升高-降低”。扦插初期,处理组和对照组均持续上升达到峰值,可能因为插穗脱离母体,受到切割刺激从而导致ABA 含量的增加,ABA 含量的增多可降低逆境环境对插穗的伤害;处理组ABA 在峰值处含量显著低于对照组,可能是由于插穗经IBA 处理后,有效抑制了ABA的过多合成。20~30 d,各处理ABA 均急剧下降,此过程中,插穗基部皮孔持续膨大开裂,根原基逐渐发育形成,开始有不定根出现。30 d后处理组中ABA 含量趋于稳定,对照组在20~40 d 持续下降至平缓,与处理组大致处于同一水平,说明低浓度的ABA 含量有利于不定根的发生与伸长。50~60 d,两个处理ABA 含量均出现小幅下降,回归到插穗扦插前水平,分析与插穗根系已基本发育成熟,插穗突破了逆境生长有关。

图3 麻楝插穗生根过程中ABA 含量的变化Fig.3 Changes of ABA content in Chukrasia tabularis cuttings during adventitious root formation
2.2.3 GA 含量的变化
麻楝插穗基部韧皮部GA 含量变化如图4,可见处理组插穗GA 含量呈“上升-下降-上升-下降”的变化趋势,对照组GA 含量则一直下降。插后10 d,IBA 处理组插穗内GA 含量上升,而对照组则呈相反趋势,可能由于植物生长调节剂IBA 在某种程度上促进了GA的合成。IBA 处理插穗GA含量在10 d 出现小高峰,与ZR 变化如出一辙,说明两者可能存在协同作用,在某种程度上促进了插穗皮孔的萌动。10~30 d,处理组GA 含量大幅下降,可能是因为插穗根原基诱导及新梢的萌发生长消耗了大量赤霉素。30 d 往后,处理组GA 含量再次小幅升高然后降低,此时正是不定根发生之际,随着根尖突出皮孔,不定根逐渐伸长,GA 含量逐渐降低,可能是由于不定根生成以后,高水平的GA 会抑制其伸长生长。对照组插穗GA含量变化幅度不大,扦插初期不断下降,之后趋于稳定动态,在皮孔萌动和不定根发生阶段,处理组插穗GA 含量一直高于对照组,这可能也是处理组插穗生根率更高的原因。
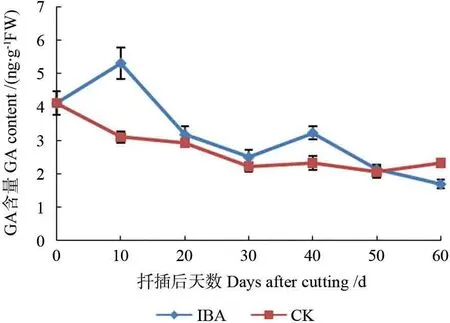
图4 麻楝插穗生根过程中GA 含量的变化Fig.4 Changes of GA content in Chukrasia tabularis cuttings during adventitious root formation
2.2.4 ZR 含量的变化
纵观图5可知整个生根进程中,处理组插穗ZR 含量呈现出“上升-下降-上升-下降”的变化趋势,对照组ZR 含量变化幅度不大,比较平缓,其变化趋势大体与处理组一致。0~20 d,IBA 处理组ZR 含量先上升后下降,此阶段为插穗皮孔萌动及根原基诱导期,个别插穗有愈伤生成,说明ZR 含量的升高有利于插穗皮部根原基的发生及愈伤组织的形成;对照组变化不大,这可能也是对照插穗皮孔萌动不如处理组明显的原因。20~40 d,处理组ZR 含量趋于平稳,可知对于麻楝嫩枝插穗,在皮孔膨大开裂、根原基形成及根系大量发生阶段,较为稳定的低浓度内源ZR 含量有利于插穗不定根的诱导与发生;对照组ZR 含量略微上升,与处理组大致处于同一水平。40~50 d,两个处理ZR 含量再次升高,可能是ZR 可促进细胞分裂、生长,有利于不定根的生长发育;之后,随着不定根大量发生,其伸长生长消耗了大量的玉米素核苷,ZR 含量又开始降低。
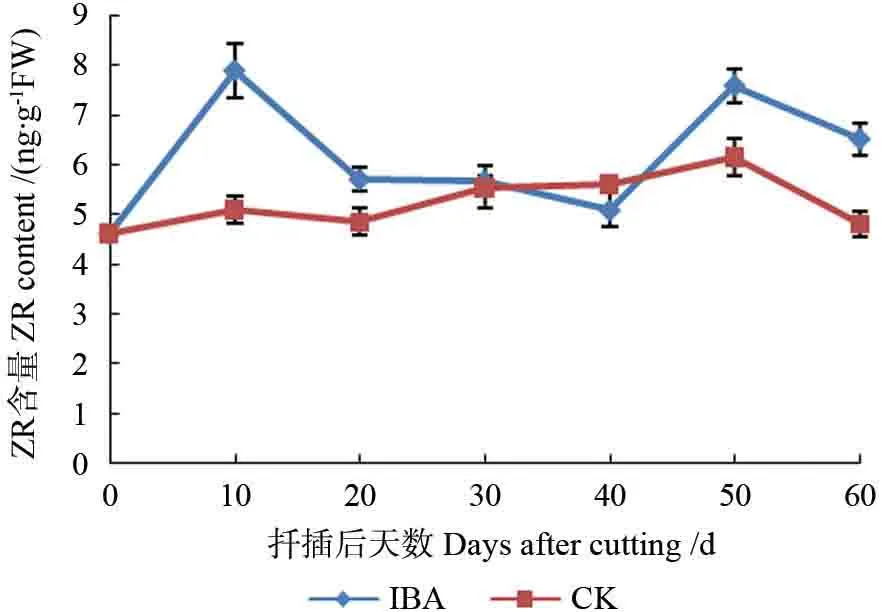
图5 麻楝插穗生根过程中ZR 含量的变化Fig.5 Changes of ZR content in Chukrasia tabularis cuttings during adventitious root formation
2.2.5 IAA/ABA的变化
由图6可知,扦插初期IAA/ABA 值处理组与对照组均下降,这是因为插穗离开母体,ABA 含量增加所致。20~30 d,处理组比值上升至峰值,对照组也大幅上升,此时正处于插穗皮孔膨大开裂期,说明较高的比值有利于麻楝插穗不定根原基的诱导与发生。30 d后,处理组比值缓慢下降至一定值,这是不定根大量发生从而消耗大量IAA的结果,而后又缓慢上升,此时不定根正处于伸长生长时期,IAA 趋于稳定,插穗代谢趋于正常,ABA 降低至初始水平,故IAA/ABA 值表现为缓慢上升;对照组在30~50 d 比值趋于稳定,至50 d后缓慢下降。在插穗整个生根关键期,处理组插穗的IAA/ABA 比值始终高于对照组,说明施用外源激素可在一定程度上提高插穗IAA/ABA的比值。
2.2.6 IAA/ZR的变化
纵观整个生根进程(图7),处理组和对照组插穗IAA/ZR 值变化整体上均呈现出“下降-上升-下降”的趋势。插后0~20 d,处理组IAA/ZR 值表现为先降低而后缓慢升高,对照组插穗IAA/ZR比值一直缓慢降低,两者都维持在一个较低水平,这有利于插穗皮孔萌动;20~30 d,处理组和对照组插穗皮孔均大量膨大、开裂,不定根开始发生,使其基部聚积大量IAA,ZR 含量相对保持稳定,故两者比值大幅上升,说明高比值的IAA/ZR 有利于根原基的诱导和不定根的发生,处理组比值大于对照组,可知处理组插穗对外源激素的刺激开始产生反应;30 d 以后,由于不定根大量生出,一方面消耗大量IAA,另一方面,ZR 相对含量升高,使得IAA/ZR 值逐渐下降,基本恢复至初始水平,有利于不定根的伸长。观察图6和图7可知,在生根关键期两者均出现峰值,说明较高比值的IAA/ZR和IAA/ABA 有利于麻楝嫩枝插穗生根。

图6 麻楝插穗生根过程中IAA/ABA 值的变化Fig.6 Changes of IAA/ABA in Chukrasia tabularis cuttings during adventitious root formation

图7 麻楝插穗生根过程中IAA/ZR 值的变化Fig.7 Changes of IAA/ZR in Chukrasia tabularis cuttings during adventitious root formation
2.3 麻楝插穗生根进程中营养物质含量变化
2.3.1 可溶性糖含量变化
ABT1 处理组插穗可溶性糖含量呈“急剧下降-上升-下降”的变化趋势,清水对照组插穗整体上呈“急剧下降-上升稳定”的趋势(图8)。扦插后0~10 d,各组插穗可溶性糖含量均急剧下降,以处理组插穗下降量更多,可能因为插穗刚脱离母体,需消耗自身储存的大量营养物质来分解提供能量,用于插穗自我保护,和供于插穗根原基形成及新梢抽出。10~20 d,处理和对照组插穗的可溶性糖变化趋势出现较大反差,可能由于外源激素ABT1的施用对其形成起到了一定促进作用,插穗基部淀粉酶活性增强,淀粉被水解,基部可溶性糖含量开始增加。20~30 d,各处理插穗基部可溶性糖含量均增加,这阶段插穗基部皮孔持续开裂,处理组部分插穗有不定根发出,插穗叶芽不断长大;经ABT1 处理的插穗可溶性糖含量增加幅度较大,说明外源激素可提高插穗的细胞分化和代谢能力。30~40 d,两组插穗可溶性糖含量均有所下降,以处理组下降幅度大,分析是由于插穗不定根大量发生,可溶性糖进一步被消耗,供给根系发生。40 d后,处理组插穗不定根多已突出表皮,不断伸长生长,消耗一定可溶性糖等营养物质,之后随着插穗生长状态逐渐稳定,其含量又有所回升;对照组插穗可溶性糖含量在此阶段变化不大,趋于稳定,可能因为部分插穗仍处于假活状态,未有根系突出表皮,插穗代谢缓慢。
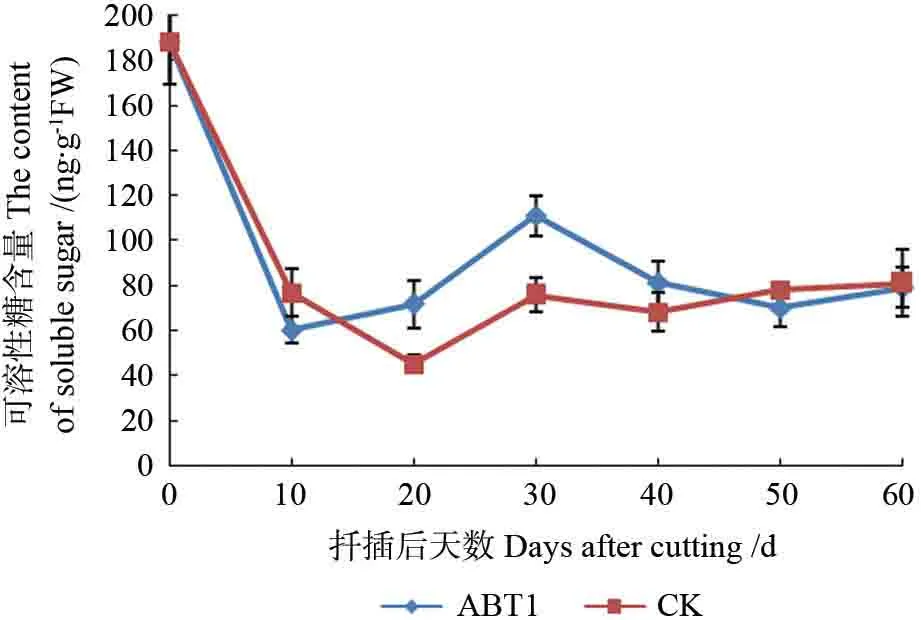
图8 麻楝插穗生根过程中可溶性糖含量变化Fig.8 Changes of soluble sugar content in Chukrasia tabularis cuttings during adventitious root formation
2.3.2 淀粉含量变化
ABT1 处理组插穗内淀粉含量变化趋势与可溶性糖类似,均为“急剧下降-上升-下降”,对照组插穗呈现出急剧下降然后趋于稳定的趋势(图9)。扦插初期,各处理插穗淀粉含量变化与可溶性糖变化相似,均表现为显著下降,可能是因为插穗形成自我保护,为防止切口感染,消耗大量营养物质,另一方面,插穗皮孔萌动、诱导根原基的过程也需消耗自身贮存的大量营养物质。20~30 d,处理组淀粉含量开始上升,因为这时期插穗新梢逐渐舒展,光合作用增强,使得淀粉的合成速率加快,且此时部分插穗根系已突破表皮,可以吸收基质中的营养物质,故淀粉含量逐渐在基部积累,积累量远大于其供插穗生根及生长所需的消耗量。30~40 d,处理组淀粉含量再次降低,正值不定根发生的高峰期,能量需求量大,淀粉又被大量消耗。40 d后,插穗基部淀粉含量又趋于缓慢升高,可能由于不定根发生已基本完成,插穗各项生命活动趋于正常。与处理组相比,20 d后对照组插穗淀粉含量变化幅度很小,趋于平稳;且在整个生根进程中,处理组根原基的形成及抽稍的时间早于对照,根系的形成时间及数量也早和多于对照组插穗,由此可知,经外源激素ABT1 处理后的插穗,其代谢强度明显优于清水组插穗,可在生根关键期加强插穗对其内部淀粉的利用,促进插穗生根。
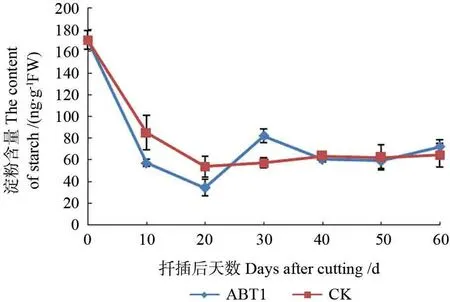
图9 麻楝插穗生根过程中淀粉含量变化Fig.9 Changes of starch content in Chukrasia tabularis cuttings during adventitious root formation
2.3.3 可溶性蛋白含量变化
由图10可知,麻楝插穗内可溶性蛋白含量呈“下降-缓慢上升”的变化趋势,对照组插穗整体上呈逐渐下降的趋势。扦插初期,各处理插穗内可溶性蛋白含量均降低,这是因为插穗在克服逆境生长和皮孔萌动期需要大量能量供给,而能量来源就是插穗体内存储的可溶性糖、淀粉及蛋白等营养物质,此时插穗内部可溶性糖和淀粉可能分解有限,光合产物也极度匮乏,故可溶性蛋白开始分解释放能量以供插穗所需。与对照组相比,处理组下降幅度较大,可能是由于ABT1 提高了插穗内部某些蛋白酶的活性,进而促进蛋白的分解利用。扦插后10~20 d,处理组插穗蛋白含量缓慢回升,这时期插穗开始大量抽稍,逐渐开展,插穗光合能力逐渐恢复,促进了可溶性蛋白的积累,也可能是由于外源激素的施用可提高一些酶的活性,促进了mRNA的合成,进而可溶性蛋白含量有所增加,为不定根提早发生做准备;对照组插穗抽稍数量较处理组少,叶片开展程度也较处理组低,可溶性蛋白含量变化不大。20 d后,处理组插穗内可溶性蛋白含量趋于稳定,这一时期插穗内可溶性糖和淀粉含量均大幅升高,提供了插穗生根的必要营养物质,缓解了可溶性蛋白的消耗;对照组插穗蛋白含量则一直下降,可能是由于插穗内其他营养物质不足以补充根系生长所需能量,以致可溶性蛋白的消耗量远大于其生成量。50 d后插穗生长状态基本稳定,各项生命活动趋于正常,可溶性蛋白含量又开始增加。
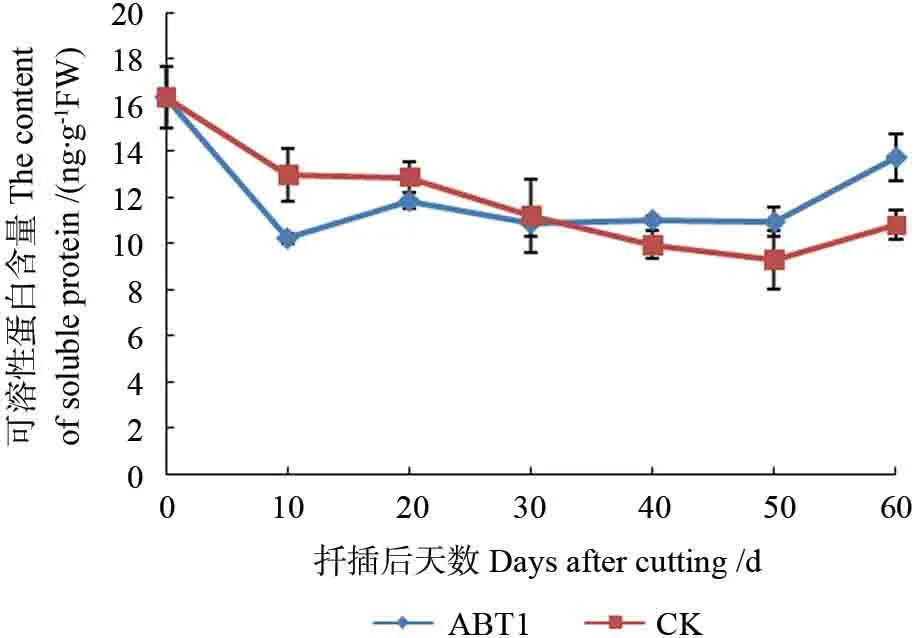
图10 麻楝插穗生根过程中可溶性蛋白含量变化Fig.10 Changes of soluble protein content in Chukrasia tabularis cuttings during adventitious root formation
3 结论与讨论
3.1 结 论
1)麻楝嫩枝插穗生根类型主要为皮部生根型,少量为愈伤组织生根型和中间生根型;其生根进程大致分为皮孔萌动根原基诱导期(0~20 d)、不定根表达发生期(20~40 d)和不定根伸长发育期(40 d 以后)3个时期。
2)在麻楝嫩枝插穗整个生根过程中,外源激素IBA的施用,能在一定程度上提高插穗内源激素IAA、GA、ZR的含 量 及IAA/ABA、IAA/ZR的值,而对内源ABA 含量有一定抑制作用。较高浓度的IAA 有利于插穗不定根的发生,较低水平的IAA 含量合GA 含量有利于插穗不定根的伸长生长;低浓度的ABA 含量有利于不定根的发生与伸长;同时较为稳定的低浓度内源ZR 含量有利于插穗不定根的诱导与发生。内源激素间共同作用、相互制约,较高值的IAA/ZR和IAA/ABA 有利于麻楝嫩枝插穗不定根的发生。
3)插穗内3种营养物质的含量变化表现出一定的规律性,与生根过程中插穗形态变化相对应;外源激素的施用加速了插穗内各营养物质的代谢过程,对插穗生根有利;插穗内可溶性糖和淀粉含量显著高于可溶性蛋白,变化幅度也较可溶性蛋白含量大,是麻楝插穗生根的主要能量 来源。
3.2 讨 论
3.2.1 内源激素与麻楝生根的关系
众多学者已从多个角度论证过生长素在插穗不定根形成过程中的作用,认为IAA 对插穗不定根的发生有明显的促进作用[6,16];詹亚光等[17]对白桦Betula platyphylla嫩枝进行扦插试验发现IAA含量的高峰与根原基出现的高峰相一致;本试验研究结果与上述一致。对于脱落酸的研究,许多学者都得出ABA 对不定根的发生具有明显抑制作用[7,13,16]。本试验研究结果显示,ABA 含量在扦插初期先升高,与薄壳山核桃Carya illinoinensis[16]、青钱柳Cyclocarya paliurus[18]、细柄蕈树Altingia gracilipes[19]研究结果一致,由于插穗切口损伤刺激而产生大量ABA 以增强自身抗逆性;之后在生根关键期ABA 含量大幅下降,且外源激素IBA 处理组的ABA 含量低于对照组,而IAA 含量较对照组高,说明低浓度的ABA 含量有利于不定根的发生与生长,外源激素的施用促进了IAA 含量的增长,对ABA 合成有一定抑制作用,与杂交鹅掌 楸[6]、长蕊杜鹃[7]等研究一致。关于细胞分裂素ZR 对于扦插生根的影响,一直以来都存有较大争议。有些研究认为高浓度的ZR 可以促进不定根的发生[13];也有些试验研究得出ZR 对根原基的发生并无明显作用,而在其进一步生长发育时期有着重要作用[9,20]。针对麻楝,本研究试验发现,处理组插穗内源ZR 在皮孔根原基诱导及根系伸长生长期变化幅度较大,对照组插穗变化幅度整体较小,且在整个生根进程中,处理组插穗ZR 含量大体上均高于对照组,说明可能是外源激素IBA 处理可在不同生根时期加速合成细胞分裂素ZR,以满足插穗生根需要,这与细柄蕈树[19]的研究结果一致。对于赤霉素GA的研究结果也是各异。李永欣等[9]、吴文浩等[16]分析认为高浓度的GA 抑制插穗不定根的形成;在长蕊杜鹃[7]和糙叶杜鹃[8]的研究中均发现赤霉素(GA)含量的升高,对插穗愈伤组织的诱导和不定根的发生有正相关性的影响;本试验研究发现,麻楝嫩枝扦插生根进程中,各处理插穗内GA 含量整体上处于降低趋势,说明高浓度水平的GA 可能会抑制不定根的大量产生及伸长生长,与北美香柏[4]、光皮树[9]、薄壳山核桃[16]的研究结果相似。
在植物扦插生根过程中,不是单一激素的简单变化对根系发生起作用,而是多种内源激素共同发挥作用、相互制约,不同激素含量比值的动态变化更能反应出插穗不定根发生能力[16]。关于激素比例,IAA/ABA和IAA/ZR 值变化与生根有较大关系。相关研究通过试验得出,IAA/ABA 值可用来衡量插穗的生根力,比值越高越有利于不定根发生[12-13];本试验发现,IAA/ABA、IAA/ZR值在麻楝嫩枝插穗不定根发生关键期均出现峰值,且处理组高于对照组,印证了IAA与ABA、IAA与ZR 比值高有利于植物插穗生根的观点,与刘明国等研究一致[4]。
3.2.2 营养物质与麻楝生根的关系
植株插条内所储存的碳水化合物和可溶性蛋白等营养物质对其生根具重要影响。郭素娟等[12]对白皮松试验发现,总糖、总氮及总糖/总氮,与白皮松插穗生根存在正相关的关系,其中以总糖、总糖/总氮与插穗生根更为密切,其比值越大,插穗生根率就越高;李先民对青钱柳研究发现可溶性糖是插穗生根的必须营养物质,也是插穗生根前维持生命活动的主要能量来源;淀粉水解是插穗可溶性糖来源的一条主要途径,当可溶性糖供应不足时,外源激素可增强淀粉酶活性加速淀粉的水解,可溶性糖含量增加,为插穗生根提供充足的能源物质[18];王小玲等[21]对四倍体刺槐研究发现可溶性蛋白可构建细胞膜系统,发挥运输协调、免疫保护与生长分化等功能。不同的树种,其生根难易和生根状况也不同,在生根进程中营养物质含量的变化也不同[22]。本试验研究发现,在麻楝嫩枝插穗整个生根进程中,各营养物质含量在不同阶段不断波动,外源激素处理组变化幅度更大;可溶性糖与淀粉含量均呈“下降-上升-下降、而后趋于稳定并开始升高”的趋势,由此变化可知碳水化合物对麻楝插穗生根不可或缺;可溶性蛋白含量呈现“下降-上升”的趋势,变化幅度较碳水化合物类小,含量值也大量低于后者,可见可溶性糖和淀粉是麻楝插穗生根主要能量来源;扦插初期,由于插穗刚脱离母体,需消耗自身储存的能量维持生命活动,且插穗切口为防止感染所形成的自我保护也需消耗能量[18],故插穗内各营养物质均下降;待生根基本完成,新梢绿叶舒展,光合作用逐渐恢复,插穗内各营养物质均开始积累,逐渐呈上升趋势。外源激素的施用加快了麻楝插穗内各营养物质的代谢进程,加速了营养物质的合成与积累,对生根有一定促进作用,与细柄蕈树[19]研究一致。
本研究对插穗生根进程中的外部形态变化进行了描述,对内源激素水平、营养物质含量进行了测定分析,为麻楝无性繁殖提供了参考。但麻楝插穗生根过程中其他生理生化指标,如其他种类营养物质(总氮量、C/N 比等)、多种氧化酶活性及生根抑制物对插穗生根的影响,以及根原基诱导及根系发生过程中内部细胞组织分化的过程,均有待进一步探讨。
