氯化铵水溶液的分子动力学模拟
2020-04-25王纪红袁俊生
王纪红, 文 闻, 李 非,3, 林 鹤, 袁俊生,3,4
(1. 河北工业大学化工学院, 天津 300130; 2. 中国科学院上海应用物理研究所, 上海 201204; 3. 河北工业大学海水资源高效利用化工技术教育部工程研究中心, 天津 300130; 4. 泉州师范学院化学工程学院, 泉州 362000)
1 引 言
电解质溶液在化工工业、物理研究以及环境保护等领域中有着非常广泛的应用. 电解质水溶液的宏观性质如密度,粘度和电导率与它们的离子之间的微观相互作用密切相关. 因此,电解质溶液的理论研究对于溶液微观结构的深入探索以及统计力学理论的发展有着巨大的推动作用,对于理解溶液的宏观性质具有一定的指导意义. 氯化铵是一种常用的化学原料和中间产品. 此外,铵离子和氯离子属于众所周知的Hofmeister序列[1]. 因此,研究氯化铵水溶液的微观结构很有必要.
电解质溶液的结构研究既有实验的实施又有理论的计算. 实验方面,DS Terekhova等人[2]通过X射线散射法研究了NH4F水溶液. 他们认为,无论是在低浓度还是高浓度条件下,铵离子周围水分子的配位数与纯水相似,表明NH4F水溶液中的水结构没有被破坏. 此外,Filippo Bruge等人[3]对水团中NH4+的水合作用进行了研究,结果发现NH4+中的N-H键长为1.03 Å,当NH4+与一个水分子产生水合作用时,NH4+中与水分子形成氢键的N-H键键长增加,当NH4+周围有四个水分子时,这种作用最弱. Wright等人[4]应用拉曼光谱研究了不同温度下溴化铵水溶液中NH4+的结构信息,表明NH4+不仅与卤素元素相互作用,而且在相邻的铵离子之间也有一定的作用.
计算模拟方面,周健等人[5]通过分子动力学模拟(MD)研究了无限稀释水溶液中的五个离子(Li+,Na+,K+,F-和Cl-)在298 K下的水合作用,得出阳离子的水合强度顺序为Li+> Na+> K+,而对于阴离子F-> Cl-. 并且离子水合不仅可以影响离子的短程结构,还可以影响离子的扩散性质. 袁俊生等[6, 7]采用COMPASS力场模拟了在298 K下K+、 Cl-水化现象的分子动力学,得出了离子的水分子配位数及扩散系数等依赖浓度的变化情况. 虽然关于铵根离子、氯离子水化情况的分子动力学模拟已经得出了很多成果[8-14],但是对于铵根离子来说,只是笼统的分析铵根离子整体对溶液结构的影响,而对铵根离子中N和H分别对水溶液产生的影响,以及N和H之间的相互作用这样细致的探索较少,本文对该问题进行深入考察,并且定性地研究了随着浓度的变化,氯化铵水溶液中的氢键变化情况、离子的配位数、水化数及水化半径的变化情况,希望为膜渗透、离子交换等过程研究提供更深入的理论指导.
2 模拟使用的力场
本文的模拟使用的是COMPASSⅡ力场(Condensed-phase Optimized Molecular Potentials for Atomistic Simulation Studies的首字母缩写)[15],适用于共价分子体系,包括大多数常见有机物、无机物和聚合物、金属、金属氧化物和金属卤化物,并且添加了对离子液体的支持,强化了对聚合物和杂环体系的支持. 其中,价参数和原子点电荷由ab initio 数据拟合得到. 此力场可以精确、快速的寻找分子能量处于极小值状态时分子的构型. 采用优化的方法,COMPASSⅡ力场用来计算分子体系的势能,一般包括
Etotal=Evalence+Ecrossterm+Enon-bond
(1)
Evalence=Ebond+Eangle+Etorsion+Eoop+EUB
(2)
其中,Ebond代表健伸缩能,Eangle代表键角弯曲能,Etorsion代表二面角扭转能,Eoop代表离平面相互作用项,EUB代表Urey-Bradley项.Ecrossterm代表共价交叉项.
Enon-bond=EvdW+ECoulomb+Ehbond
(3)
其中,EvdW代表van der Waals能,ECoulomb代表静电(库仑)相互作用能,Ehbond代表氢键作用能.
而结构优化的方法中,使用的是smart方法[16],它是steepest descent(最速下降法)、ABNR和Quasi-Newton methods的串联,对于分子体系进行结构优化,通常先采用最速下降法进行粗略的优化,然后再用共轭梯度或牛顿法进行更精细的优化.
3 模拟方法
通过使用Material Studio(MS)软件在室温下进行不同浓度的NH4Cl水溶液的分子动力学模拟,以获得关于原子间相互作用的更详细信息. 首先,在分子动力学模拟方法中,我们使用Amorphous Cell模块中的Construction功能来创建初步模型. 根据摩尔比(表1)构建水盒子,每种浓度的模拟水盒子的尺寸分别取决于密度1.0868 g/cm3,1.1054 g/cm3,1.1390 g/cm3,1.1790 g/cm3和1.1907 g/cm3. 其次,分子动力学模拟部分在COMPASS II力场,而结构优化的方法中,使用的是smart方法. 模拟温度设定为298 K,恒温采用Nose-Hoover法. 选择NVT系综,并分别使用Ewald方法和Atom based方法计算静电力和范德华力. 每个原子的初始速度是随机的,同时,步长为0.2 fs,模拟过程总共运行500000步,总模拟时间为100 ps. 最后,分子动力学计算使用与分子动力学模拟相同的模块,但是系综改为NPT. 外压设定为1.0×10-4GPa,压力控制为Berendsen法. 计算后的模型可用于导出径向分布函数(RDF).
图1和图2分别为分子动力学计算过程中体系能量的变化以及温度变化图,从图中可以看出,计算的前15 ps,体系慢慢趋于稳定,后85 ps体系能量及温度变化不大,说明体系已经达到平衡,可以用来统计和分析各种性质.
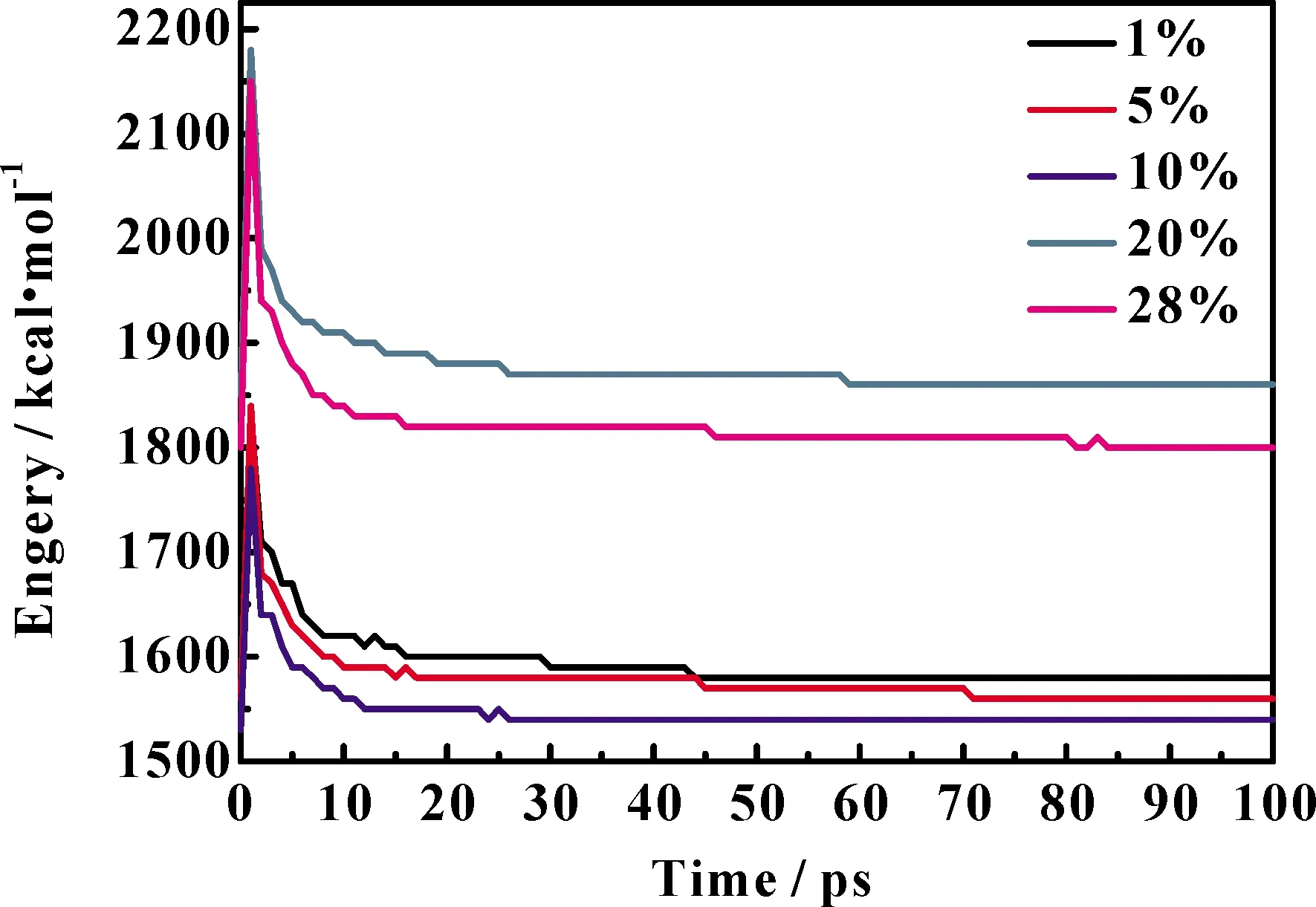
图1 不同浓度NH4Cl水溶液分子动力学优化过程中系统能量变化曲线Fig. 1 Total kinetic energy optimization curves of NH4Cl
图2 NH4Cl水溶液分子动力学优化过程中系统温度变化曲线Fig. 2 Temperature change diagram by molecular dynamic of NH4Cl solutions solutions at different concentrations.
4 结果和讨论
4.1 径向分布函数
Radial distribution function ( RDF )径向分布函数,是在距离原子一定距离的地方,找到另外一个原子的概率,与完全均匀分布情况下该处找到原子的概率之比,它反映的是一个有序性问题,存在进程有序就会出现峰,峰高而尖,说明有序性强[17],原子之间联系较紧. RDF积分反映了配位数[16]. 径向分布函数的物理意义可参照下图3,图中黑球为流体系统中的一个分子,称为“参考分子”.
之一,其管理质量关系到现场管理工作的总体质量。在管理过程中人员管理的难度大,易出现各种问题。当前现场施工人员管理主要问题有:人员纪律性差。水利工程施工人员众多,极大提高了管理难度;施工人员多,也会导致其技术水平参差不齐,不利于对施工质量的管理;其自身意识不强,加大了现场管理难度。管理方法落后,施工人员的归属感与责任感不强,降低管理效率。

图3 径向分布函数物理意义分析参考图Fig. 3 Reference diagram of physical meaning analysis of radial distribution function
分子动力计算径向分布函数的方法为:
式中,ρ为系统的密度;N为分子的总数目;T为计算的总时间;δr为设定的距离差;ΔN为介于r→r+δr间的分子数目.
通过研究Ion-O 和Ion-H径向分布函数,可了解溶液中离子的微观结构变化. 图4(a)~图4(i)分别给出了289 K下不同浓度NH4Cl水溶液的径向分布函数(RDF).
NH4Cl水溶液中N-H(NH4)和O-HW的径向分布函数图及其部分放大图如4(a)和(b)所示. 在所有图中,下标W代表水分子,NH4代表NH4+. 可以看出,N-H(NH4)和O-HW的RDF图的第一峰都非常强,这表明液态水系统中原子的排列是短程有序的[19]. 此外,众所周知,纯水中的O-H径向分布函数第一峰位在1.0 Å处[20]. 根据图6(a)和(b)可得,NH4Cl水溶液中N-H(NH4)径向分布函数的第一峰位也是1.0 Å,且峰强有大幅度降低的趋势,而O-HW的径向分布函数第一峰少量增强. 这可解释为:在NH4Cl水溶液中,1.0 Å附近的峰位分别对应于H2O和NH4+分子内的O-H和N-H键. 虽然通过NH4+中的氢原子和水分子的氧原子之间形成弱氢键而适合液态水的四面体结构[21,22],使得溶液中的NH4+离子的行为与水分子非常相似[21]. 但是随着氯化铵浓度的升高, 大量Cl-的加入破坏溶液中的氢键网络结构,不过主要影响在了与NH4+相作用的弱氢键[23],对水分子与水分子间的氢键影响要小得多.
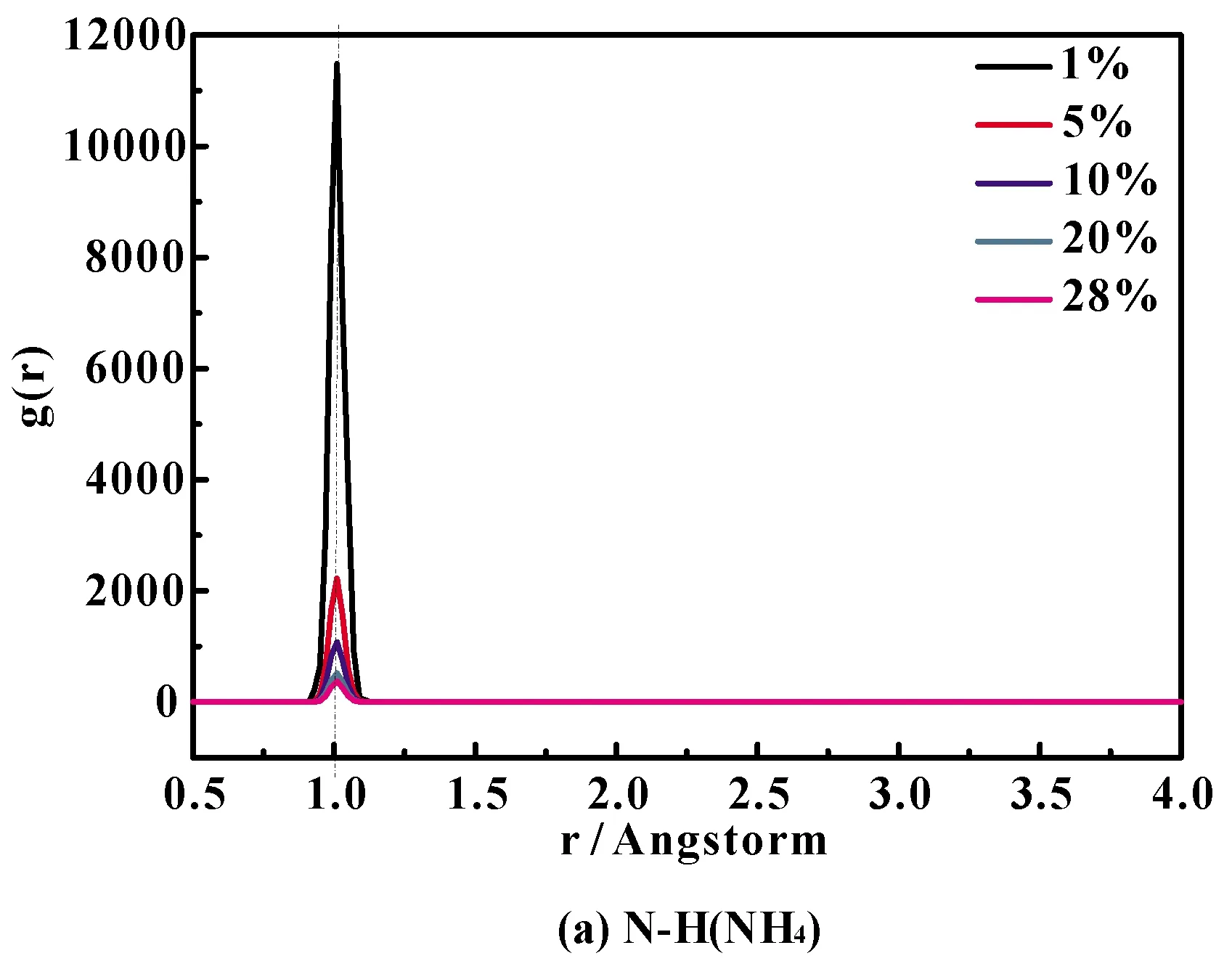

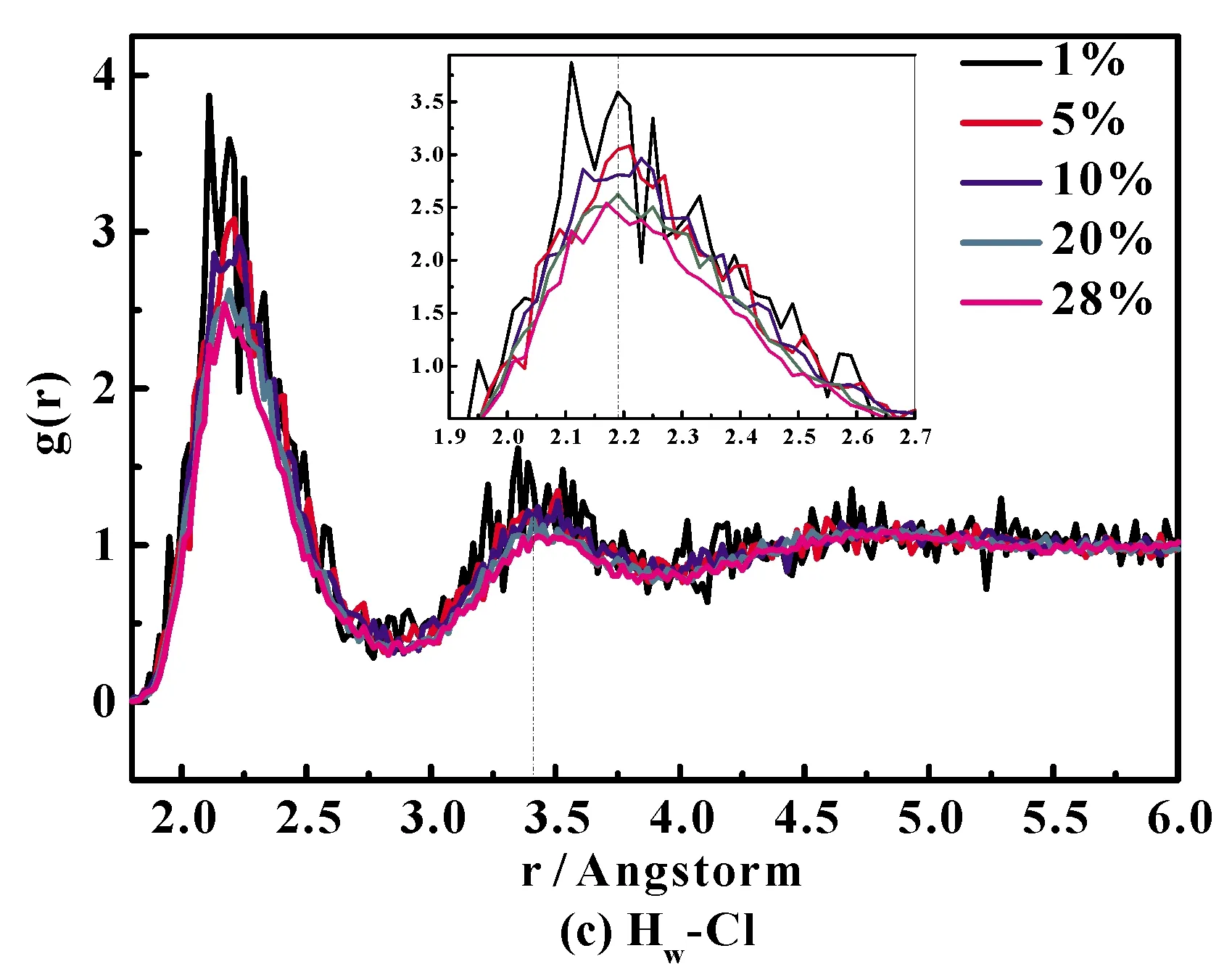
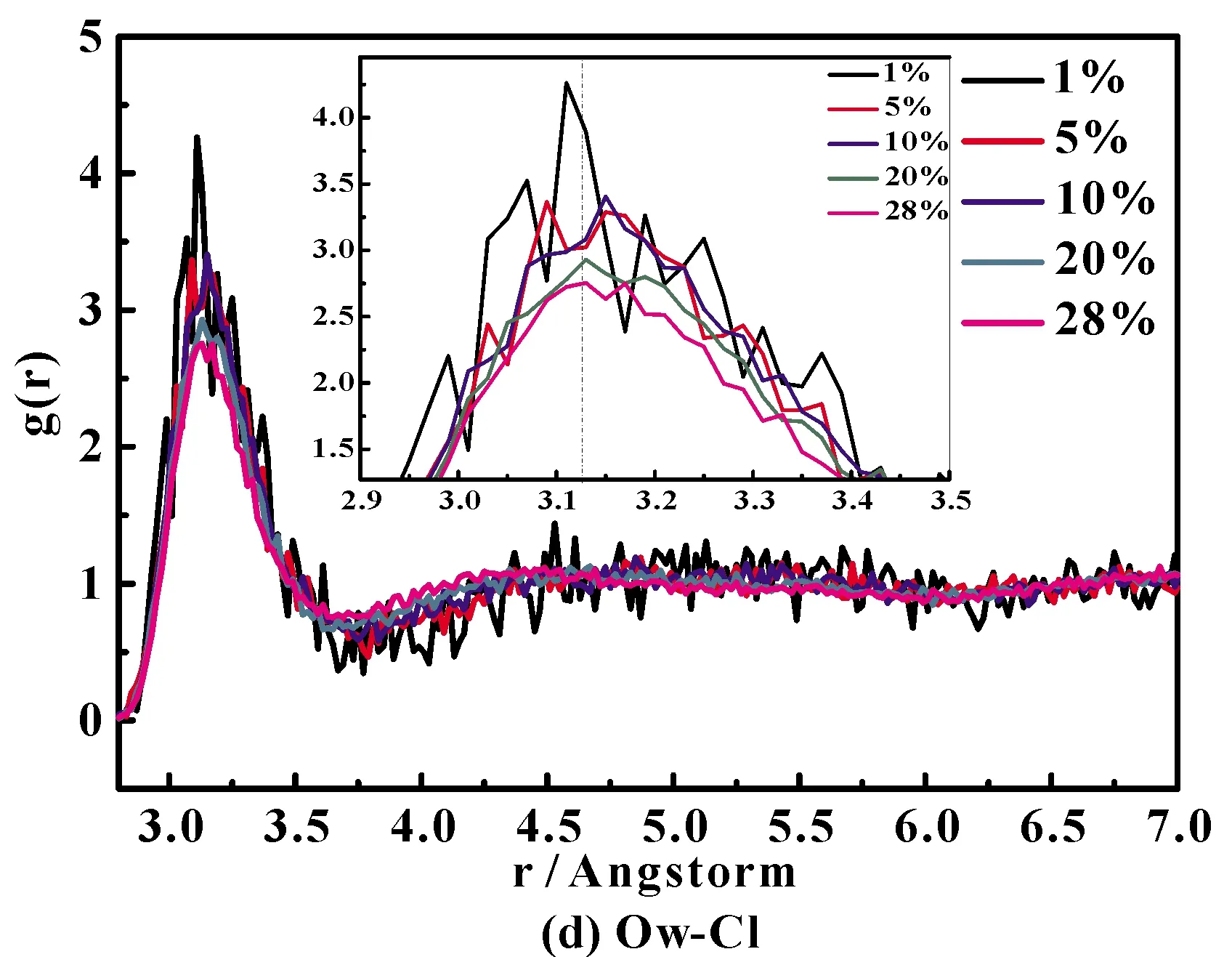
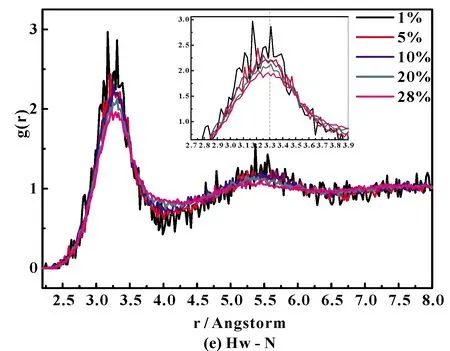


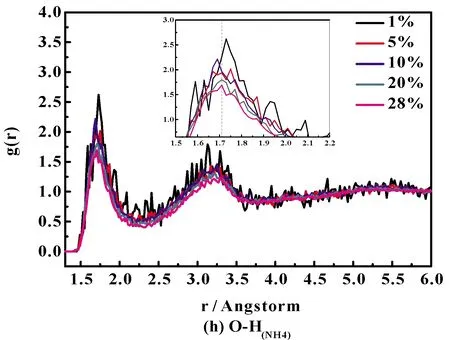
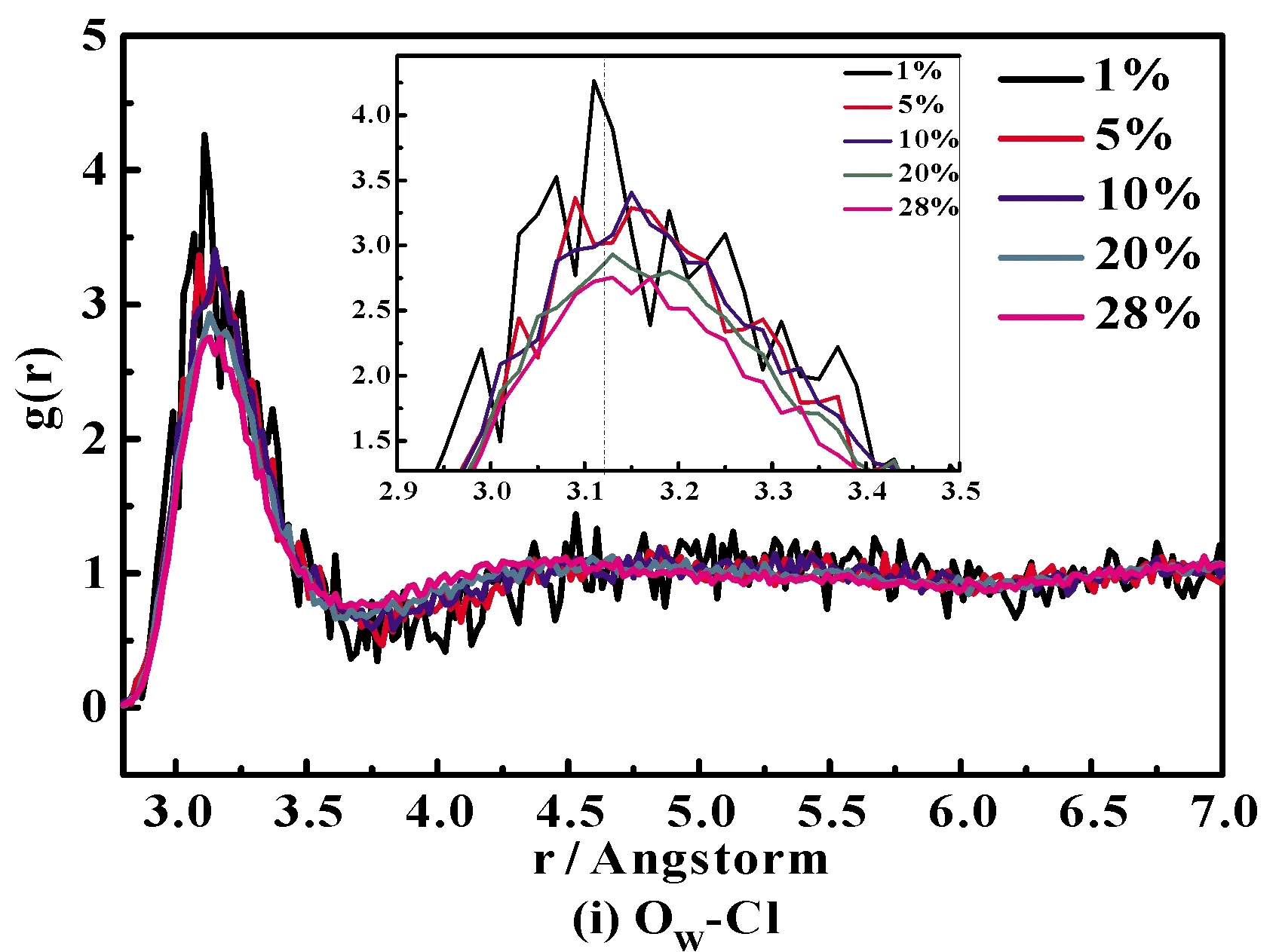
图4 NH4Cl水溶液中不同原子对径向分布函数:(a)N-HNH4, (b)O-Hw, (c)HW-Cl, (d)O-Cl, (e)N-HW, (f)N-O, (g)HW-HNH4,(h)O-HNH4 and (i)OW-Cl.Fig.4 Radial distribution functions for different atom pairs of NH4Cl aqueous solution: (a)N-HNH4, (b)O-Hw, (c)HW-Cl, (d)O-Cl, (e)N-HW, (f)N-O, (g)HW-HNH4,(h)O-HNH4 and (i)OW-Cl.
图4(c)、(d)分别为不同浓度下Cl-HW和Cl-O的径向分布函数,第一峰位分别是2.20 Å和3.12 Å. 从图中可以看出,随着NH4Cl浓度的增加,峰位没有变化,但是峰强均呈现逐渐降低的趋势. 这是由于高浓度时,Cl-增多,占据了水分子的间隙,Cl-周围的水分子数目逐渐变少,水分子之间的作用力减弱,Cl-配位数减少.
图4(e)、(f)分别是N-HW和N-OW的径向分布函数图,第一峰位分别是3.30 Å、和2.6 Å. 随着NH4Cl浓度的增加,峰强也都呈现逐渐降低的趋势,也就是说NH4+配位数减少. 同时,根据图4(a)、(e)我们也可以看出,N-HW和N-H(NH4)的第一峰位不同,这就说明,N(NH4)-Ion中Ion虽然都是H,但是作用力却不同,很明显,水中的氢离子比NH4+中的氢离子对N的影响作用要大的多.
将图4 (a)、(e)、(g)、(h)与图4(c)、(i)对比可得出,对于Cl-体系,Ion-O的RDF的第一峰位大于Ion-H;而对于NH4+体系,正好相反,Ion-H的RDF的第一峰位大于Ion-O,说明阳离子由周围水分子中的氧原子去靠近,而阴离子则由周围水分子中的氢原子去靠近. 再详细的说,对于氯化铵水溶液,铵根离子中的N及H都是由周围水分子中的氧原子来靠近,而氯离子则由周围水分子中的氢原子去靠近.
4.2 离子水化数和水化半径
离子周围水分子的配位数并不是离子的水化数,因为离子周围配位的水分子不全是水化的. 离子水化数[5]:
nhyd=nij(r)h
(4)
(5)
式中,rhyd为离子水化半径,v=2.991×10-29m3为一个水分子的体积.reff为离子有效半径,水分子的有效半径为0.318 nm.
根据以上公式(4)(5)可得,由于NH4+和Cl-配位数随着氯化铵水溶液浓度增加而减少,则离子水化数也就相应减少,水化半径也随之减小.
4.3 氢键数
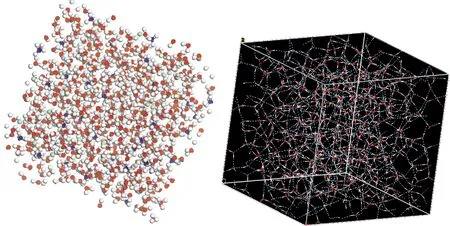
图5 (a)20%氯化铵水溶液体系的微观结构; (b)20%氯化铵水溶液体系的氢键网络结构Fig. 5 (a) Microstructure of 20% ammonium chloride solution system; (b) Hydrogen bond network structure of 20% ammonium chloride solution system
为了更直观的研究氯化铵水溶液中氢键情况,作者通过分子动力学模拟出体系稳定状态时的微观结构,图5为20%浓度的氯化铵水溶液达到平衡时的微观构型及加入氢键网络图. 然后统计出各浓度氯化铵水溶液的氢键数及键长变化,如表1所示. 随着浓度增加,氯化铵水溶液中氢键数逐渐增多,键长也增长,这和我们之前提到的氢键网络遭到破坏并不矛盾. 可以解释为,NH4+中的氢原子和水分子的氧原子之间形成弱氢键而适合液态水的四面体结构,虽然Cl-的加入破坏了溶液中的氢键,但是也生成了新的氢键,并且生成的数量大于被破坏的数量,但是氢键力却变弱了,这是之前研究当中没有人提过的现象.
表1 同一空间内不同浓度NH4Cl水溶液中氢键数及键长变化
Table 1 The changes of hydrogen bond number and bond length in different concentrations of NH4Cl aqueous solution in the same space

Name1%5%10%20%28%Hbond NO.11841188119814311460Hbond length(Å)1.781852571.809537781.837730281.884008931.91058799
4.4 扩散性质
本实验采用FORCITE模块中的ANALYSIS功能计算了不同质量分数氯化铵水溶液的中H2O、NH4+及Cl-的均方位移(MSD). 离子扩散系数的求取采用Einstein法[16],得出将离子的MSD对时间的曲线拟合成直线,斜率的六分之一即为离子的扩散系数,由此可以得到溶液H2O、NH4+及Cl-的扩散系数.
图6(a)~(c)给出了不同浓度NH4Cl溶液中H2O、NH4+及Cl-的均方位移(MSD)对时间的关系图,由此计算出的各离子扩散系数见表2. 可得出,随着浓度增大,H2O、NH4+及Cl-的扩散系数均逐渐降低,表明由于溶液浓度的增加,加剧了离子微观反向运动的震荡,从而导致离子的扩散系数降低,而降低幅度排序为NH4+> Cl-> H2O.
5 结 论
采用COMPASSⅡ力场,模拟计算了不同浓度氯化铵溶液中离子的动力学性质. 本文的结论如下:
(1) 随着氯化铵浓度增大,Cl-、NH4+配位数均减少,离子水化数也就相应减少,水化半径也随之减小.
(2) 水中的氢离子比铵根中的氢离子对N(NH4)的影响作用要强的多.
(3) 对于氯化铵水溶液,铵根离子中的N及H都是由周围水分子中的氧原子来靠近,而氯离子则由周围水分子中的氢原子去靠近.
(4) 随着浓度增加,氯化铵水溶液中氢键数逐渐增多,键长也增长.
(5) 随着浓度增大,H2O、NH4+及Cl-的扩散系数逐渐降低,而降低幅度排序为NH4+> Cl-> H2O.
表2 不同浓度NH4Cl溶液中H2O、NH4+及Cl-的扩散系数
Table 2 Diffusion coefficients of H2O, NH4+and Cl-in different concentrations of NH4Cl solution
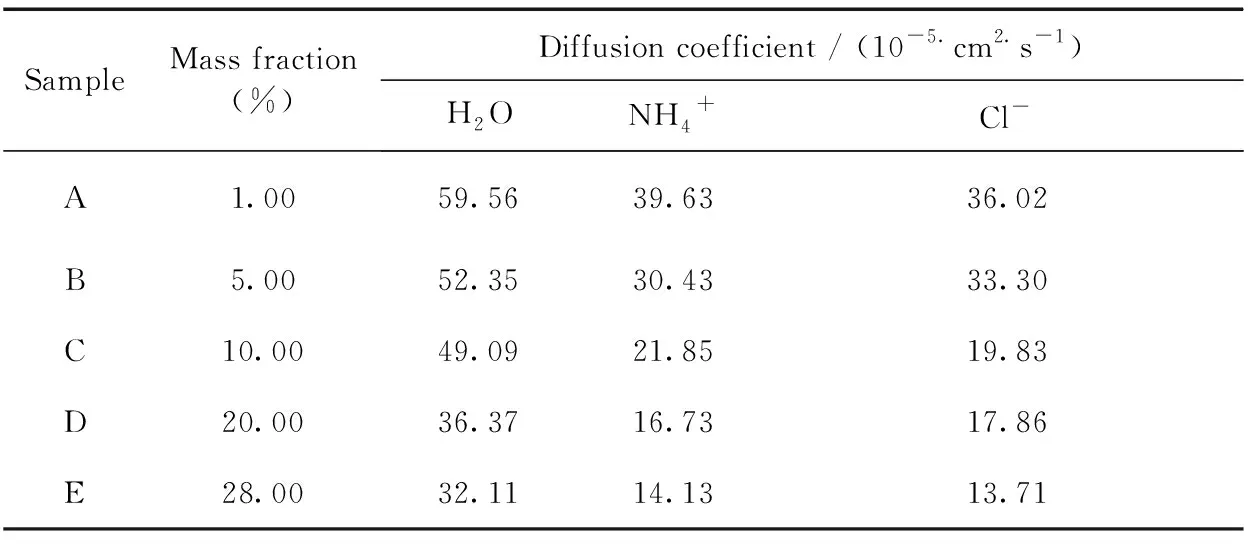
SampleMass fraction(%)Diffusion coefficient / (10-5.cm2.s-1)H2ONH4+Cl-A1.0059.5639.6336.02B5.0052.3530.4333.30C10.0049.0921.8519.83D20.0036.3716.7317.86E28.0032.1114.1313.71



图6 不同浓度NH4Cl水溶液中离子的MSD与时间之间的关系: (a) H2O (b) NH+ (c) Cl-Fig. 6 Relationships between MSD and time for ions in NH4Cl solutions at different concentrations: (a) H2O (b) NH+ (c) Cl-
