乳酸菌缓解酒精性肝病的研究进展
2020-04-25李慧臻史佳鹭关嘉琦闫芬芬霍贵成
李慧臻,史佳鹭,占 萌,关嘉琦,闫芬芬,霍贵成*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
酒精是全世界死亡和残疾调整生命年(disabilityadjusted life-years,DALYs)的第七大风险因素,也是15~49 岁人群的首要死因[1]。据世界卫生组织(World Health Organization,WHO)的最新报道,2016年酒精造成大约300万 人死亡,占全球死亡人数的5.3%[2]。酒精的过度消费带来了严重的社会和经济负担,更是导致慢性肝病的最常见原因之一。长时间过量饮酒常常导致酒精性肝病(alcoholic liver disease,ALD)[3]。酒精性肝病包括以下几种组织病理学变化:肝脂肪变性、酒精性脂肪性肝炎、肝纤维化(通常始于肝小叶的静脉周围区域)、肝硬化和肝癌[4]。这些组织病理学变化可以在同一患者中单独、同时或依次发生[5]。超过90%的重度饮酒者会产生肝脂肪变性,并且大约有30%的重度饮酒者会形成严重的酒精性肝病[6-7]。通过长达10 年的随访调查发现,酒精性肝脂肪变性患者的死亡率远高于未患有酒精性肝脂肪变性的人(分别为74%、25%),且前者发生肝硬化的概率也比后者高出不少(分别为21%、1%)[8]。酒精性肝病是欧洲肝脏移植的主要原因[9],也是 美国继丙型肝炎病毒(hepatitis C virus,HCV)之后的第二大肝移植原因[4]。在发达国家和发展中国家中,酒精性肝病的死亡率都越来越高,已成为最严重的健康问题 之一[10]。我国的酒精消费增长速度明显快于世界其他地区[11],但我国目前尚缺乏全国的酒精性肝病流行病学调查,部分地区的ALD流行病学调查显示,酒精性肝病的患病率呈现上升趋势[12-17]。目前还没有美国食品药品监督管理局批准的治疗酒精性肝病的药物[18]。乳酸菌(lactic acid bacteria,LAB)是一类可以利用可发酵的碳水化合物产生大量乳酸的革兰氏阳性菌的总称,兼性厌氧,不产生芽孢,在世界范围内被公认为是安全等级(Generally Recognized as Safe,GRAS)的食品微生物[19-20]。乳酸菌已经在乳制品和其他食品当中安全使用一百多年[21]。近年来,由于肠道微生物研究的快速兴起,人们越来越关注乳酸菌用于预防、减轻或者治疗特定疾病的作用[22]。国内外大量的研究发现,乳酸菌能够预防和治疗酒精性肝病,因此,乳酸菌在酒精性肝病中的潜在作用正在受到越来越多的关注和研究。在这篇综述中,简要总结了最近在患者和动物模型中使用乳酸菌缓解酒精性肝病的研究。
1 酒精性肝病
早在1973年,Rubin和Lieber首次证明,用含酒精的营养充足的液体食物喂养狒狒,酒精会对狒狒产 生直接的肝毒性[23]。因此,大量的研究人员开始研究酒精的吸收代谢途径以及酒精性肝病的病理学变化机理。酒精进入体内时,一般经过口腔、食管、胃和小肠等吸收到人体的各个组织器官中,其中,口腔吸收的酒精极 少,胃能够吸收10%~20%,小肠可以吸收75%~80%;吸收入体内的酒精不能储存,只能被代谢掉,酒精的主要代谢场所是肝脏,其中90%以上的酒精在肝脏中进行氧化代谢,只有大约5%~10%的酒精未经氧化代谢直接经尿液、呼吸道和汗液排出,因而肝脏是酒精损伤的主要靶器官(图1)[24]。酒精进入体内后,可直接造成肠道菌群组成的变化[25-26],促进了肠道革兰氏阴性菌的生长,并破坏肠屏障的完整性,使肠道通透性增加,从而提高了外周血中脂多糖(lipopolysaccharides,LPS)(又称为内毒素)的水平[27],到达肝脏的过量脂多糖可以激活肝脏的库普弗细胞,从而产生活性氧(reactive oxygen species,ROS)和炎性细胞因子,这是肝脏炎症和纤维化的开始。酒精在肝脏进行代谢的过程当中,会产生大量乙醛,乙醛对肝细胞具有毒性作用,造成肝细胞损伤[28];同时酒精代谢也会伴随着大量ROS的产生,并降低肝脏中抗氧化酶的活性,造成氧化应激,从而损伤肝细胞,进一步造成肝脏脂质过氧化和脂肪变性[10]。酒精的摄入增加了体内铁的含量[29],即使中等水平的酒精摄入也可提高血清铁蛋白的水平,并增加转铁蛋白的饱和度,使肝脏的铁含量增加,游离亚铁离子(Fe2+)与过氧化氢(H2O2)发生芬顿反应,导致ROS增加,从而促进ALD的发展[10]。酒精性肝病的具体相关病理变化如图2所示。

图1 酒精吸收、排出示意图[24]Fig. 1 Schematic diagram of alcohol absorption and excretion[24]

图2 酒精性肝病的相关病理变化[30]Fig. 2 Pathological changes associated with alcoholic liver disease[30]
2 乳酸菌缓解酒精性肝病的机制
人体肠道内存在大量的乳酸菌,乳酸菌通过抑制有害菌的黏附定植 及生长、产生有益的代谢产物和调节机体的免疫及代谢水平等发挥着至关重要的作用。近些年来,愈来愈多的实验证明,乳酸菌能够缓解酒精性肝病。Kirpich等经过一项前瞻性随机临床实验表明,与健康对照组相比,酒精性肝病患者组血清中的丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)含量显著升高;而在口服乳酸菌(两歧双歧杆菌和植物乳杆菌8PA3)治疗5 d后,与标准治疗组(戒酒+维生素)相比,乳酸菌治疗组的患者血清中的ALT和AST水平显著降低[31]。
国内外许多研究人员在大量的乳酸菌缓解酒精性肝病的研究中,已经提出了几种重要的机制,包括调整肠道菌群、改善肠屏障功能、减弱肝脏氧化应激、调节肝脏炎症水平和抑制肝脏脂肪堆积[32]。
2.1 乳酸菌通过调整肠道菌群缓解酒精性肝病
人体肠道菌群由细菌、真菌、古生菌和病毒构成[33],其微生物数目与人体自身细胞数目的比例约为1∶1[34]。已经在多种疾病中描述了肠道菌群的改变,例如肝硬化、炎症性肠病、帕金森病、孤独症和艰难梭菌感染[35-38]等。肠道和肝脏之间有着密切的解剖学及功能关系,称为肠肝 轴,越来越多的研究证明,肠道菌群通过肠肝轴在酒精性肝病的发生和发展中发挥着重要的作用。肠道菌群中的主要菌门包括厚壁菌门、拟杆菌门、变形菌门和放线菌门,正常情况下,各个菌门保持动态平衡;而大量的研究表明,酒精性肝病患者的肠道菌群紊乱,例如拟杆菌门的丰度降低和变形菌门的丰度增加等[39]。酒精直接作用于肠道菌群,使革兰氏阴性菌的数量增加后,其细胞壁成分LPS会更多地进入门静脉循环并到达肝脏,超出肝脏的清除能力,会造成肝脏氧化应激和炎性浸润。Bajaj等研究表明,在酒精性肝硬化患者的肠道菌群中,肠杆菌科(属于变形菌门)的相对丰度增加,毛螺菌科和瘤胃菌科(二者属于厚壁菌门)的相对丰度降低[40]。Llopis等将38 名住院患者(16 名无酒精性肝炎患者,12 名非严重酒精性肝炎患者和10 名严重酒精性肝炎患者)进行分析发现,肠杆菌科等潜在致病家族的丰度与酒精性肝炎的严重程度呈现出正相关[41]。为了进一步研究肠道菌群与酒精性肝病的关系,Kang等将酒精性肝硬化患者的粪便移植于无菌小鼠后,在小鼠体内发现细菌移位和肝脏炎症[42]。因此,调整肠道菌群或许能够预防/治疗酒精性肝病。
Bull-Otterson等在实验的最后2 周,将鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG,LGG)菌悬液(1×109CFU/mL)加入到小鼠的含酒精的Lieber-DeCarli液体饲料中,实验结束后,将小鼠的粪便进行宏基因组分析发现,酒精组小鼠肠道中的厚壁菌门和拟杆菌门丰度显著降低,而变形菌门和放线菌门的比例显著增加,与肠道菌群的定性和定量改变相一致,血清中LPS和ALT水平显著增加,肝脏炎症以及肝损伤明显;LGG菌悬液加入后,可能是由于产生了短链脂肪酸(short chain fatty acid,SCFA)和降低了肠道内的pH值,显著抑制了肠道菌群的上述变化,明显降低了血清中的LPS和ALT水平,缓解了肝脏炎症以及肝损伤[43]。武岩峰在LGG缓解慢性酒精性肝损伤的研究中也得出了部分类似的结果[44]。一项随机双盲的临床实验表明,酒精性肝炎患者补充屎肠球菌或枯草芽孢杆菌7 d后,粪便中革兰氏阴性的大肠杆菌数量显著减少,血清中的LPS、ALT、AST和γ-谷氨酰转肽酶水平显著降低,肝脏中的肿瘤坏死因子(tumor necrosis factor-α,TNF-α)水平也显著降低,这意味着屎肠球菌或枯草芽孢杆菌通过调整肠道菌群,进一步改善了内毒素血症,从而减弱了肝脏炎症,改善了肝功能[45]。张冬进行的随机双盲的临床实验显示,治疗酒精性肝病的同时增加口服益生菌制剂(含有长双歧杆菌、嗜酸乳杆菌和粪肠球菌),可以使酒精造成的紊乱的肠道菌群恢复至接近健康对照组,从而减轻肝损伤[46]。
肠道菌群中除细菌之外的微生物,例如真菌、古生菌和病毒,它们可以调节宿主和细菌之间的相互作用并直接影响宿主和细菌。在小鼠ALD模型中,酒精摄入导致真菌过度生长,尤其是念珠菌属,可增加肝损伤[47]。研究人员还发现,真菌细胞壁上的β-葡聚糖通过结合库普弗细胞上的C型凝集素样受体CLEC7A,上调白细胞介素(interleukin,IL)-1β水平,从而诱发肝脏炎症[47]。目前,还没有关于乳酸菌是否能够抑制酒精造成的其他微生物(除细菌之外)紊乱的相关报道,这或许是未来研究的一个方向。
2.2 乳酸菌通过改善肠屏障功能缓解酒精性肝病
肠屏障是肠肝轴的一个重要组成部分,肠屏障包括物理层和免疫层,具体而言,包括具有共生微生物、分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)和抗菌肽的黏液层;相邻细胞间紧密连接的肠上皮细胞层;含有先天和适应性免疫细胞(例如T细胞、B细胞,巨噬细胞和树突状细胞)的固有层(图3)[48-49]。其中,肠上皮细胞层是最重要的一道屏障,肠上皮细 胞通过紧密连接、黏着连 接和桥粒形成肠上皮细胞屏障[50],而紧密连接是肠上皮细胞之间最关键的连接方式[51],紧密连接由跨膜蛋白(例如claudins和occludin)、外周膜蛋白(例如ZO-1和ZO-2)和调节蛋白构成。酒精摄入后,会抑制紧密连接蛋白的表达,从而破坏肠上皮细胞屏障,导致肠道的通透性增加[52],大量的LPS进入门静脉循环到肝脏后,刺激库普弗细胞,产生氧化应激以及炎症反应。
Kim等研究发现,给小鼠灌胃植物乳杆菌LC27、长双歧杆菌LC67以及二者的复合物,可显著提高酒精抑制的紧密连接蛋白(occludin和claudin-1)的表达,从而抑制酒精造成的肠道通透性增加,降低血清中的LPS含量,进一步通过检测肝脏中TNF-α等指标发现,酒精引起的炎症得到缓解;并且在Caco-2细胞模型中发现,只用酒精处理Caco-2细胞,紧密连接蛋白(occludin和claudin-1)表达量显著降低,而加入植物乳杆菌LC27、长双歧杆菌LC67或二者的复合物后,再用酒精处理时,无论是单菌株还是复合菌株都可显著增加酒精抑制的occludin和claudin-1的表达[53]。李逢源给小鼠喂食LGG的发酵上清液(LGGs)也发现了上述类似的结果[54]。一项研究表明,与酒精组的小鼠相比,酒精+发酵乳杆菌LA12组的小鼠的ZO-1、occludin和claudin-1的蛋白表达量显著提高,并且恢复了小鼠的小肠绒毛长度和隐窝深度,血清中的ALT和AST含量显著降低,显示出LA12通过保护肠道屏障,预防了酒精造成的肝损伤[55]。Chang等给大鼠灌胃益生菌制剂VSL#3(包含短双歧杆菌、长双歧杆菌、婴儿双歧杆菌、嗜酸乳杆菌、植物乳杆菌、副干酪乳杆菌、保加利亚乳杆菌和嗜热链球菌)表明,VSL#3可以防止酒精引起的ZO-1和occludin的mRNA及蛋白表达量降低,通过电子显微镜观察小肠的紧密连接,也进一步显示出VSL#3可防止酒精对紧密连接的破坏,从而防止了酒精造成的肠道通透性增加[56]。
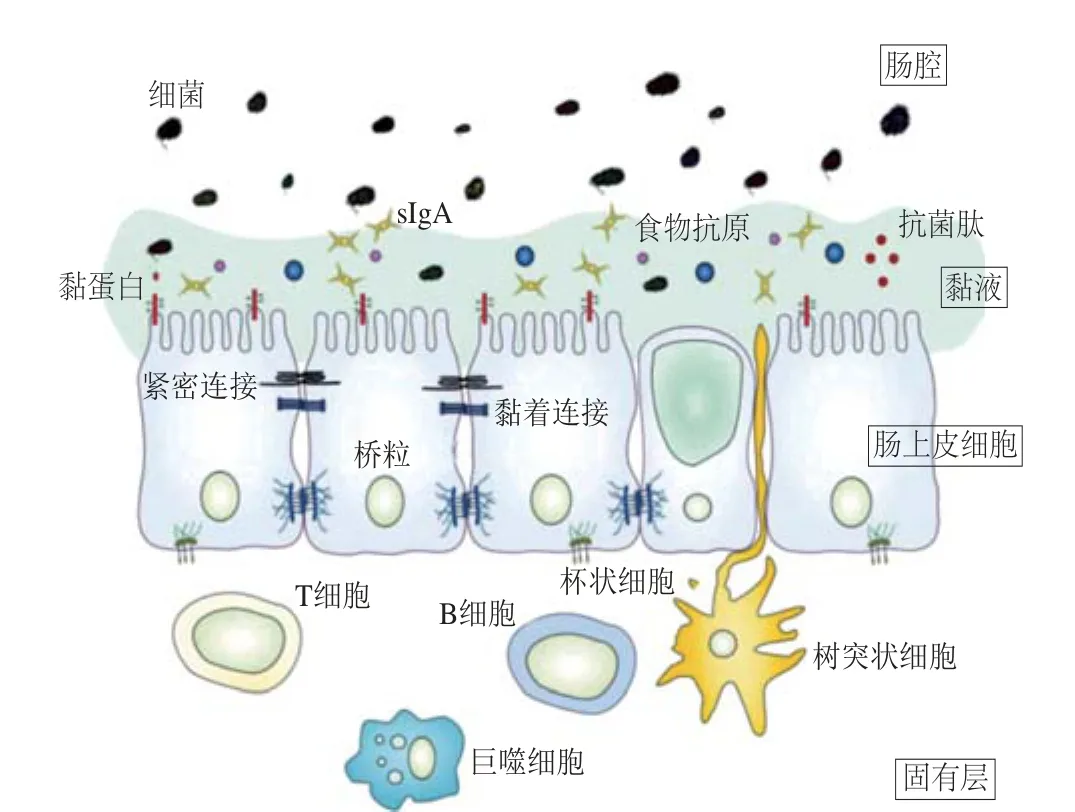
图3 肠屏障主要成分的示 意图[49]Fig. 3 Schematic diagram of the major components of the intestinal barrier[49]
另外,缺氧诱导因子(hypoxia inducible factor,HIF)是调节多种肠屏障保护因子的重要转录因子,包括肠三叶因子(intestinal trefoil factor,ITF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、P-糖蛋白(P-glycoprotein,P-gP)和抗菌肽等[57-60]。酒精摄入后,会减少HIF的表达,从而使多种肠屏障保护因子的表达减少,损坏肠屏障功能。有研究表明,给小鼠补充LGG能显著抑制酒精造成的HIF-2α表达降低,从而恢复酒精降低的ITF和VEGF水平,同时,LGG还恢复了紧密连接蛋白(ZO-1、claudin-1和occludin)的表达,LGG通过上述几个方面改善了肠道通透性,通过肝脏病理切片可以看出,肝损伤得到显著缓解;研究人员也在Caco-2细胞模型中进一步验证了LGG对肠屏障的修复作用[58]。将乳酸菌改善肠屏障功能的具体机制总结于图4中。
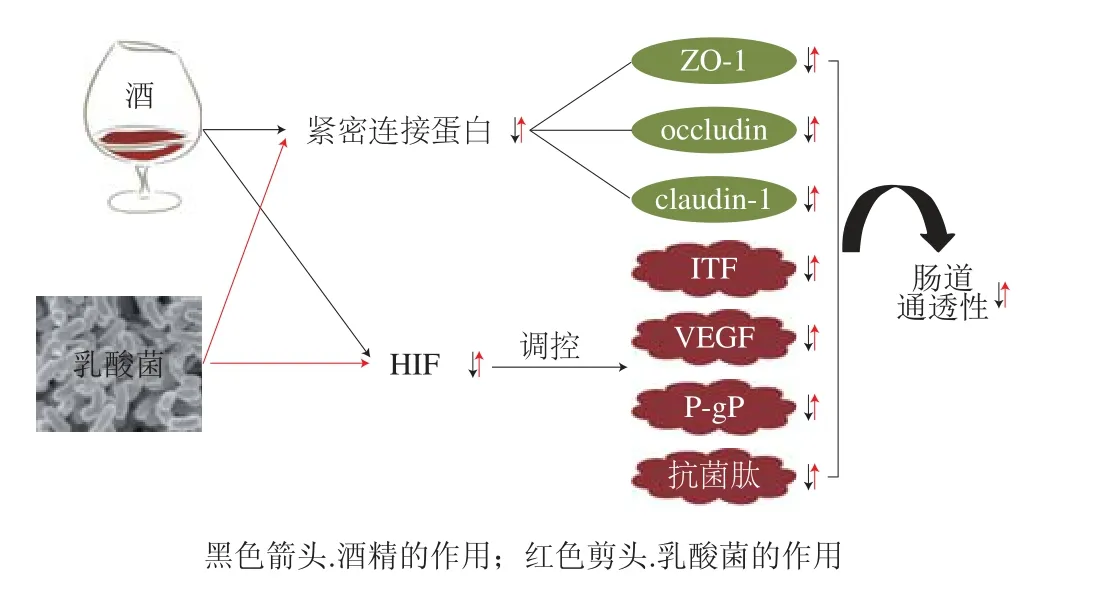
图4 乳酸菌改善肠屏障功能示意图Fig. 4 Schematic diagram of the role of lactic acid bacteria in improving intestinal barrier function
2.3 乳酸菌通过减弱肝脏氧化应激缓解酒精性肝病
氧化应激被认为是酒精性肝病的主要致病途径之一。无论是急性酒精摄入还是慢性酒精摄入,进入体内的大量酒精在肝脏中进行代谢,代谢过程中产生大量的ROS,ROS除直接损伤肝细胞外,还能够增加肝细胞对脂质过氧化的敏感性,引起肝细胞损伤;另外,还发现ROS能够在细胞膜上与细胞色素P450 2E1(cytochrome P450 2E1,CYP2E1)结合,从而引起抗体依赖的细胞毒性作用,使肝细胞损伤,导致ALD的病理学变化。酒精摄入还会降低抗氧化酶(包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽和谷胱甘肽过氧化物酶)的活性,由于ROS增多,而抗氧化酶减少,产生氧化应激,造成肝脏脂质过氧化以及脂肪变性。

图5 酒精在肝脏中代谢的三个主要途径示意图[10]Fig. 5 Schematic diagram of three major pathways for alcohol metabolism in liver[10]
酒精在肝脏中代谢的三个主要代谢途径如图5所示。具体而言,乙醇通过乙醇脱氢酶(alcohol dehydrogenase,ADH)代谢为乙醛,乙醛随后被乙醛脱氢酶(aldehyde dehydrogenase,ALDH)代谢,这些反应都会增加细胞质或线粒体中还原型烟酰胺腺嘌呤二核苷酸/烟酰胺腺嘌呤二核苷酸的比例,从而加剧肝细胞中ROS的产生,这可能与增加线粒体呼吸链中电子的流动有关[61];酒精代谢导致肝细胞中ROS增加的另一个原因是微粒体乙醇氧化系统,以前的研究表明,乙醇可以增加CYP2E1的活性和蛋白表达量,CYP2E1在代谢乙醇时产生ROS,CYP2E1诱导的程度与ROS的产生有关[62];并且,乙醛是乙醇代谢的中间产物,它是一种毒性很强的物质,直接结合并降低抗氧化酶的活性[63]。

图6 乳酸菌减弱肝脏氧化应激示意图Fig. 6 Schematic diagram of the role of lactic acid bacteria in weakening liver oxidative stress
此外,LPS刺激库普弗细胞后,也会产生一定量的ROS;酒精造成肝脏铁含量增加后,同样增加ROS的生成。酒精同时还可以降低肝脏中一些抗氧化通路基因的表达量。大量的研究证明,乳酸菌可以通过减少肝脏中ROS的产量,增加抗氧化酶的活性以及恢复抗氧化通路基因的表达来减弱肝脏中的氧化应激(图6),从而缓解酒精性肝病。
迟菲菲在给小鼠灌胃酒精后,间隔几小时将鼠李糖乳杆菌Z7和植物乳杆菌N31分别灌胃给小鼠,研究发现,鼠李糖乳杆菌Z7和植物乳杆菌N31可阻止酒精造成的超氧化物歧化酶、谷胱甘肽和谷胱甘肽过氧化物酶表达的降低,两个乳酸菌组的丙二醛(malondialdehyde,MDA)水平与空白组无显著差异,肝脏病理切片也表明,鼠李糖乳杆菌Z7和植物乳杆菌N31预防了酒精引起的肝脂肪变性[64]。王慧晶在研究中用筛选出来的乳酸菌也 得出了上述结论[65]。Zhao Lei等给小鼠灌胃植物乳杆菌C88能预防酒精摄入后引起的肝损伤,具体是由于植物乳杆菌C88能够增强肝脏中超氧化物歧化酶的活性,抑制酒精引起的CYP2E1的蛋白表达量的增加,并增加核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)的mRNA和蛋白表达量[66]。Chuang等将热灭活的唾液乳杆菌或约氏乳杆菌与酒精一起加入到培养好的HepG2细胞中,发现热灭活的唾液乳杆菌和约氏乳杆菌都可以防止酒精造成的MDA含量增加,这种情况在接下来的大鼠实验中也得到证实[67]。
2.4 乳酸菌通过调节肝脏炎症水平缓解酒精性肝病
酒精摄入后,导致通过门静脉运输到肝脏的LPS增多,LPS刺激肝脏库普弗细胞,从而引起肝脏炎症。具体信号传导过程(图7)如下所述,LPS与血清中的LPS结合蛋白(LPS-binding protein,LBP)结合,经血液循环后,与肝脏库普弗细胞膜上的CD14形成复合物,复合物中的LPS解聚后,在分泌蛋白MD-2辅助下,与Toll样受体4(Toll-like receptor 4,TLR4)结合,导致TLR4活化,然后TLR4胞内尾状结构与接头蛋白MyD88结合,后者通过其死域与IL-1受体相关激酶(IL-1 receptor-associated kinase,IRAK)结合,二者相互作用引起IRAK自身磷酸化,进而激活肿瘤坏死因子受体相关因子6(TNF-receptor-associated factor 6,TRAF6),后者再激活IκB激酶(IκB kinase,IKK)复合物,使其磷酸化IκB并发生降解,由此NF-κB得以释出而转位入核,与DNA分子特定基因增强子/启动子的RHD区内NF-κB位点结合,启动多种炎性细胞因子(如TNF-α、IL-6等)、ROS和辅助刺激分子CD80与CD86基因的转录,以上就是TLR4介导LPS活化NF-κB信号公认的通路,但也有报道称,LPS可直接与TLR4相结合。在信号传导入细胞内时,还能激活细胞内的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径,与NF-κB的信号途径协同,引发机体的一系列炎症反应[68]。国内外学者的研究表明,乳酸菌可以抑制酒精增强的CD14、TLR4以及NF-κB和MAPK通路中一些基因的表达来减少TNF-α、IL-6等炎症因子的产生,从而降低肝脏炎症水平。
Wang Yuhua等给小鼠喂食含酒精的液体饲料发现,酒精显著增加了TLR4的mRNA表达,导致TNF-α的mRNA表达量明显增加,髓过氧化物酶(myeloperoxidase,MPO)活性显著增强,在小鼠的含酒精的液体饲料中加入LGG后,LGG能显著降低TLR4的mRNA表达量,从而降低TNF-α的mRNA表达量,MPO活性也显著降低;用LGGs预处理外周血单个核细胞(peripheral blood mononuclear cell,PBMC)发现,LGGs可以显著抑制LPS激活的p38MAPK磷酸化,从而明显降低TNF-α的活性[69]。有实验证明,给小鼠灌胃乳酸菌(鼠李糖乳杆菌R0011和嗜酸乳杆菌R0052)后,酒精造成的TLR4的蛋白表达量增加被显著抑制,进一步降低了TNF-α的活性,从而降低了肝脏炎症水平[70]。Stadlbauer等进行了一项开放性研究,酒精性肝硬化患者每天给予3 次干酪乳杆菌Shirota(6.5×109CFU),持续4 周,与未给予干酪乳杆菌Shirota的酒精性肝硬化患者相比,TLR4的表达量显著降低,并改善了中性粒细胞的吞噬功能,减轻了肝脏炎症[71]。将植物乳杆菌C88灌胃给小鼠,发现它可以显著阻止乙醇诱导的p65的mRNA和蛋白表达量增加,并且也可以显著抑制酒精引起的p38MAPK的磷酸化,表明植物乳杆菌C88通过抑制NF-κB和MAPK通路,降低了肝脏中TNF-α、IL-6和IFN-γ的水平,预防了酒精引起的肝脏炎症[66]。

图7 TLR4介导LPS活化NF--κB信号示意图Fi g. 7 Schematic diagram of Toll-like receptor 4-mediated lipopolysaccharides activation of NF-κB signal
2.5 乳酸菌通过抑制肝脏脂肪堆积缓解酒精性肝病
脂质在机体机内存在的主要形式是甘油三酯,肝脏、脂肪组织和小肠是合成甘油三酯的场所,其中,肝脏合成甘油三酯的能力最强。正常情况下,肝脏中甘油三酯的合成和脂肪酸的氧化保持动态平衡,而酒精摄入会造成甘油三酯合成增加、脂肪酸氧化减少,从而导致甘油三酯在肝脏中堆积,肝脏脂肪堆积能促进脂肪变性的发展,并进一步发展为炎症、纤维化和肝硬会具体而言,腺苷一磷酸激活蛋白激酶(adenosinemonophosphate-activat ed protein kinase,AMPK)是一种关键的代谢主开关,它可以调节许多组织(包括肝脏)中参与脂质代谢的靶酶[72-73]。乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)是肝脏中脂肪酸生物合成的限速酶,它可以催化乙酰辅酶A转化为丙二酰辅酶A,丙二酰辅酶A是脂肪酸合成的前体,AMPK能够灭活ACC增加脂肪酸氧化[74]。此外,AMPK还可调节甾醇调节元件结合蛋白-1(sterol regulatory element binding protein-1,SREBP-1)[73]和过氧化物酶体增殖物激活受体-α(peroxisome proliferator activated receptor-α,PPAR-α)[75-76],SREBP-1是调节脂肪酸合成的重要转录因子,而PPAR-α是调节脂肪酸氧化的关键转录因子。酒精摄入后,降低肝脏AMPK的磷酸化,从而降低了ACC的磷酸化水平,ACC活性升高,脂肪酸合成增加;AMPK的磷酸化水平降低也会导致SREBP-1的表达量增加,而PPAR-α的表达量减少,使脂肪酸合成增加、氧化减少,从而导致肝脏脂肪堆积。因此,减少或预防肝脏中的脂肪积聚可能是缓解ALD的有效策略。
Zhang Min等在小鼠的含酒精液体饮食中加入LGGs发现,LGGs能够显著阻止酒精造成的AMPK磷酸化的降低,从而显著抑制了ACC活性的增加,显著抑制了SREBP-1蛋白表达量的增加,恢复了PPAR-α的mRNA表达量,并且明显抑制了酒精导致的硬脂酰辅酶A去饱和酶-1(stearoyl-CoA desaturase-1,SCD-1)的表达量增加,SCD-1作为SREBP-1下游的一个关键酶,在脂肪酸合成中也起着重要作用;此外,检测游离脂肪酸(free fatty acid,FFA)和甘油三酯(triglyceride,TG)时发现,酒精显著增加了肝脏中FFA和TG的含量,而LGGs显著减少了二者的含量[77]。Segawa等给小鼠灌胃热灭活的短乳杆菌SBC8803后发现,热灭活的短乳杆菌SBC8803能够显著抑制酒精导致的SREBP-1的mRNA表达量的增加,并且明显降低了肝脏中的TG含量,再通过肝脏切片的苏木精-伊红染色和油红O染色的观察,发现热灭活的短乳杆菌SBC8803可以显著抑制酒精导致的肝脏脂肪堆积[78]。
3 结 语
随着全球酒精性饮品饮用量的逐年增加,酒精性肝病已经成为世界上各个国家研究人员关注的焦点。越来越多的研究证明,乳酸菌可以通过调整肠道菌群、改善肠屏障功能、减弱肝脏氧化应激、调节肝脏炎症水平和抑制肝脏脂肪堆积来缓解酒精性肝病。乳酸菌是一种天然的益生菌,这为人们预防和治疗酒精性肝病提供了一条新的思路。就目前来看,虽然乳酸菌在缓解酒精性肝病的研究方面已经取得了一些进展,但由于酒精性肝病自身的复杂性、研究方法的局限性以及研究技术上的不足,导致乳酸菌缓解酒精性肝病的具体分子机制还不是十分清楚,在由表象研究深入到内在分子作用机理的研究仍然需要不断努力;并且只发现了个别菌株能够缓解酒精性肝病,临床研究也较少,导致临床研究数据缺乏。因此,有必要进一步从分子水平上和基因水平上来研究乳酸菌是如何缓解酒精性肝病的,这将为乳酸菌预防和治疗酒精性肝病提供扎实的理论基础,同时,还需要进一步挖掘能够缓解酒精性肝病的菌株,并进行大量的临床研究,为进一步开发新型预防和治疗酒精肝病的生物类药物提供理论支撑,加快生物技术缓解酒精性肝病的步伐。
