阴极电势对微生物电合成系统还原CO2合成有机物性能的影响
2020-04-25陈小进廖梦根
柳 焜,王 黎,胡 宁,陈小进,廖梦根
(武汉科技大学 环境污染绿色控制与修复技术研究中心,湖北 武汉 430081)
随着化石能源的燃烧,自然界中CO2的含量呈现逐年上升的趋势。由于在热力学上的稳定性和动力学上的惰性,CO2很难与其他物质发生反应[1]。利用微生物电合成系统(Microbial Electrosynthesis System,简称MES)还原CO2是近几年兴起的一种电化学技术[2]。MES可以利用产电微生物电化学氧化还原反应的联合作用减少CO2转化为增值化学品所需的热力学能量,实现废弃物向可利用的化学物质的转换[3-4]。
MES合成有机物的性能受到多种因素的影响,主要包括阴极材料、阴极微生物、阴极电势、质子交换膜等。祁家欣等[5]利用羟基改性碳布电极使乙酸的产量提高了243%。BATLLEVILANOVA等[6]利用巨球型菌(Megasphaerasp.)通过链延长的方式将乙酸合成丁酸。XIANG等[7]采用双极膜取代质子交换膜,与使用质子交换膜相比,乙酸产量提高了238%,并且在阴极的醋杆菌(Acetobacteriumsp.)相对丰度比之前高。而阴极电势对MES中还原CO2合成有机物的过程也有重要的影响。例如JIANG等[8]发现在稳定的阴极电势下,MES能在固定CO2的同时合成乙酸等有机物,外加电势对MES中产物的类型和组成及细胞的代谢有着极其重要的影响。这主要体现在过高的电极电势或者过低的电极电势会对电化学功能微生物产生负面的影响,并会导致电化学反应体系中功能菌生长代谢的酶减少,无法进行物质合成和能量代谢,甚至导致细胞死亡。但是不同的阴极电势对MES还原CO2合成有机物的能力的影响规律还缺乏较为全面的认识。
本工作通过调节阴极电势提升MES还原CO2合成有机物的性能,以期为MES的工业化应用提供理论依据。
1 实验部分
1.1 材料及试剂
MES菌种来自武汉市某污水处理厂厌氧池的活性污泥。
所用试剂均为分析纯。
0.1 mol/L磷酸缓冲溶液:KH2PO46.8 g/L,NaOH 0.944 g/L,pH 6.0。微生物液体培养液:K2HPO42.18 g/L,KH2PO41.70 g/L,NaHCO32.50g/L,NH4Cl 1.25 g/L,KCl 0.10 g/L,MgCl2·6H2O 1.00 g/L,NaCl 0.80 g/L,CaCl2·2H2O 0.30 g/L,L-半胱氨酸 0.50 g/L,微量元素溶液10 mL/L,维生素溶液10 mL/L,pH 6.0。
1.2 实验方法
1.2.1 MES的建立
MES采用3电极体系H型双室反应器,两室容积均为500 mL,阴阳两极室之间通过阳离子交换膜(厚度为0.16~0.23 mm,北京廷润膜技术开发股份有限公司)隔开。阳离子交换膜在使用前置于0.5 mol/L的NaCl溶液中至少浸泡24 h,然后用去离子水清洗干净,使得阳离子交换膜充分水化和膨胀。用直径0.5 mm的钛丝作导线,阴极以碳毡(8.00 cm×8.00 cm×0.10 cm)作为工作电极,阳极以钛板(8.00 cm×4.00 cm×0.05 cm)作为对电极,参比电极采用Ag/AgCl电极(218型,上海雷磁仪器有限公司,相对标准氢电极电势为+0.197 V)并置于阴极电解室中。阳极电解液为磷酸缓冲溶液,阴极电解液为微生物液体培养液,培养温度(37±1)℃。在本实验中,所有的电势数据均相对于Ag/AgCl参比电极,MES输出电压、电流监测均采用电化学工作站(CHI660E型,上海辰华仪器有限公司)。
1.2.2 实验过程
活性污泥先置于干燥处进行厌氧暴晒,以除去霉菌等不良微生物。取20 mL处理后活性污泥接入电化学反应器阴极室,同时加入480 mL液体培养基,在阳极室中加入500 mL磷酸缓冲液(pH=6.0),通过向阴极室中加入2-溴乙基磺酸钠抑制污泥中产甲烷菌的活性[9]。阴极电极的电势设为-0.70 V(相对于Ag/AgCl),在阴极室的底部通入CO2(纯度>99.999%)进行微孔曝气(曝气流量20 mL/min,曝气时间40 min,静止时间4 h),其中阳极进行没有微生物的氧化反应,阴极进行有电化学功能菌的还原反应。活性污泥的驯化周期为8 d,待每个周期结束后,检测阴极液中有机物的浓度并置换出75%的阴极液开始下一个周期,直到阴极检测到的有机物浓度与上一周期完全相同时,表明电化学功能菌驯化完成,微生物挂膜成功。然后利用电化学工作站分别设置5组实验组,阴极电势分别设为-0.40,-0.50,-0.60,-0.70,-0.80 V,另外一组不施加外电势(电势为0 V)作为对照组。接通电源,内置Ag/AgCl参比电极,反应装置连续运行24 h,对反应的产物进行检测分析。
1.3 分析方法
1.3.1 微生物形态的SEM表征
用无菌镊子从阴极碳毡上取5 mm×5 mm大小的薄片,用2.5%(w)戊二醛固定液固定2.5 h;用磷酸缓冲溶液清洗3次,每次10 min;再分别利用30%,50%,70%,85%,95%(φ)的乙醇各脱水一次,每次15 min,100%浓度的乙醇脱水2次,每次20 min;最后用乙酸异戊酯置换2次,每次15 min。试样干燥后用离子溅射仪(GVC2000型,上海禾早电子科技有限公司)喷金,采用扫描电子显微镜(XL 30 TMP型,荷兰Philips公司)观察阴极电极上微生物的形态。
1.3.2 细菌PCR高通量测序
反应结束后,分别收集不同电势下阴极碳毡上的混合菌体,混合细菌的DNA提取采用细菌DNA提取盒(武汉华大基因有限公司)进行。16S PCR扩增采用通用引物的序列:正向引物采用F1:5-AGAGTTTGATCCTGGCTCAG-3’,反向引物采用R1:5’-AAGGAGGTGATCCAGCCGCA-3’。通过Illumina Mise平台进行高通量测序。
1.3.3 合成有机物的高效液相色谱分析
采用高效液相色谱仪(U3000型,美国戴安公司),0.45 μm滤膜过滤,微量进样器进样,进样量20 μL,入C18反相检测柱,流动相为0.01 mol/L NaH2PO4溶液(pH为3.0),流量0.5 mL/min,柱温30 ℃,检测波长210 nm。
1.3.4 电化学分析
MES稳定运行一段时间后,阳极连接对电极,阴极连接工作电极,Ag/AgCl电极作为参比电极,利用电化学工作站对MES进行循环伏安(CV)扫描。CV扫描参数:扫描电势范围-1.0~0.8 V,扫描频率0.005 V/s。
反应结束后,通过阴极液中各产物的最终积累量计算MES的总库伦效率,计算方法参考文献[10]。库伦效率是指微生物在阴极上捕获电子转化为有机物的效率。
2 结果与讨论
2.1 MES还原CO2合成有机物分析
在MES中,微生物在电流的驱动下还原CO2合成甲酸和乙酸。合成产物甲酸(a)、乙酸(b)积累量随时间的变化见图1。
由图1a可见:在反应的前18 h,随着反应的进行,甲酸积累量的上升趋势十分明显,随后上升速率降低直至趋于稳定;当阴极电势从-0.40 V降至-0.50 V时,甲酸的积累量相差不大,可能的原因是较小的电势差对微生物代谢影响较小;在阴极电势为-0.70 V时,甲酸的积累量最大,反应24 h时达到1.554 mmol/L,其产生速率约为0.065 mmol/(L·h);当阴极电势进一步降至-0.80 V时,反应24 h时的甲酸的积累量降为1.467 mmol/L。
图1b可见:随着反应的进行,乙酸的积累量在整体上随着反应的进行呈现出不断上升的趋势;当阴极电势在-0.70 V时,反应24 h时的乙酸的积累量最大,为2.754 mmol/L。
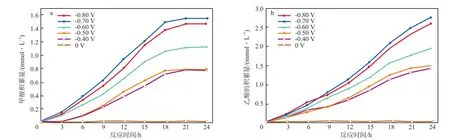
图1 合成产物甲酸(a)、乙酸(b)积累量随反应时间的变化
2.2 总库伦效率分析
库伦效率能够反映MES中微生物捕获电子以及吸收电子催化还原底物合成转化相应产物的能力[11]。阴极电势对MES库伦效率的影响见图2。由图2可见:整个系统的总库伦效率变化范围在41.07%~81.42%之间,其中有机物的库伦效率在39.23%~75.80%之间;阴极电势为-0.70 V时,系统的总库伦效率最大,为81.42%,此条件下乙酸的库伦效率为66.44%,比BAJRACHARYA等[12]报道的乙酸库伦效率(40%)要高;总库伦效率最小值为-0.40 V时的41.07%,与NEVIN等[13]的研究结果相比,本实验结果稍低;阴极电势为-0.80 V时,总库伦效率为77.09%;阴极电势为-0.50~-0.60 V时,总库伦效率为42.91%~56.60%。
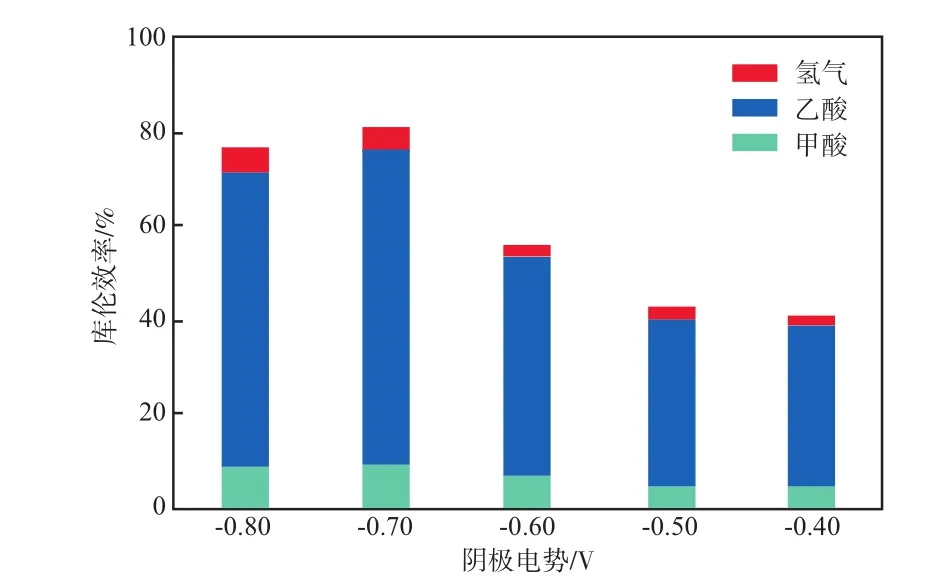
图2 阴极电势对MES库伦效率的影响
2.3 电化学分析
不同阴极电势下反应后MES的CV曲线见图3。
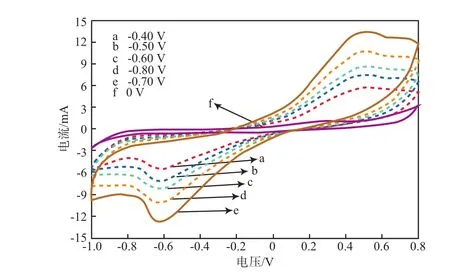
图3 不同阴极电势下反应后MES的CV曲线
由图3可见:各阴极电势条件下CV曲线中的电流值均比对照组的要大,表明电化学功能微生物在阴极发生了还原反应;在阴极电势为-0.70 V时,电流值最大,电流密度最大,且在-0.62 V附近出现了还原峰,该还原峰出现的位置与之前HAWKINS等[14]报道的结果相似;随着阴极电势的改变,MES阴极还原CO2的还原峰出现的位置差别不大,表明阴极电势的差异对MES还原CO2的还原电位几乎没有影响;但是不同阴极电势下CV曲线对应的曲线面积相差较大,通过CV计算反应完成后电极的电容效应发现,阴极电势-0.80,-0.70,-0.60,-0.50,-0.40 V下的电容分别为0.542,0.673,0.439,0.374,0.288 F,与对照组(0.065 F)相比,外加电势组的电容提高了约3.4~9.4倍,这说明施加外加电势后,阴极电容有了极大的提高。对比不同阴极电势条件下的阴极电容发现,在-0.70 V的条件下电势电容最大。电极电容越大,表明生物阴极比表面积越大,阴极生物的活性表面积得到了提升,从而提高了MES的合成转化效率。
2.4 SEM结果分析
MES阴极表面的SEM照片见图4。由图4可见:MES阴极碳毡纤维表面不同程度附着微生物,微生物紧密吸附在碳毡纤维的表面,说明电极材料具有良好的生物亲和性。

图4 MES阴极表面的SEM照片
2.5 微生物菌群高通量测序分析
阴极生物膜细菌在属水平上的分布情况见图5。由图5可见:醋杆菌(Acetobacteriumsp.)、假丝酵母菌(Candidasp. S)、地杆菌(Geobactersp.)等在各电势条件下丰度均相对较高,为优势菌群;未驯化污泥中甲烷菌(Methanothrixsp.)的丰度为13%,其次是变形杆菌(Proteussp.)11%、醋杆菌10%、大肠杆菌(Escherichiasp.)10%、假丝酵母菌8%;而在不同电势强度的实验组中均未检测到甲烷菌,这是因为在驯化之前加入了甲烷抑制剂,抑制了与其他菌种竞争电子的产甲烷菌的生长,这样能使反应向着更益于合成有机酸的方向进行[15]。醋杆菌是一种产乙酸菌,它可以利用H2和CO2生成乙酸[16]。对比外加电势和无电势的MES发现,在外加电势条件下假丝酵母菌生长更为旺盛,其丰度在不同电势条件下均有明显提升,可能的原因是假丝酵母菌可以捕捉电子,一方面用于自身细胞生长代谢,另一方面消耗底物合成相应产物。
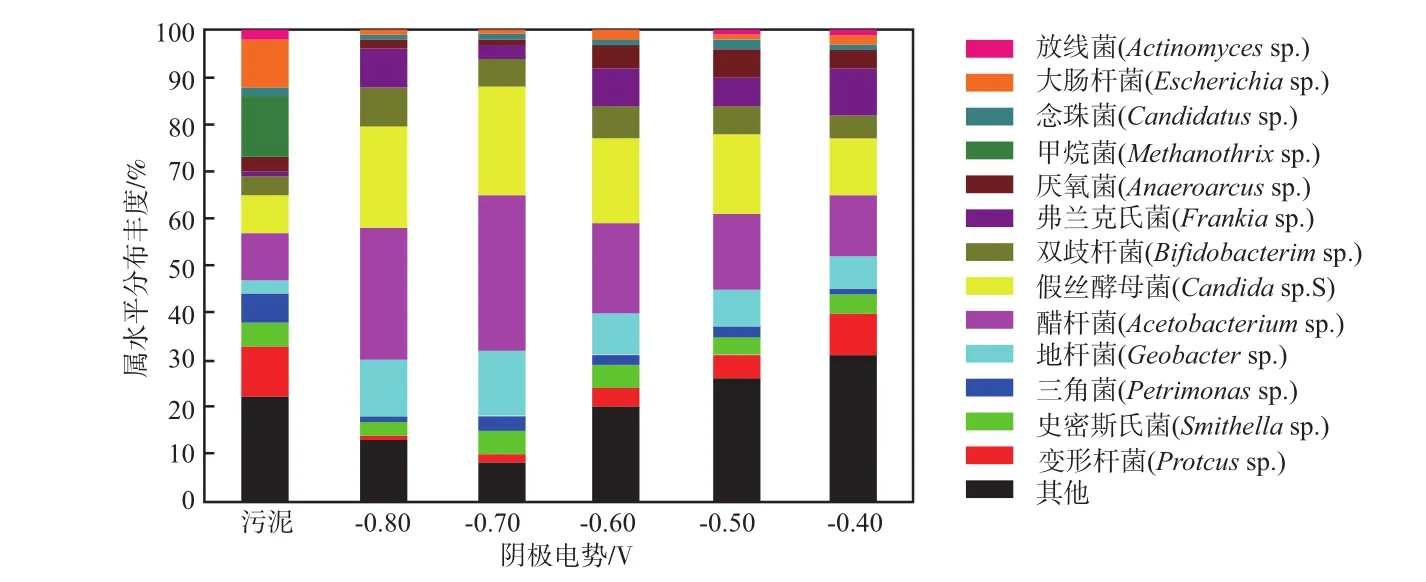
图5 阴极生物膜细菌在属水平上的分布情况
由图5还可见:阴极电势为-0.40 V的条件下,醋杆菌(Acetobacteriumsp.)的丰度为13%,假丝酵母菌(Candidasp. S)的丰度为12%,地杆菌(Geobactersp.)的丰度相对较低,只有7%;随着阴极电势的降低,这3种优势菌在属水平上的丰度均有明显提高,在电势条件为-0.70 V时,3种优势菌丰度之和相对整个菌群占比最大,醋杆菌(Acetobacteriumsp.)为33%、假丝酵母菌(Candidasp. S)为23%、地杆菌(Geobactersp.)为14%,在此条件下MES中有机酸的积累量最多,可能的原因是这些细菌可以通过特殊途径建立互利共生的关系,营造出一种共养的环境,微生物之间的协同作用使得混合菌群能在电势的作用下合成有机酸,这与之前的报道一致[17];而在-0.80 V条件下,醋杆菌(Acetobacteriumsp.)的丰度为28%、假丝酵母菌(Candidasp. S)为22%、地杆菌(Geobactersp.)为12%,相比-0.70 V条件下略有降低,这表明优势菌的最适电势为-0.70 V,一旦超过最适宜的电势条件反而不利于微生物的生长。控制好细菌生长的最适电势,是提高MES还原CO2合成有机物的关键。
3 结论
a)采用3电极体系H型双室反应器建立MES,还原CO2合成有机物。阴极电势从-0.40 V降至-0.70 V时,甲酸积累量从0.774 mmol/L增加到1.554 mmol/L;当降至-0.80 V时,甲酸积累量降为1.467 mmol/L。电势为-0.70 V时,乙酸积累量最大,为2.754 mmol/L。
b)整个系统阴极的总库伦效率变化范围为41.07%~81.42%,其中有机酸的库伦效率为39.23%~75.80%。阴极电势为-0.70 V时总库伦效率最大,为81.42%;-0.40 V时最小,为41.07%。
c)在阴极电势为-0.7 0 V时,醋杆菌(Acetobacteriumsp.)、假丝酵母菌(Candidasp. S)、地杆菌(Geobactersp.)3种菌在阴极生物膜上占比最大,为优势菌种,丰度分别为33%,23%,14%。
