钙周期蛋白S100A6在子宫腺肌病患者相关组织中的表达
2020-04-23李妍仪申英张秀艳
李妍仪 申英 张秀艳
子宫腺肌病(adenomyosis,AM)为育龄期女性常见却难治的一种良性疾病,其定义为子宫内膜的腺体及间质侵入子宫肌层形成的病变,现已作为异常子宫出血FIGO分期(PALM-COEIN)中的一种独立因素[1]。子宫腺肌病虽然是一种良性疾病,却表现出一些类似恶性肿瘤的生物学行为,如异位病灶异常增殖、浸润、甚至向邻近组织侵袭等[2]。关于有活性的异位子宫内膜来源的学说有多种,如种植学说、体腔上皮化生学说、诱导学说、在位内膜决定论等。子宫腺肌病患者的主要临床表现是月经改变(常见经量增多、经期延长)和痛经进行性加重。进行性加重的痛经对子宫腺肌病患者的生活质量和心理健康造成了极其严重的影响。该病具有形态多、范围广、极具复发性的特点,致使其难以被早期诊断,越来越多的患者因不堪疾病反复发作的痛苦而选择全子宫切除术这种彻底性的治疗手段,对患者生育功能及生活质量造成了极大损害。然而目前子宫腺肌病的病因及发病机制以及痛经的发生机制却尚未完全明确。钙周期蛋白S100A6很可能通过诱导细胞分化、影响信号转导通路等方式,改变细胞的增殖、迁移和凋亡能力,来参与肿瘤的发生发展过程。据此推测S100A6也可能通过诱导子宫内膜细胞发生浸润和转移[3],参与子宫腺肌病和(或)子宫内膜异位症的发生。本实验通过研究S100A6在子宫腺肌病患者子宫相关组织中的表达水平,探索其在疾病发生发展过程中的作用及与患者痛经的关系,以期证明可以通过子宫内膜活检等方法术前获取患者子宫内膜,检测子宫内膜组织中S100A6的表达,为术前诊断子宫腺肌病提供理论依据。
1 资料与方法
1.1 一般资料 选取2016年1月至2017年8月在河北省承德市中心医院妇科就诊,行全子宫切除术,临床病例资料完整的子宫腺肌病患者30例作为病例组;选取同期因子宫肌瘤行全子宫切除术的患者30例作为对照组。术前通过模拟视觉评分法(visual analogue score,VAS)对病例组子宫腺肌病患者进行痛经程度评分,轻度痛经10例中度痛经12例,重度痛经8例。2组患者年龄、BMI、孕次、产次、经期、月经周期相比较,差异均无统计学意义(P>0.05)。见表1。
表1 2组临床特点比较
1.2 入选标准 所有病例的诊断经病理组织学证实,2组患者均未绝经、未放置宫内节育器及术前6个月内均未使用过激素类药物。子宫腺肌病患者,且不同时患有子宫内膜异位症。本研究经过医院伦理委员会批准,患者知情同意。
1.3 免疫组化法检测S100A6 分别选取病例组包埋在位子宫内膜组织、子宫肌层异位内膜组织蜡块和对照组包埋正常子宫内膜组织蜡块。全部石蜡标本入选后进行4 μm厚连续切片,置于玻片,60℃烤片过夜,常规脱蜡水化,蒸馏水水洗2次,柠檬酸高温高压修复2 min,PBS洗5 min×3次。3%双氧水处理10 min,PBS洗5 min×3次,每张切片依次滴加S100一抗4℃冰箱过夜,PBS洗5 min×3次,二抗孵育20 min,PBS洗5 min×3次,DAB进行显色10 min,苏木紫复染,最后常规脱水透明,进行封片。在高倍镜下对图像进行观察分析。实验相应的试剂:免疫组织化学染色Rabbit Anti-S100A6 antibody,购自北京博奥森生物技术有限公司。
1.4 结果判读 结果判定在双盲下进行,由至少2名经验丰富的病理科医师分别阅片和统计结果。阳性标准:细胞浆和(或)胞膜、胞核出现棕黄色颗粒标记为阳性。阳性判断:在100倍光学显微镜下观察,然后在400倍光学显微镜下随机计数5个视野。评分标准:(1)染色细胞率计分:0~5%评0分;6%~40%评1分;41%~70%评2分;>70%评3分。(2)染色强度计分:无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。每张切片免疫组化染色评分(IRS)=染色细胞率分数+染色强度分数。IRS分数<1分为阴性(-),分数≥1分为阳性。阳性强度根据所得分值分为3个等级:1~2分记为弱阳性(+);3~4分记为中度阳性(++);5~6分记为强阳性(+++)。

2 结果
2.1 3组A100A6免疫组化染色 病例组在位内膜、异位内膜的子宫内膜上皮细胞和间质中均可检测到S100A6的表达,其主要表达于子宫内膜的上皮细胞和间质细胞的胞质和胞膜(呈淡黄色、棕黄色或棕褐色)。图1可见子宫内膜腺体组织异位至子宫肌层组织中,称之为异位内膜。S100A6在对照组正常子宫内膜组织中无表达。见图1~3。
2.2 3组S100A6表达及其阳性率比较 病例组在位内膜、异位内膜S100A6的表达阳性率分别为80%和70%,对照组正常子宫内膜的S100A6表达阳性率为33.33%。见表2。
2.3 3组S100A6表达水平比较
2.3.1 病例组在位子宫内膜与对照组正常子宫内膜S100A6表达:病例组在位子宫内膜S100A6表达水平高于对照组(Z=-3.745,P=0.00018)。见表3。
2.3.2 病例组异位子宫内膜与对照组正常子宫内膜S100A6表达:病例组异位内膜的S100A6表达水平高于对照组(Z=-3.215,P=0.001)。见表3。
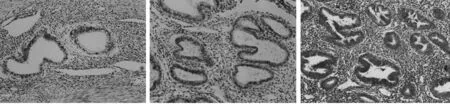

图1 病例组异位内膜组织中S100A6的表达(免疫组化×400)图2 病例组在位子宫内膜组织中S100A6的表达(免疫组化×400)图3 对照组正常子宫内膜组织中S100A6的表达(免疫组化×400)

表2 S100A6在子宫腺肌病组和对照组中的表达 n=30,例

表3 3组S100A6 的表达水平 n=30,例
2.3.3 病例组在位子宫内膜与病例组异位子宫内膜S100A6表达:病例组在位内膜S100A6的表达水平与病例组异位内膜相似(Z=-1.134,P=0.257)。
2.4 S100A6在子宫腺肌病患者在位内膜组织中的表达强度与痛经程度比较 不同痛经程度的患者在位子宫内膜组织中S100A6表达水平,差异有统计学意义(P<0.05)。见表4。
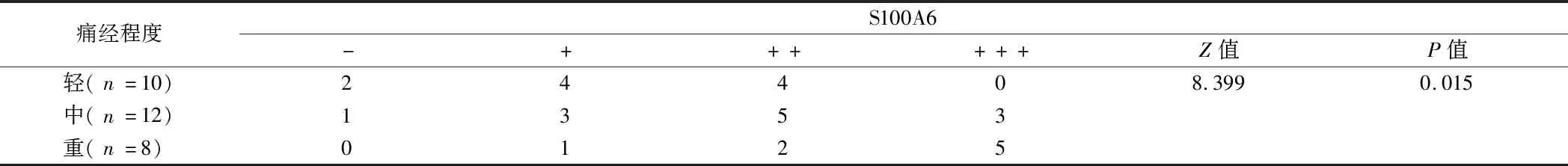
表4 S100A6在子宫腺肌病患者在位内膜组织中的表达强度与痛经程度比较 例
3 讨论
据不完全统计,子宫腺肌病患者的痛经率高达64.8%~77.8%[4],近年来其发病率显著提高,但迄今为止,其发病机制仍不清楚。目前子宫腺肌病的主要治疗方法包括(1)药物治疗如:应用促性腺激素释放激素激动剂(GnRH-a)、无相对禁忌证的女性应用左炔诺孕酮宫内缓释系统(LNG-IUS)以及口服抗雌激素药物等;(2)介入治疗如:子宫动脉栓塞、高强度聚焦超声(HIFU)等[5];(3)手术治疗:开腹或腹腔镜子宫切除术、子宫肌层异位病灶切除术等。因药物治疗时,患者不良反应多,停药后症状易复发,大多数患者因无法忍受进行性加重的痛经而最终选择全子宫切除术这种极端的治疗手段。如今子宫腺肌病患者群体趋于年轻化,选择子宫切除术无法保留其生育功能,保守治疗复发率高,临床医生在选择治疗方案时进退两难,越来越多的临床医生及患者亟待新的治疗方法出现。现子宫腺肌病痛经的发病机制尚不完全明确,仍在不断探讨的过程中,可能是由EMJZ区的功能失调、神经源性因素、异常的激素水平、炎性反应等多种因素共同介导。许多神经递质(细胞因子、肽类激素等)及相应受体的表达可链接神经系统、内分泌系统和免疫系统,参与这几大系统之间的信息交流,使其互相影响,共同发挥作用,最终导致AM患者产生痛经等临床症状。其中最被广泛接受及认可的发病机制是子宫内膜-肌层交界区功能失调。子宫内膜-肌层交界区(endometrial-myometrial iunctional zone,EMJZ)是子宫内膜基底层和子宫肌层(IM)之间的区域。由组织损伤等因素导致EMJZ结构发生改变,增加了该部位的张力,进而促进了雌激素分泌,分泌过多的雌激素可上调子宫肌层细胞上催产素受体的表达,其作用是诱导产生更多的过度运动,进而导致更多EMJZ区组织的损伤,使基底层子宫内膜腺体和基质组织进一步向子宫肌层的深处移位,形成子宫腺肌病的病灶,引发痛经[6]。神经生长也是引起疼痛的直接原因,考虑为有髓神经纤维与无髓神经C纤维发挥重要作用[7],而S100则是高度特异性表达于此类神经纤维的标记物[8],同时也是子宫内膜异位症及子宫腺肌病常用的神经标记物[9,10]。
本课题针对S100A6在AM患者相关组织中的表达情况进行研究。S100A6蛋白即钙周期蛋白,是S100蛋白家族的成员之一,S100A6蛋白相对分子质量为10 235,像其他S100蛋白家族成员一样,其活性形式为同源二聚体。S100A6蛋白与钙离子结合后,其EF手型经典区得到暴露,进而可以与多种靶蛋白结合(原肌球蛋白、膜联蛋白Ⅱ、Ⅵ、Ⅺ、钙调结合蛋白等)[11]。S100A6蛋白最初由Kuznicki和Filipek在Ehrlich腹水瘤中检出,主要存在于细胞的胞质、胞膜及核被膜上(包括核膜内表面)[12]。近年研究已经发现2条有关S100A6在细胞增殖、凋亡、肿瘤发生、浸润和转移等过程中发挥作用的信号通路:一是S100A6可能通过RAGE(晚期糖基化终末产物受体)信号通路发生作用[13],RAGE作为一种细胞膜表面受体,通过第2个C型S100A6主要与RAGE的第 2个 C型免疫球蛋白结构域与S100A6蛋白结合并发挥细胞外信号传导作用。其机制可能是通过激活ROS依赖性的c-Jun氨基末端激酶(c-Jun NH2-terminalkinase,JNK)及凋亡蛋白酶3和7来引起神经细胞凋亡,从而激活下游的NF-kB转录因子调节的一些促进生存和(或)抗凋亡通路;二是发现S100A6通过结合CacyBP/SIP蛋白,阻断β-catenin磷酸化,使β-catenin增多。而后者是Wnt信号通路的关键分子,Wnt与跨膜Frlzzled家族受体的N末端细胞富含半胱氨酸的结构域和辅受体脂蛋白受体相关蛋白(LRP)5/6结合时,使得Dishevelled蛋白活化,将信号传递到细胞内,抑制破坏复合物Axin,腺瘤病大肠杆菌(APC),蛋白磷酸酶2A(PP2A),糖原合成酶激酶3(GSK3)和酪蛋白激酶1α(CK1α)的活性,使得β-catenin磷酸化被阻断,大量去磷酸化β-catenin转移入核,并且这种信号与核因子转录因子/淋巴样增强因子(TCF/LEF)相互结合,能进一步激活靶基因,从而能诱导疾病的发生发展[14]。结合近年来有关AM发病机制的基础研究分析,认为S100A6很可能参与子宫腺肌病的发生。利用反义核酸技术阻断S100A6的表达,是否可以抑制子宫腺肌病的转移和复发[15],有待进一步研究。
刘泽群等[16]研究发现:S100A6在子宫腺肌病患者子宫内膜间质细胞中存在高表达,并推断其可能参与子宫腺肌病的发生,且在子宫腺肌病患者疼痛的发生发展过程中起重要作用,其通过影响细胞的增殖、迁移和凋亡能力,造成子宫腺肌病异位内膜的转移和浸润性生长。车璇等[8]通过检测子宫腺肌病患者子宫内膜-肌层交界区S100蛋白及蛋白基因产物9.5(PGP9.5)的表达,并探究其与子宫腺肌病发病机制及患者痛经的关系,结论是:子宫腺肌病患者子宫内膜-肌层交界区S100蛋白与PGP9.5的表达异常增高,这可能参与子宫腺肌病的发病机制,并可能在子宫腺肌病患者疼痛的发生中起重要作用。Tokushige等[7]发现,在严重痛经和性交困难的子宫内膜异位症患者直肠阴道子宫内膜异位病灶中出现了由非特性抗体 S100 蛋白染色的神经纤维[7]。但对于同时检测子宫腺肌病患者在位子宫内膜和异位内膜中S100A6的表达情况的相关研究比较少见。本研究通过检测S100A6在病例组子宫腺肌病患者在位子宫内膜、异位内膜和对照组子宫内膜中的表达水平发现:病例组在位子宫内膜和异位到肌层的子宫内膜组织中S100A6的表达水平均高于对照组,且差异有统计学意义(P<0.05)。子宫腺肌病患者相关组织中表达异常增高的S100A6与患者痛经程度存在正相关,可由此推断,S100A6可作为子宫腺肌病的一种诊断参考指标。同时,本研究通过检测同一位子宫腺肌病患者在位内膜和异位到肌层的子宫内膜组织中S100A6的表达情况,得出结论:病例组在位内膜S100A6的表达水平与病例组异位内膜相似,差异无统计学意义(P>0.05),故推测可以通过术前子宫内膜活检等方法获取患者子宫内膜组织,通过病理免疫组化法检测子宫内膜组织中S100A6的表达,作为诊断子宫腺肌病的重要参考指标,亦可根据其表达程度评估患者病情严重程度。
李蕴薇等[17]研究结果显示221例子宫腺肌病患者中72.4%血清CA125水平升高,痛经症状及其严重程度与血清CA125水平升高有关。给予GnRH-a后血清CA125水平能明显下降。CA125是目前研究比较透彻,亦最常用于子宫内膜异位症诊断的一种糖蛋白、其检测敏感性与疾病严重程度呈正相关。但单独检测CA125表达水平,其诊断特异性较低,因此目前国内外大量研究推荐联合其他指标进行检测。张清等[18]的研究结果提示CA125联合CA199可将诊断敏感度提高到60%。Agic等[19]发现CA125联合检测CCR1mRNA(趋化因子受体-1信使RNA)和MCP1(单核细胞趋化蛋白-1)的表达水平,可以使诊断敏感性达到92.2%,特异性达到81.6%。Acimovic等[20]近年研究发现CA125联合检测生存素(survivin)和VEGF(血管内皮生长因子),其敏感性可达到到93.3%,特异性可达到90%。但因本研究时间及经费有限,样本量较小,只通过病理免疫组化检测了S100A6这一种子宫腺肌病患者组织中的观测指标。在之后的研究中可进一步扩大样本量,增加血清学观测指标(如CA125),探究其与子宫内膜组织中S100A6联合检测子宫腺肌病,是否能提高诊断敏感性及特异性。
目前,子宫腺肌病难以用微创甚至无创的方法,诊断和评估病情严重程度[21],影像学诊断为现今诊断子宫腺肌病的主要方法,特异性诊断子宫腺肌病的分子标志物尚未出现。本研究显示,病例组在位内膜与子宫肌层异位内膜S100A6的表达水平相似,差异无统计学意义(P>0.05),且两者的S100A6的表达水平均高于对照组。因此推断,可以通过子宫内膜活检的方法,取得子宫腺肌病患者子宫内膜进行免疫组化染色,检测S100A6的表达水平,将其作为诊断子宫腺肌病的一项重要参考指标。还可在子宫腺肌病患者保守治疗前后取患者子宫内膜,进行免疫组化染色,检测S100A6的表达水平,作为评价保守治疗疗效,甚至预测复发的一项指标。以后可进一步扩大样本量,对上述内容进一步研究。
