治中颗粒对脑缺血再灌注模型大鼠颞叶神经元凋亡的影响
2020-04-23王龙张勇黄燕席丽娜张明吕建瑞
王龙 张勇 黄燕 席丽娜 张明 吕建瑞
动脉硬化性脑梗死是指大脑中动脉系统的动脉粥样硬化和血栓形成使动脉管腔狭窄,导致该动脉供血区局部脑组织的坏死,临床上表现为偏瘫、讲话不清等突然发生的神经功能缺损症状[1]。该病为最常见的脑血管病,中医药治疗脑栓塞有丰富的临床经验,治中颗粒出自《备急千金要方》卷二十治中汤,主要成分为人参、干姜、甘草、(炙)、白术各9 g,用水1.6 L,煮取600 ml,去滓,每次温服200 ml,3次/d。治五脏中寒,口噤失音,四肢强直。本文对该剂进行了与功能主治有关的药效学试验。
1 材料与方法
1.1 试验动物 SPF级雌性SD大鼠70只,体重180~220 g;由西安交通大学实验动物中心提供,许可证号:SCXK(陕)2015-002。大鼠昼夜循环光照,饲养在温度19~28℃,相对湿度40%的洁净环境中,喂食双蒸水和购于动物中心的大鼠饲料,大鼠自由饮水和进食。
1.2 受试药物 治中颗粒,用法用量:口服,5 g/次,3次/d;规格:5 g/袋,每袋相当于12 g生药;由西安交通大学附属第二医院提供,批号:20171103。银杏叶片,用法用量:口服:2片/次,3次/d;规格:0.2 g;石家庄以岭药业股份有限公司,批号:170116。
1.3 试剂 枸橼酸钠,批号:20160718,国药集团化学试剂有限公司。枸橼酸,批号:20160313,国药集团化学试剂有限公司。PBS磷酸缓冲液,批号:20180221,北京Solarbio科技有限公司。大鼠含半胱氨酸的天冬氨酸蛋白水解酶-3(Caspase-3)一抗,13A111,博士德生物工程有限公司。大鼠凋亡诱导因子(AIF)一抗,13F57,博士德生物工程有限公司。多聚甲醛,批号:F20160417,国药集团化学试剂有限公司。TMS-P超敏试剂盒,批号:1703261406,福建迈新生物技术开发有限公司。DAB显色试剂盒,批号:1705110031福建迈新生物技术开发有限公司。
1.4 仪器 YG-280KX型阳光神琦摊片机。YG-280KX型阳光神琦烤片机。TP1020型徕卡自动脱水机。Leica切片机。BX53型奥林巴斯光电显微镜。
1.5 研究方法
1.5.1 动物分组、造模、给药方法:70只SPF级SD大鼠随机选取10只为假手术组,其余60只大鼠随机分为模型组、治中颗粒低剂量组(3.24 g生药/kg)、治中颗粒中剂量组(6.48 g生药/kg)、治中颗粒高剂量组(12.96生药/kg)、银杏叶片组(0.108 g/kg),每组12只。给药体积为10 ml·kg-1·d-1,假手术组和模型组灌胃等体积蒸馏水。大鼠腹腔注射6 ml/kg的水合氯醛溶液(5%)麻醉,大鼠仰卧位固定,颈部褪毛、消毒,分离、双侧颈总动脉,在其下置线备用。待所有大鼠自然苏醒3 h后,用无创性微动脉夹夹闭双侧颈总动脉20 min后,松夹进行再灌注,止血后,涂青霉素粉,缝合皮肤。大鼠缺血30~60 s 内昏迷,翻正反射消失、双侧瞳孔放大为造模成功,剔除6组因实验操作死亡的动物。假手术组只分离双侧颈动脉,不夹闭双侧颈总动脉[2]。造模后继续灌胃给药14 d。
1.5.2 大鼠脑组织灌流方法:末次给药1 h后,6组大鼠腹腔注射6 ml/kg 的水合氯醛溶液(5%)麻醉,大鼠仰卧位固定,开胸暴露心脏,将灌注针刺入左心室,右心耳剪孔,使用200 ml 0.9%氯化钠溶液冲洗,然后用4%多聚甲醛固定液灌流,直至身体逐渐僵硬震颤为止。开颅取脑,脑组织行冠状位切片,置于4%多聚甲酸溶液(pH值7.4,0.01 mol/L PBS配制)中固定24 h。固定后的脑组织用乙醇梯度脱水,二甲苯透明,石蜡包埋,切片进行HE染色以及Caspase-3和AIF在颞叶神经元表达的检测[3]。
1.5.3 大鼠脑颞叶神经HE染色方法:切片用二甲苯(Ⅰ)透明15 min,二甲苯(Ⅱ)透明15 min, 100%乙醇(Ⅰ)浸泡5 min,100%乙醇(Ⅱ)浸泡5 min,80%乙醇浸泡5 min,蒸馏水浸泡5 min,苏木精液染色 5 min,流水稍洗去苏木精液3 s,1%盐酸乙醇3 s,水洗30 s,0.5%伊红液染色3 min,蒸馏水洗2 s,80%乙醇洗2 s,95%乙醇(Ⅰ)3 s,95%乙醇(Ⅱ)5 s,无水乙醇浸泡10 min,二甲苯(Ⅰ)浸泡2 min,二甲苯(Ⅱ)浸泡2 min,二甲苯(Ⅲ)浸泡2 min,中性树胶封固。将切片置于200 倍显微镜下观察6组大鼠颞叶皮层神经元染色结果[4]。
1.5.4 免疫组化方法检测大鼠脑颞叶神经元Caspase-3和AIF的表达:石蜡切片,在烘箱中60℃烘烤3 h,然后切片用二甲苯(Ⅰ)透明15 min,二甲苯(Ⅱ) 透明15 min,100%乙醇(Ⅰ)浸泡5 min,100%乙醇(Ⅱ)浸泡5 min,80%乙醇浸泡5 min,蒸馏水浸泡5 min。用3%的H2O2去离子水孵育10 min。蒸馏水冲洗,使用PBS缓冲液浸泡3次,每次5 min。在柠檬酸钠缓冲溶液中(pH值7.0)高压修复5 min。室温血清封闭15 min,倾去血清。滴加PBS稀释的一抗(Caspase-3 1∶100,AIF 1∶200),于37℃孵育2 h。使用PBS缓冲液浸泡3次,每次5 min。滴加生物素标记的二抗,37℃孵育1 h,PBS浸泡3次,每次5 min。滴加链霉亲和素-过氧化物酶,于37℃孵育30 min。PBS浸泡3次,每次5 min。滴加(DAB)显色剂显色[5]。自来水冲洗。苏木精液染色 5 min,流水稍洗去苏木精液3 s,1%盐酸乙醇3 s,水洗30 s,中性树胶封片,免疫组化染色图片采用ImageJ软件进行灰度值分析,计算各组积分光密度值(integral optical density IOD)。IOD = log[gv0/gv],gv0 为背景灰度值,gv为目标区灰度值[6]。

2 结果
2.1 6组大鼠脑颞叶皮层神经元HE染色结果 假手术组大鼠脑颞叶皮层神经元,结构清晰、完整,胞浆透明,胞核呈圆形或椭圆形,染色质分布均匀,核仁清晰,形态正常;模型对照组,大鼠脑颞叶皮层出现明显的神经元损伤,细胞变性和死亡,细胞形态改变。脑颞叶皮层部分神经元结构不完整,细胞肿胀、破裂,轮廓模糊、界限不清,变性损伤的神经元失去了正常结构,其胞体呈三角形,细胞质浓缩、深染,细胞核固缩,核仁不明显。给药组与模型组相比均有所改善,其中治中颗粒中剂量组、治中颗粒高剂量组及银杏叶片组神经元损伤程度具有较为明显的改善。见图1。
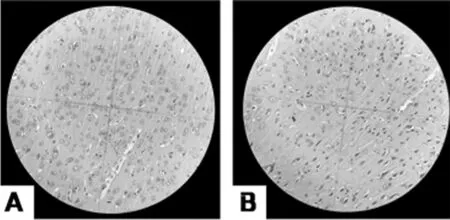
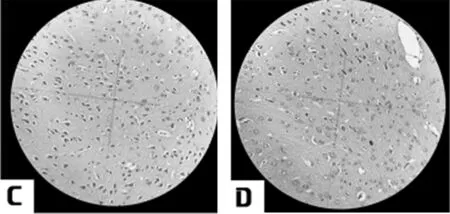

图1 大鼠脑颞叶神经元(HE×200);A 假手术组;B 模型组;C 治中颗粒低剂量组;D 治中颗粒中剂量组;E 治中颗粒高剂量组F 银杏叶片组
2.2 6组大鼠脑颞叶神经元Caspase-3表达免疫组化图片IOD值比较 与假手术组比较模型组Caspase-3表达显著增加(P<0.01)。与模型组比较治中颗粒中剂量组、治中颗粒高剂量组及银杏叶片组Caspase-3表达显著降低(P<0.05)。见表1,图2。

表1 6组大鼠脑前颞叶Caspase-3的表达结果比较
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05
2.3 6组大鼠脑颞叶神经元AIF表达免疫组化图片IOD值比较 与假手术组比较模型组AIF表达显著增加(P<0.01)。与模型组比较治中颗粒中剂量组、治中颗粒高剂量组及银杏叶片组AIF表达显著降低(P<0.05)。见表2,图3。

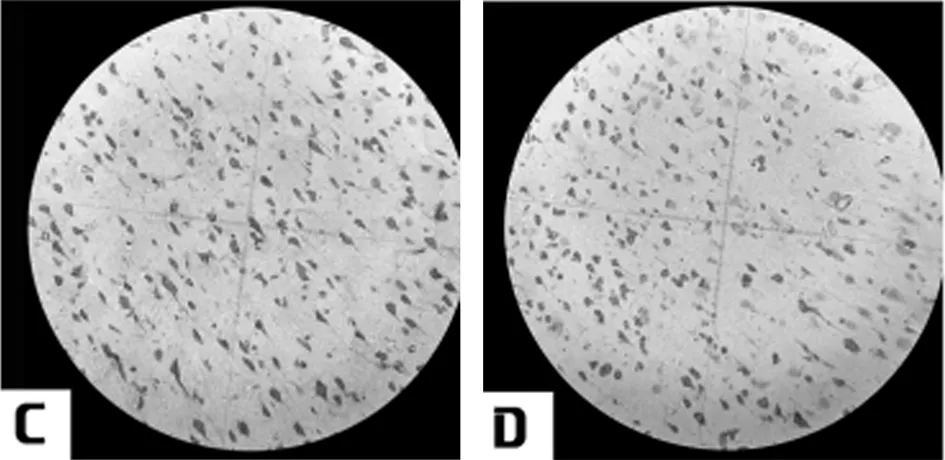
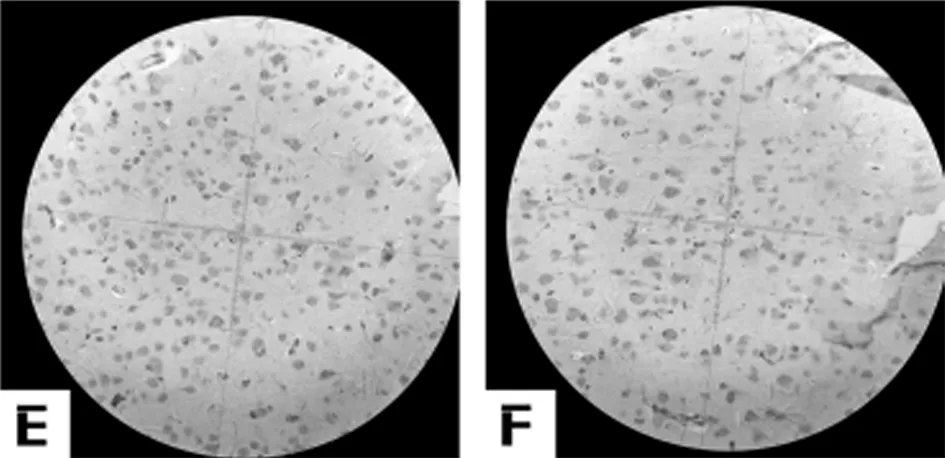
图2 大鼠脑颞叶神经元caspase-3表达结果(HE×200);A 假手术组;B 模型组;C 治中颗粒低剂量组;D 治中颗粒中剂量组;E 治中颗粒高剂量组F:银杏叶片组

表2 6组大鼠脑前颞叶AIF的表达结果比较
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05
3 讨论
脑动脉狭窄大脑由两侧颈内动脉和椎动脉供血,当其中一条动脉发生闭塞时,若侧支循环良好,可不发生临床缺血症状,如侧支循环不良,或多条动脉发生狭窄时,则会使局部或全脑的脑血流(减少,产生脑缺血症状[7]。轻度动脉狭窄不影响血流量,当动脉缩窄至原有管腔横断面积的80%以上才足以使血流量减少。多条脑动脉狭窄对脑血流的影响更大,因为可能使全脑血流处于缺血的边缘状态,此时如果有全身性血压波动,就可能诱发脑缺血。造成脑动脉狭窄的主要原因为动脉粥样硬化,且绝大多数累及颅内的中等动脉,其中以颈动脉起始部受累的机会最多[8]。动脉粥样硬化斑块除了可以造成动脉管腔狭窄外,在斑块上的附着物被血流冲刷脱落后形成栓子,随血流进入颅内动脉,堵塞远侧动脉引起脑栓塞,造成供血区缺血。栓子常来源于颈内动脉起始部的动脉粥样硬化斑块。栓子可能很快分裂成碎片后溶解,或向远侧动脉移动。颈内动脉内的栓子大多随血液的主流进入脑中动脉,引起相应的临床症状。短暂的低血压也可引起脑缺血,如果脑血管狭窄严重,使脑血流处于少血状态时,轻度的血压降低就可以引起脑缺血,如心肌梗死、休克、直立性低血压等[9]。本研究中的治中颗粒,由人参、干姜、甘草、(炙)、白术组成,所含药物具有扩张动脉及升高血压的作用,因此可以用于治疗脑缺血性疾病。



图3 大鼠脑颞叶神经元AIF表达结果(HE×200);A假手术组;B 模型组;C 治中颗粒低剂量组;D 治中颗粒中剂量组;E 治中颗粒高剂量组;F 银杏叶片组
由于神经元本身储存的能量物质ATP或ATP代谢底物很有限,大脑需要持续的脑血流来供应葡萄糖和氧。当脑血流下降时,脑组织通过自动调节机制来调节血流,最大限度地减少脑缺血对神经元的影响[10]。但当脑血流下降到一定阈值,脑自动调节机制失代偿,则可引起脑功能性或器质性改变。脑血流<10~12 ml·100 g-1·min-1时,ATP耗竭,膜磷脂降解,K+从神经元内释放到细胞外,Ca2+则大量进入神经元内,引起神经元钙超载,星形胶质细胞内Na+、Cl-和水分异常增加,细胞破坏死亡[11]。本研究结果表明大鼠双侧颈动脉结扎20 min后,大鼠脑颞叶皮层神经元出现明显的损伤,细胞形态改变,细胞变性和死亡,治中颗粒中剂量组、治中颗粒高剂量组及银杏叶片组与模型组相比神经元损伤有明显改善。
脑缺血后缺血核心区脑血流停止,细胞膜稳定性被破坏,细胞内容物释放,细胞死亡或凋亡,细胞凋亡是脑缺血后的细胞损害的主要形式,特别是缺血半暗区的神经元或暂时性脑缺血伴再灌注等缺血程度相对较轻的区域[12]。形态学上细胞凋亡表现为染色质的浓缩和折叠或形成碎片,细胞皱缩,并在胞质内出现凋亡小体[13]。Caspase为含半胱氨酸的天冬氨酸蛋白水解酶。Caspase为存在于细胞质中具有相似结构的蛋白酶。Caspase是一类蛋白酶家族,Caspase-1亚族包含 Caspase-1、4、5、11;Caspase-2亚族包含Caspase-2、9;Caspase-3亚族包含Caspase-3、6、7、8、10。正常的细胞中,每一种Caspase都以非活化状态存在的,这种非活化的Caspase称作酶原,它是酶的非活性前体,其肽链比有活性的长一些,将多出的部分切除,就转变成有活性的Caspase[14]。Caspase有两类,分为起始者和执行者,外来蛋白信号切割激活起始Caspase,起始Caspase切割执行者Caspase并使之激活,被激活的执行者Caspase通过对靶蛋白的水解,导致细胞程序性死亡。凋亡诱导因子(AIF)是一类存在于线粒体内外膜间隙的保守的黄素蛋白。AIF具有双重功能,在细胞正常的生理状态下,AIF可作为线粒体氧化还原酶,能催化细胞色素c和烟酰胺腺嘌呤二核苷酸(NAD)之间的电子传递;当细胞受到凋亡的刺激时, AIF从线粒体中转移到细胞质内,然后进入细胞核,引起细胞核内DNA凝集并断裂成50 kb大小的片段,这是其与典型细胞凋亡的区别[15]。本研究中与模型组比较治中颗粒中剂量组、治中颗粒高剂量组及银杏叶片组Caspase-3、AIF表达显著降低,说明治中颗粒可以通过调节Caspase-3和AIF在神经元中的表达,而抑制脑缺血再灌注引起的神经元凋亡。
综上所述,治中颗粒可通过调节Caspase-3和AIF在神经元中的表达对脑缺血再灌注模型产生保护作用,以上药效学结果为治中颗粒在临床上治疗脑缺血性疾病提供了试验依据。
