急性温度胁迫对大口黑鲈存活率及肝脏生化指标的影响
2020-04-23张佳佳王佩佩周国勤
陆 健,张佳佳,王佩佩,周国勤,庆 辉
(南京市水产科学研究所,南京 210036)
温度作为一个重要的环境因子,在生物的生长、发育、形态、行为、数量和分布等方面起着极其重要的作用[1]。鱼类作为变温动物,其生长发育等所有的生理过程皆会受到环境因素的影响。先前的研究表明,在一定的适应范围内,较高的温度能促进鱼苗的生长,从而带来良好的经济效益[2,3]。但如果水温在短时间内急剧波动,鱼类会因不能立即适应新的环境而导致死亡,同时鱼类体中的蛋白质、酶等物质在高温下会变性失活,造成鱼体抵抗力变弱而死亡[4]。近年来,由于人类过渡的破坏,包括森林砍伐、耕地活动和工业生产导致内陆环境温度总体升高,从而导致全球气候的变化、极端天气的频现。生产活动中,由夏季连续高温、极端天气等事件引起的鱼类致死事件已有报道[5,6],因此探究急性高温下鱼类生理变化机制对于鱼类的健康养殖具有重要的实践指导意义。
大口黑鲈(Micropterussalmoides)“优鲈3号”(GS-01-001-2018)是2019年经全国水产原种和良种审定委员会审定通过的新品种之一,是以“优鲈1号”(GS01-004-2010)和从美国新引进的北方亚种为基础选育种群,采用群体选育和分子生物学技术相结合的方法,经连续4代选育而获得。在投喂人工配合饲料的养殖条件下,与“优鲈1号”和未选育群体相比,“优鲈3号”稚鱼驯化时间明显缩短,幼鱼和成鱼的生长速度较快,养殖5~7个月即可达到上市规格,适合在我国淡水水域进行人工配合饲料养殖[7]。“优鲈3号”作为水产领域的新星,将会迎来广阔的养殖前景,但关于其研究还较少,目前尚未见到有关“优鲈3号”在温度胁迫下的各项机能反应的报道。同时,肝脏作为鱼类最主要的代谢器官,在鱼类适应温度变化的过程中发挥重要作用[8]。因此本文以大口黑鲈“优鲈3号”为研究对象,探究了其在急性温度胁迫下的存活率、肝脏抗氧化酶活性和非特异性免疫应答,旨在为大口黑鲈“优鲈3号”应对高温胁迫的机制和健康高效养殖提供基础数据。
1 材料与方法
1.1 实验处理
实验所用大口黑鲈“优鲈3号”幼鱼(体质量(9.87±1.2)g,体长(7.9±0.4)cm)均来自江苏南京帅丰饲料有限公司,将实验用鱼暂养于有生物过滤水再循环系统(配备有冷却和加热功能,流速为5 L/min,光照时间为14 h)的水族箱中。每天投喂两次(8∶00~9∶00和20∶00~21∶00)江苏南京帅丰饲料有限公司“优鲈3号”专用饲料。整个暂养和实验期间水体溶氧高于5 mg/L,氨氮与亚硝酸盐低于0.01 mg/L,实验前禁食24 h,实验期间不投喂。
将各组幼鱼在25 ℃水温下暂养15 d后,对照组水温保持在该温度下恒定。将实验组迅速转入预调好水温的水循环缸中(31 ℃、34 ℃、37 ℃),每个实验组包括四个平行,每个平行含有30尾幼鱼,在相应的实验水温下保持至实验结束,并于0、1、3、6、12、24、48 h记录死亡幼鱼个体数量。同时取6条幼鱼的肝脏组织于液氮中速冻,然后转移至-80℃中保存,用于酶活力的测定。
1.2 酶活性测定
准确称取0.1 g肝组织,按照重量(g)∶体积(mL)=1∶9的比例加入0.9 mL的生理盐水,冰水浴条件下机械匀浆,2 500 r/min,离心10 min,取上清液为10%的组织匀浆液,分装置于-20 ℃冰箱备用。组织样品的蛋白浓度、总超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶、酸性磷酸酶、碱性磷酸酶、溶菌酶酶活性测定均采用南京建成生物工程研究所提供的试剂盒,按照实际浓度做微小调整,选用最适浓度测量。
1.3 数据统计与分析
实验所得数据均用平均值±标准差的方式表示,所有数据均用 SPSS 19.0进行统计分析。利用方差分析(One-way ANOVA)进行显著性检验,P<0.05表示差异显著,用最小显著极差法(LSD)分析不同温度胁迫下同一时间大口黑鲈“优鲈3号”酶活性的差异,以及同一温度胁迫下不同时间大口黑鲈“优鲈3号”酶活性的差异。用Origin 8.6 绘图。
2 结果与分析
2.1 急性温度胁迫对大口黑鲈“优鲈3号”存活率的影响
大口黑鲈“优鲈3号”在不同的温度胁迫下表现出不同的存活率(图1)。其中31 ℃组在整个实验过程中均未出现死亡,34 ℃组在实验24 h出现个体死亡,死亡率为3.33%,48 h存活率为93.33%。而37 ℃组,大口黑鲈“优鲈3号”在6 h就出现死亡现象,实验结束时大口黑鲈“优鲈3号”的存活率仅为50%。

图1 急性温度胁迫对大口黑鲈“优鲈3号”存活率的影响Fig.1 Effect of acute temperature stress on survival rate of M.salmoides “Youlu No.3”
2.2 急性温度胁迫对大口黑鲈“优鲈3号”肝脏抗氧化酶活性的影响
急性温度胁迫下大口黑鲈“优鲈3号”肝脏中总超氧化物歧化酶(T-SOD)活力变化见图2。31 ℃和34 ℃实验组T-SOD活力呈先升高再下降再升高的变化趋势,31 ℃组在1 h达到第一个峰值(309.86 U/mgprot)后随之下降,3 h时与对照组无显著性差异,在6 h又开始上升并在48 h时达到最高值(421.58 U/mgprot),显著高于其他时间点;34 ℃组在3 h达到第一个峰值(299.25 U/mgprot)后随之下降,12 h显著低于对照组,24 h又开始上升,48 h显著高于对照组。37 ℃组实验组T-SOD活力呈先升高再下降的变化趋势,在1 h达到峰值(298.26 U/mgprot)后随之下降,在24 h与对照组无显著性差异。
急性温度胁迫下大口黑鲈“优鲈3号”肝脏中过氧化氢酶(CAT)活力变化见图3。各组CAT活力均呈先升高再下降的变化趋势,且均在3 h达到最高值,分别为108.80、115.95、109.36 U/mgprot,显著高于其他时间点(31 ℃组6 h组除外)。31 ℃和34 ℃实验组CAT活力在48 h仍显著高于对照组,37 ℃实验组在24 h与对照组无显著差异。31 ℃和34 ℃实验组CAT活力在1-48 h内均显著高于对照组(34 ℃组48 h除外)。
急性温度胁迫下大口黑鲈“优鲈3号”肝脏中谷胱甘肽过氧化物酶(GSH-PX)活力变化见图4。31 ℃和34 ℃实验组GSH-PX活力呈先升高再下降再升高的变化趋势,31 ℃组在3 h达到第一个峰值(82.93 U/mgprot)后随之下降,在24 h又开始上升并在48 h时达到最高值(108.41 U/mgprot),显著高于其他时间点;34 ℃组在6 h达到第一个峰值(85.69 U/mgprot)后随之下降,在24 h与对照组无显著差异,在48 h回升且显著高于对照组。37 ℃实验组GSH-PX活力呈先升高再下降的变化趋势,在6 h达到峰值(90.02 U/mgprot)后随之下降,在48 h与对照组无显著性差异。
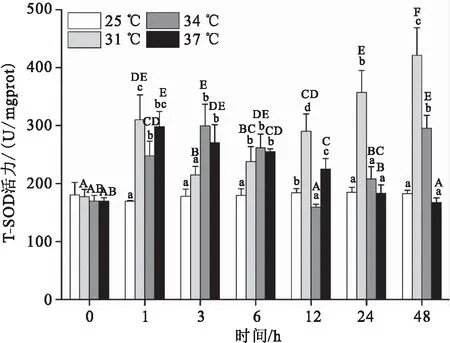
图2 急性温度胁迫对大口黑鲈“优鲈3号”肝脏T-SOD活性的影响Fig.2 Effect of acute temperature stress on T-SOD activities in liver of M.salmoides “Youlu No.3”图柱上方不同大写字母表示同一实验组不同时间的差异显著( P<0.05),不同小写字母表示同一时间段内不同实验组之间差异显著(P<0.05),下同。

图3 急性温度胁迫对大口黑鲈“优鲈3号”肝脏CAT活性的影响Fig.3 Effect of acute temperature stress on CAT activities in liver of M.salmoides “Youlu No.3”
2.3 急性温度胁迫对大口黑鲈“优鲈3号”肝脏非特异性免疫相关指标的影响
急性温度胁迫下大口黑鲈“优鲈3号”肝脏溶菌酶(LZM)活力变化见图5。各组LZM活力均呈先升高再下降的变化趋势。31 ℃实验组在1 h达到峰值(117.85 U/mgprot),显著高于对照组同时显著高于其他时间点,之后缓慢下降,直至48 h仍显著高于对照组。34 ℃实验组CAT活力在6 h达到峰值(111.45 U/mgprot),之后缓慢下降,48 h与对照组无显著差异。37 ℃实验组在6 h达到峰值(142.35 U/mgprot)后迅速下降至24 h与对照组无显著差异。

图4 急性温度胁迫对大口黑鲈“优鲈3号”肝脏GSH-PX活性的影响Fig.4 Effect of acute temperature stress on GSH-PX activities in liver of M.salmoides “Youlu No.3”

图5 急性温度胁迫对大口黑鲈“优鲈3号”肝脏LZM活性的影响Fig.5 Effect of acute temperature stress on LZM activities in liver of M.salmoides “Youlu No.3”
急性温度胁迫下大口黑鲈“优鲈3号”肝脏中碱性磷酸酶(AKP)活力变化见图6。31 ℃实验组在1 h迅速升高后基本保持不变,均显著高于对照组。34 ℃和37 ℃实验组AKP活力均在1 h达到峰值(分别为96.65 U/mgprot和80.73 U/mgprot),之后缓慢下降,34 ℃组显著高于对照组,37 ℃实验组24 h与对照组无显著差异。

图6 急性温度胁迫对大口黑鲈“优鲈3号”肝脏AKP活性的影响Fig.6 Effect of acute temperature stress on AKP activities in liver of M.salmoides “Youlu No.3”
急性温度胁迫下大口黑鲈“优鲈3号”肝脏中酸性磷酸酶(ACP)活力变化见图7。各组ACP活力均在6 h达到最高值,分别为84.17、87.93、90.48 U/mgprot,均显著高于对照组。31 ℃和34 ℃实验组在3 h下降至对照组水平,在6 h又升高,且显著高于对照组,随后又下降,直至48 h仍显著高于对照组。34 ℃组24 h与对照组无显著差异,37 ℃实验组12 h与对照组无显著差异,48 h显著低于对照组。

图7 急性温度胁迫对大口黑鲈“优鲈3号”肝脏ACP活性的影响Fig.7 Effect of acute temperature stress on ACP activities in liver of M.salmoides “Youlu No.3”
3 讨论
3.1 急性温度胁迫对大口黑鲈“优鲈3号”存活率的影响
温度是影响鱼类生存重要的环境因子之一, 主要对鱼类代谢反应起控制作用,从而能够影响鱼类的成活率[9-11]。由试验结果可知,在急性温度胁迫下,34 ℃时大口黑鲈“优鲈3号”的成活率高达95%以上,而37 ℃组的成活率已低至50%。由此可见,37 ℃高温对于大口黑鲈 “优鲈3号”幼鱼的生存已经构成威胁,因此,在培育大口黑鲈 “优鲈3号”鱼苗时温度应该保持在34 ℃以下,否则会造成稚、幼鱼的大量死亡。当温度高于22 ℃后,异齿裂腹鱼(Schizothoraxoconnori)幼鱼存活率显著降低,当温度为32 ℃时,存活率为0[11];太平洋鳕(Gadusmicrocephalus)15 ℃高温胁迫下的成活率仅为43.3%[12]。因此,在大规模健康养殖中应时刻注意由于高温天气导致的鱼类死亡而带来的经济损失,在夏季连续高温等极端天气来临之前应做好相应的防护措施,例如配备能够迅速降温的制冷系统等。
3.2 急性温度胁迫对大口黑鲈“优鲈3号” 抗氧化性相关指标的影响
鱼类在正常生理代谢中会产生有害的氧化自由基,但是鱼体内一般都存在清除自由基的抗氧化体系,使自由基处于一个正常水平,维持鱼体内正常的代谢活动[13]。但是当生物受到环境因子胁迫时,生物体就会产生过量的活性氧和氧自由基,打破生物体内活性氧代谢的平衡,如不及时消除就会造成生物体活性氧伤害。SOD作为生物防御系统中重要的抗氧化酶,可以消除过氧化氢(H2O2)、超氧阴离子等过量的自由基,同时CAT将SOD与自由基反应生成的 H2O2转化为水,去除体内H2O2,保护细胞免受H2O2毒性,此外,GSH-PX可以特异性地催化GSH和H2O2的还原,从而保护细胞膜的结构和功能[14]。因此,SOD、CAT、GSH-PX等一些抗氧化酶通过协同作用共同清除生物体内的氧自由基,从而维持机体正常代谢,可以作为判断生物体健康状况及其抗氧化防御能力的重要指标[12]。在本研究中,随着温度的升高和胁迫时间的增加,大口黑鲈“优鲈3号”的T-SOD 、CAT、GSH-PX酶活性迅速升高,且显著高于对照组,类似的结果也出现在温度胁迫后的军曹鱼(Rachycentroncanadum)[15]、毛蚶(Scapharcasubcrenata)[16]、太平洋鳕(Gadusmicrocephalus)[12]等,这可能是因为在胁迫初期,鱼体内产生大量自由基,各种抗氧化酶的活性被激发增强以清除过量的自由基,并通过适应性调节相关生理活动使得机体维持相对稳定的状态,说明这三种酶在鱼类应对高温胁迫中发挥了作用[17]。不同的是,在31 ℃、34 ℃、37 ℃温度胁迫下,大口黑鲈 “优鲈3号”的T-SOD酶活性分别在1 h、3 h、1 h达到第一个峰值,而CAT酶活性则均是在3 h达到峰值,GSH-PX酶活性分别在3 h、6 h、6 h达到第一个峰值,表明与总超氧化物歧化酶相比,过氧化氢酶和谷胱甘肽转移酶酶活性的变化有明显的滞后性,同样的结果也出现在温度胁迫后的太平洋鳕[12]中,这说明鱼类的总超氧化物歧化酶酶活性较过氧化氢酶更易受环境因子的影响。另外,在31 ℃和34 ℃温度胁迫后期,T-SOD和GSH-PX酶活性均有不同程度的回升,尤其31 ℃实验组更是在48 h达到最大值,原因可能是较低程度的增温,机体有能力清除由于应激产生的氧自由基,并保持较高的酶活性来适应环境的变化以保持体内平衡,存在抗热锻炼的可能性[5,18],是一种积极的调节活动。
3.3 急性温度胁迫对大口黑鲈“优鲈3号”非特异性免疫相关指标的影响
LZM是生物体吞噬细胞内溶酶体的标志酶,具有防御和免疫调节等生理作用[19],而AKP 和ACP是两种非特异性磷酸水解酶,能催化磷酸单酯的水解,打开磷酸酯键,释放磷酸离子,促使磷酸基团的转移反应,从而广泛参与调节生物体生长代谢、保持内环境稳定以及维持机体健康,且其功能作用会受到营养状况、疾病及环境变化的影响[20,21]。当鱼体的免疫水平发生变化时,它们也会产生相应的变化,因此它们可以作为水产动物在环境胁迫下反映非特异性免疫功能的指标。本实验结果表明在温度胁迫后初期,大口黑鲈 “优鲈3号” LZM、AKP和ACP活力均有不同程度的上升趋势,且显著高于对照组,产生此现象原因可能是在胁迫初期鱼体受到应激导致分泌水解酶的能力增强,使之浓度升高,活力增强。这与高温胁迫后吉富品系尼罗罗非鱼(Oreochromisniloticus)[22]、银鲳(Pampusargenteus)[21]相关免疫酶活变化研究的结果相似。值得注意的是,在31 ℃和34 ℃胁迫过程中相关免疫酶活显著高于对照组,表明与25 ℃比较而言,31 ℃和34 ℃下大口黑鲈“优鲈3号”具有更高的生理代谢和免疫水平,适当增加水温可以保证鱼体的免疫能力的充分发挥,减少疾病的发生。同样的,吉富品系尼罗罗非鱼[22]在31 ℃水温中的AKP和LZM活力显著高于25 ℃,大菱鲆(Scophthalmusmaximus)在27 ℃水温中的AKP活力显著高于24 ℃。此类相似的结果也在大比目鱼(Hippoglossushippoglossus)[23]、大西洋鲷(Sparusaurata)[24]等鱼中获得。但37 ℃胁迫后 AKP和ACP活力均呈现先上升再下降的趋势,且在实验结束时低于对照组,这可能是37 ℃的高温造成一种不可逆转的热应激,从而使其代谢水平下降,表现为水解酶AKP 和ACP活性的降低,这与37 ℃胁迫后大口黑鲈“优鲈3号”死亡率的结果一致。本研究结果表明,37 ℃已经成为大口黑鲈“优鲈3号”的致死温度,在日常养殖生产中,需要密切关注池塘温度的变化,减少温度应激,增加鱼体免疫力,提高抗病害能力。同时做好应对高温天气的防护措施。
