脂肪酸酰基辅酶A 合成酶对酿酒酵母己酸乙酯合成的影响
2020-04-23何亚辉马艳蕊薛星祥杜永静陈叶福郭学武肖冬光
何亚辉,马艳蕊,薛星祥,杜永静,陈叶福,郭学武,肖冬光
(工业发酵微生物教育部重点实验室,天津市微生物代谢与发酵过程控制技术工程中心,天津科技大学生物工程学院,天津 300457)
中国白酒与白兰地、伏特加、威士忌、朗姆酒和金酒并称世界著名的六大蒸馏名酒[1].根据风味特征的不同,中国白酒可分为4 种主要香型:清香型、浓香型、酱香型和米香型,其中浓香型白酒占据了中国白酒市场的70%[2-3].己酸乙酯是浓香型白酒的主要特征风味物质,其含量的多少直接决定了浓香型白酒的风味品质.
传统浓香型白酒发酵过程中,己酸乙酯主要是在发酵后期由窖泥微生物中的己酸菌产生的己酸在大曲中酯化酶的作用下与酿酒酵母产生的乙醇发生酯化反应生成的[4-5].其中的己酸菌属于厌氧菌,生活在窖泥内部,因此其产生的己酸要参与生成己酸乙酯的过程就要渗透到窖泥的外层到发酵醅中去,这会增加粮耗并且延长发酵周期,同时窖泥还会生成一些不良的风味物质如土臭素等,对浓香型白酒品质产生负面影响[6].
在酿酒酵母(S.cerevisiae)中己酸乙酯可以经醇乙酰基转移酶催化己酰辅酶A 与乙醇生成己酸乙酯[7-8],而此时其前体物质己酰基辅酶A 的浓度是其生成的一个重要限制因素[9].有研究[10]表明添加外源脂肪酸可以提高乙基酯的产量.酿酒酵母在利用外源脂肪酸的时候主要是通过脂酰辅酶A 合成酶的作用,将外源脂肪酸以酰基辅酶A 的形式摄入胞内,进而增加了胞内酰基辅酶A 的浓度,然后再经醇乙酰基转移酶作用生成相应的酯.例如,中链脂肪酸乙酯(己酸乙酯、辛酸乙酯、癸酸乙酯)通过增加前体中链脂肪酸(MCFAs)的含量,使得中链脂肪酸乙酯含量升高,即在一定范围内,高浓度的MCFAs 可以促进乙基酯的生成[11].在实际生产中,将培养的己酸菌液加入发酵曲中作为生产己酸乙酯的前体物质,能够显著增加己酸乙酯的产量,并且缩短发酵周期,降低成本.
酿酒酵母中的脂酰辅酶A 合成酶的基因有FAA1—FAA4、FAT1—FAT2[12-14].Leber 等[15]证明FAA1、FAA2、FAA3 和FAT1 参与外源游离脂肪酸(FFA)的吸收活化用于脂肪酸以及脂肪酸乙酯的合成,FAA2 基因可以将外源脂肪酸直接吸收活化为酰基辅酶A 的形式并运入过氧化物酶体,降解形成乙酰辅酶A.Asano 等[16]报道,敲除FAA1 基因的清酒酵母可较大幅度地提高己酸乙酯的产量,这是由于FAA1 基因控制绝大部分长链脂肪酸的吸收,敲除FAA1 后,长链脂肪酸活化为长链酰基辅酶A 的量减少,减轻了对乙酰辅酶A 羧化酶的抑制,使得己酸乙酯的生成量有所提高.Faergeman 等[17]研究表明,酿酒酵母对外源长链脂肪酸进行代谢之前,需要先通过酰基辅酶A 合成酶Faa1p 和Faa4p 吸收和活化,以及Fat1p 转运蛋白的参与.敲除FAA1 和FAA4 基因后,酵母酰基辅酶A 的水平下降了10%.Knoll 等[18]曾报道过酿酒酵母体内的3 种酰基辅酶A 合成酶基因 FAA1、FAA2、FAA3,将其编码的蛋白 Faa1p、Faa2p、Faa3p 分别在缺乏酰基辅酶A 合成酶的大肠杆菌(E.coli)内表达,实验表明Faa1p 倾向于利用C12∶0—C16∶0 脂肪酸(12~16 个碳的脂肪酸);Faa2p 利用范围是C7∶0—C17∶0 脂肪酸;Faa3p 倾向利用C16∶0 和C18∶0 脂肪酸.研究[19]表明,通过同时异源表达产氨短杆菌(Brevibacterium ammoniagenes)的Ⅰ型脂肪酸合成酶系统过表达FAA1,从而提高酰基CoA 含量,并在此基础上过表达WS/DGAT基因,脂肪酸乙酯的产量提升了6.3 倍.由此看出,酯酰辅酶A 合成酶对酿酒酵母中己酸乙酯的生成量有一定影响.
本研究构建了脂肪酸酰基辅酶A 合成酶基因FAA1—FAA4、FAT1 的敲除和过表达菌株,并根据添加己酸发酵结果构建了FAA3 敲除同时过表达FAA4菌株α5-FAA4ΔFAA3,旨在增强酿酒酵母利用外源己酸生成己酸乙酯的能力.
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本实验所用的所有菌株和质粒见表1,大肠杆菌(E.coli)DH5α、酿酒酵母(S.cerevisiae)AY15 的单倍体α5 均为天津科技大学天津市工业微生物重点实验室保藏.质粒Yep352、pUG6 为本实验室保藏.
1.1.2 培养基及培养条件
YEPD 培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10.
LB 培养基(g/L):葡萄糖10,氯化钠10,酵母浸粉5.
以上两种培养基,自然pH,固体培养基加20 g/L琼脂,115 ℃高压灭菌15 min.
一级种子液:糖度为8 Brix 的玉米水解液,酵母浸粉5 g/L.
二级种子液:糖度为12 Brix 的玉米水解液,酵母浸粉5 g/L.
发酵培养基:60 g 玉米粉按1﹕3(g﹕mL)的料水比加水,70 ℃糊化20 min,加30µL 淀粉酶,85~90 ℃液化90 min,加适量营养盐和酸性蛋白酶及90µL 糖化酶,55~60 ℃糖化20 min 后待用.
1.1.3 试剂与仪器
淀粉酶(2.9×105U/mL)、糖化酶(1.0×105U/mL)、限制性内切酶、DNA 连接酶、rTaq 聚合酶、RNA 提取试剂盒、质粒精提试剂盒、PCR 纯化回收试剂盒及荧光定量PCR 试剂盒,宝生物工程(大连)有限公司;卡那霉素(KanMX),美国Merck 公司.
所用仪器主要有PCT-200 型PCR 仪、高速离心机、水浴锅、电子天平、DYY-4c 型电泳仪、照胶仪、移液枪、DL 102x 型电热鼓风干燥箱、StepOneplusTM实时荧光定量PCR(Real-time PCR)仪、安捷伦7890型气相色谱、安捷伦1260 型高效液相色谱.

表1 实验所用质粒和菌株Tab.1 Strains and plasmids used in this study
1.2 实验方法
本实验采用酵母基因同源重组基因改造方法,同时结合载体构建技术将相应基因连接到载体Yep352上,然后在酿酒酵母α5 基因组的相应位置上做相关基因的敲除和过表达,并筛选得到重组菌株.
1.2.1 引物
本实验所用引物均通过Primer 5.0 软件设计获得,酿酒酵母基因序列均从NCBI 数据库获得.引物由金唯智生物科技有限公司合成.
1.2.2 重组质粒Yep-PF1 的构建
将纯化后的 FAA1 片段用 Bgl Ⅱ酶切连入Yep352-P,构建表达载体Yep-PF1,构建过程如图1所示.其余几个基因的载体构建与此方法相同.
1.2.3 酵母转化
将准备好的待转片段使用醋酸锂转化法转化到酿酒酵母α5 中,在含100µg/mL G418 的YEPD 平板上涂布,30 ℃培养 2 d,然后对平板上的单菌落进行筛选验证.
1.2.4 发酵验证
从斜面上挑取1 环菌种接种到5 mL 一级种子液,30 ℃静置培养24 h,再按照10%的集中量将一级种子液接种到45 mL 二级种子液中,30 ℃静置培养16~17 h,再按照10%接种量接种到发酵培养基进行发酵,每隔12 h 进行CO2失重测定.每个样品做3个平行样.

图1 重组质粒Yep-PF1的构建Fig.1 Construction of plasmid Yep-PF1
1.3 分析方法[20]
1.3.1 发酵数据测定
每隔12 h 对发酵样品进行CO2失重测定,采用斐林试剂法测定样品中残还原糖的量,酒精计比重法测发酵完样品酒精度.
1.3.2 己酸乙酯的测定
发酵结束后对发酵液进行蒸馏,对蒸馏样进行气质联用(GC-MS)分析.将酒样稀释到体积分数12%,取8 mL 样品于 20 mL 螺口顶空进样瓶,加入3 g NaCl 后,再放入搅拌子,用封口膜封好.样品在恒温磁力搅拌器中60 ℃平衡10 min,将萃取头插入瓶内顶空吸附40 min.萃取后将萃取头插入GC-MS 系统进样器,250 ℃解吸附5 min.GC-MS 检测条件:色谱柱为HP-5MS(60 m×0.32 mm×0.25µm)石英毛细管柱;进样口温度250 ℃;载气为高纯氦气,流量1 mL/min;起始柱温40 ℃保持3 min,以9 ℃/min 升至116 ℃,保持4 min,再以9 ℃/min 升至260 ℃,保持5 min;不分流进样.质谱仪条件:离子源为EI 源,离子源温度230 ℃,电子能量70 eV,四极杆温度150 ℃,接口温度280 ℃,电子倍增器电压1 280 V,扫描范围m/z 为40~450.
1.3.3 脂肪酸的测定
脂肪酸的测定首先将其衍生化为易挥发的甲酯再用GC-MS 进行分析.衍生条件:取30 mL 发酵上清液,加入6 mL 氯仿-甲醇溶液(体积比为2﹕1),充分振荡30 s,4 ℃、5 000 g 离心10 min,氯仿相氮气吹干后加入0.5 mol/L NaOH-CH3OH 溶液1 mL,65 ℃保温30 min,室温冷却后加入BF3-CH3OH 溶液1 mL,70 ℃保温2 min 后,冷却至室温,加入1 mL正己烷振荡萃取,同时加入适量饱和NaCl 溶液和无水Na2SO4除水,最后吸取正己烷层过膜后待测[21].GC-MS 检测条件:色谱柱HP-5MS(60 m×0.32 mm×0.25µm)石英毛细管柱;进样口温度为250 ℃;载气为高纯氦气,流量1 mL/min;柱温起始为200 ℃保持0 min,以2 ℃/min 升至230 ℃,保持0 min,再以8 ℃/min 升至260 ℃,保持15 min;分流比1﹕1 进样.质谱仪条件:离子源为 EI 源,离子源温度230 ℃,电子能量70 eV,四极杆温度150 ℃,接口温度280 ℃,电子倍增器电压1 280 V,扫描范围m/z 为40~450.
1.3.4 实时荧光定量PCR(Real-time PCR)
对重组菌株相应基因的表达水平采用实时荧光定量 PCR 测定.重组菌株用 YPD 液体 30 ℃、180 r/min 摇床培养12 h,用酵母RNA 试剂盒提取mRNA,以mRNA 为模板,采用反转录试剂盒合成互补脱氧核糖核酸(cDNA),以cDNA 为模板,对FAA4基因进行实时荧光定量PCR.实时荧光定量PCR 反应条件:95 ℃ 5 s,60 ℃ 30 s,72 ℃ 45 s,40 个循环.以肌动蛋白基因ACT1 为内参基因.
1.4 数据分析
每个样品做3 个平行样,应用SPSS 11.0 和Origin 8.0 软件对实验数据进行差异显著性分析.
2 结果与讨论
2.1 出发菌的耐己酸实验
由于高浓度的脂肪酸会对酿酒酵母的生长产生抑制,在不影响酵母生长的条件下,为确定合适的己酸添加浓度,进行了出发菌α5 耐己酸实验.选定在YEPD 平板中添加不同浓度的己酸,将30 ℃过夜摇床培养的酵母菌稀释一定倍数涂布于平板上,观察长势,己酸添加量分别为0%、0.005%、0.01%、0.02%,结果如图2 所示.选定体积比0.01%作为己酸添加浓度.
2.2 脂肪酸酰基辅酶A合成酶基因的敲除对己酸乙酯产量的影响
本实验通过用loxP-KanMX-loxP 片段替代了对应的酰基辅酶A 合成酶基因,得到对应的敲除菌株α5ΔFAA1-4 和α5ΔFAT1;通过把对应的过表达盒敲入到对应的酰基辅酶A 合成酶基因位点,得到对应的过表达菌株.以下以敲除FAA2 为例阐述重组菌株的构建过程.以酿酒酵母α5 基因组为模板,PCR 扩增得到FAA2 基因的上、下游同源臂片段FA(482 bp)、FB(512 bp).以pUG6 质粒为模板,PCR 扩增得到KanMX 片段(1 613 bp).其电泳结果如图3 所示,PCR 扩增的特异性条带大小与目标片段大小一致,结果正确,扩增产物经PCR 纯化回收或切胶回收.
在含有1 000 mg/L G418 抗性的YEPD 平板上筛选重组突变菌.在30 ℃培养的抗性板上挑取转化子进行PCR 验证.以出发菌株α5 的基因组为阴性对照,FAA2 基因缺失菌株基因组为模板,分别对突变菌的上、下游进行PCR 定点验证,结果如图4 所示.由图4 可见:得到784 bp 和1 587 bp 大小的特异性条带,与预期大小一致.阴性对照无条带,说明FAA2 敲除菌株α5ΔFAA2 构建成功.
基因敲除后自身会导致中短链脂肪酸乙酯产量变化,为排除其对后续添加己酸发酵实验的干扰,进行了敲除菌株玉米浓醪液态发酵实验作为空白对照,结果如图5 所示.突变株相较于出发菌株的脂肪酸乙酯产量变化都很小(小于0.5 mg/L).

图4 突变株α 5ΔFAA2 PCR 定点验证Fig.4 PCR verification of the mutant strain α 5ΔFAA2

图5 突变株在不添加己酸时的脂肪酸乙酯产量Fig.5 Comparison of fatty acid ethyl esterse production without adding caproic acid of mutant strains
添加己酸经玉米醪发酵后检测的中链脂肪酸乙酯(FAEEs)和游离脂肪酸(FFAs)产量结果如图 6所示.
从图6 中可以看出:FAA3 基因敲除菌α5ΔFAA3在添加己酸发酵后,己酸乙酯产量相较于出发菌α5提高了23.8%,产量提高了约2.6 mg/L.辛酸乙酯和癸酸乙酯产量也分别提高了50.0%和25.5%.推测FAA3 基因能够将己酸活化为己酰辅酶A 并送入过氧化物酶体中进行降解,因为在有些可以利用脂肪酸作为碳源的菌中,Faa3p 倾向于将C16∶0 和C18∶0的脂肪酸经过几次的β 氧化最终变成乙酰CoA 进入TCA 循环,因此这个过程也会对己酰CoA 产生一定的降解作用,则敲除FAA3 基因有助于提高己酰辅酶A 的积累.游离的饱和脂肪酸会显著影响白酒的品质,突变株中长链脂肪酸C16∶0 的产量提高了67.5%.这也说明酵母确实有摄入外源脂肪酸的能力,证明了实验的可行性.

图6 出发菌和突变株在添加己酸后的中链脂肪酸乙酯和游离脂肪酸的产量Fig.6 FAEEs and FFAs yield after adding caproic acid of α5 strain and mutant strains
2.3 脂肪酸酰基辅酶A 合成酶基因的过表达对己酸乙酯产量的影响
为了进一步研究各基因对己酸摄入的作用,分别构建了酰基辅酶A 合成酶基因用PGK1 强启动子在原位点过表达菌株α5-FAA1—α5-FAA4、α5-FAT1 和以OPI1 为敲除整合位点的过表达菌株α5O-FAA1—α5O-FAA4、α5O-FAT1(其中OPI1 是肌醇负调控基因,敲除OPI1 能够提升风味酯的产量,所以选择此位点).玉米浓醪液态发酵空白对照实验结果如图7所示.
从图7(a)中可知:与出发菌α5 相比,突变菌α5-FAA1—α5-FAA4、α5-FAT1 己酸乙酯等中链脂肪酸乙酯的产量都有一定量的浮动,但变化量很小,可忽略不计.由图7(b)可知:α5O-FAA1 菌株己酸乙酯有一定量的提高,但变化量在1.0 mg/L 以下,变化量较小.
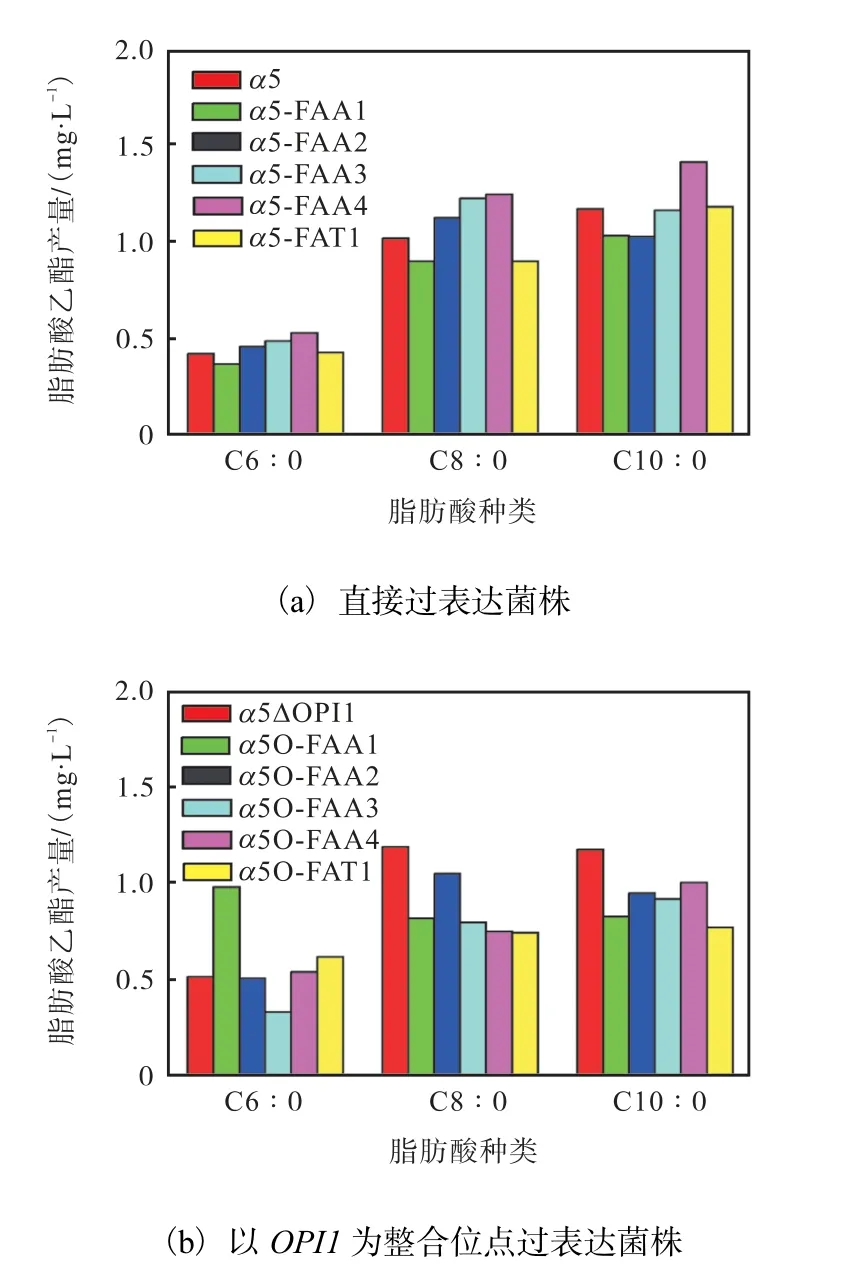
图7 出发菌和单过表达菌在不添加己酸时的脂肪酸乙酯产量Fig.7 Fatty acid ethyl esters yield without adding caproic acid of α5 strain and single overexpressing strains
经添加己酸发酵后,己酸乙酯结果如图8 所示,相较于出发菌α5,FAA4 过表达菌株α5-FAA4 中己酸乙酯产量提高了32.1%,增加了约3.5 mg/L,辛酸乙酯和癸酸乙酯产量也分别提高了61.5%和47.9%.α5O-FAA4 中己酸乙酯产量提高了20.7%,辛酸乙酯也提高了12.7%.结果表明FAA4 基因过表达能够较大幅度地提高对己酸的摄入,增加前体己酰辅酶A的含量.
游离脂肪酸结果如图9 所示,α5-FAA4 的长链脂肪酸C16∶0 和C18∶0 的产量分别增加了174%和77%;α5O-FAA4 的长链脂肪酸C16∶0 和C18∶0 的产量分别增加了125%和86%.

图8 出发菌和单过表达菌在添加己酸后的脂肪酸乙酯产量Fig.8 Fatty acid ethyl esters yield after adding caproic acid of α5 strain and single overexpressing strains
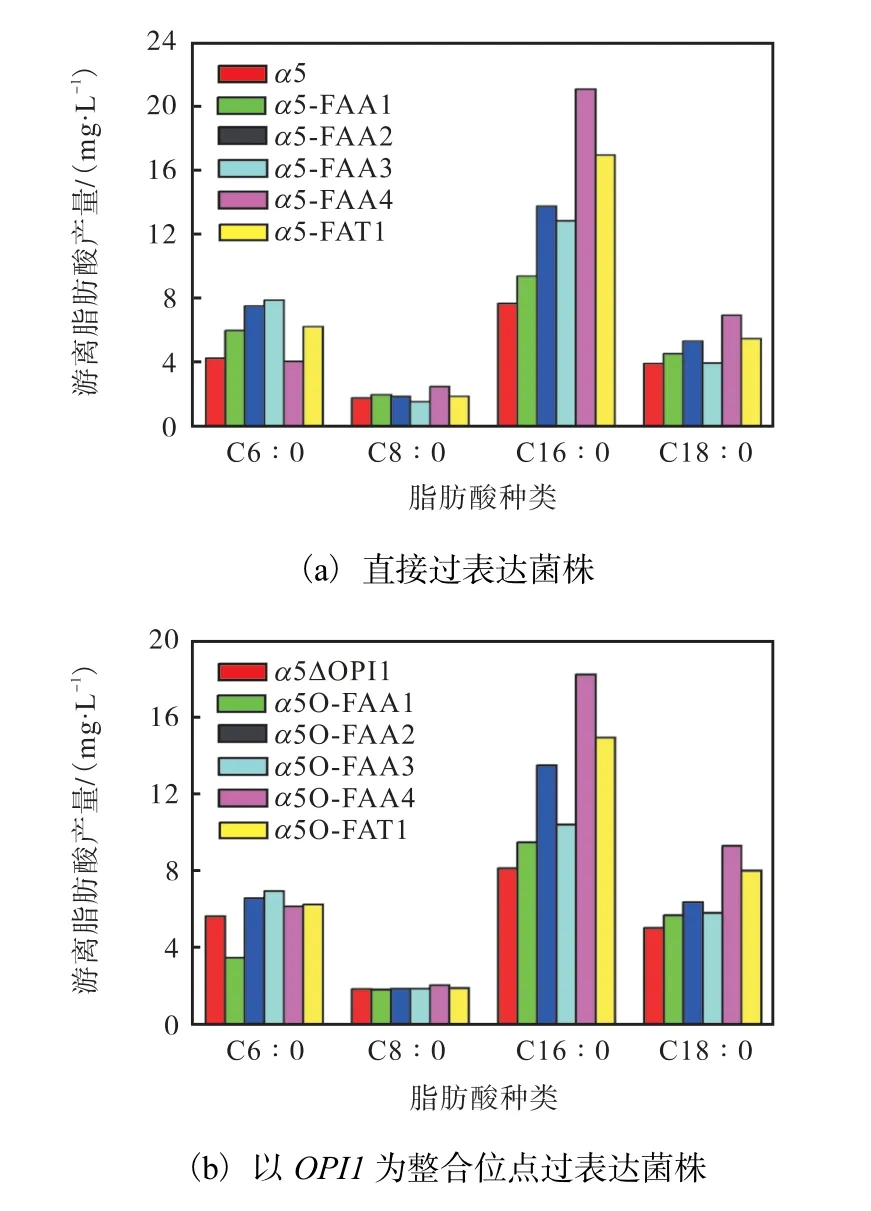
图9 出发菌和单过表达菌在添加己酸后的游离脂肪酸产量Fig.9 FFAs production after adding caproic acid of α5 strain and single overexpressing strains
2.4 敲除FAA3 同时过表达FAA4 对己酸乙酯产量的影响
为了进一步提高己酸摄入,增加己酸乙酯生成量,构建了用PGK1 强启动子过表达FAA4 同时敲除FAA3 的重组菌株α5-FAA4ΔFAA3.玉米浓醪液态发酵空白对照实验结果如图10 所示.相较于出发菌α5,重组菌α5-FAA4ΔFAA3 中己酸乙酯、辛酸乙酯和癸酸乙酯都有一定量的提升,但变化量都很小.

图10 出发菌和重组菌在不添加己酸时的脂肪酸乙酯产量Fig.10 Fatty acid ethyl esters production without adding caproic acid of α5 strain and recombinant strains
经添加己酸发酵后,中链脂肪酸乙酯和游离脂肪酸结果如图11 所示.

图11 出发菌和重组菌在添加己酸后的脂肪酸乙酯和游离脂肪酸产量Fig.11 Fatty acid ethyl esters and FFAs production after adding caproic acid of α5 strain and recombinant strains
重组菌中己酸乙酯产量达到了17.34 mg/L,相比于出发菌α 5 提高了57.4%,辛酸乙酯和癸酸乙酯也分别提高了106%和48%.其长链脂肪酸C16∶0 和C18∶0 的产量分别提高了219%和119%.结果表明,敲除FAA3 和过表达FAA4 能够显著提高己酸摄入,增加己酸乙酯的生成量.
基于上述结果,测定了出发菌α5 与重组菌α5-FAA4、α5O-FAA4、α5-FAA4ΔFAA3 中FAA4 基因的表达水平,并与其己酸乙酯产量作对比,结果见表2.
重组菌株α5O-FAA4、α5-FAA4 和α5-FAA4ΔFAA3 的FAA4 基因表达量分别是出发菌株α5 的3.6、9.1 和10.7 倍;且随着FAA4 基因表达量的提高,己酸乙酯产量也有相应的提高.这证明FAA4 基因过表达能够提高己酸的摄入,增加己酸乙酯生成量.

表2 出发菌和重组菌中的FAA4 基因表达水平和己酸乙酯产量Tab.2 FAA4 gene expression level and ethyl caproate production of α5 strain and recombinant strains
2.5 重组菌株的发酵性能
进一步测定工程菌α5-FAA4ΔFAA3 在玉米水解液中的生长和发酵性能(生物量、CO2失重、残糖、酒精度),与α5 比较,评价其生长发酵性能.如图12所示.

图12 出发菌和重组菌的生长发酵特性Fig.12 Growth fermentation characteristics of α5 strain and recombinant strain
α5-FAA4ΔFAA3 与出发菌α5 相比,生长速率相近,在14 h 达到了稳定期,α5-FAA4ΔFAA3 最终生物量略有升高.重组菌发酵速率也有所提高,最终CO2失重量一致.残糖和酒精度无显著差异(表3).综上所述,重组菌的生长速率、生物量、酒精度及CO2失重方面的发酵性能相对于出发菌株来说略有提升.

表3 出发菌和重组菌发酵后的酒精度和残糖Tab.3 Alcohol content and residual sugar after fermentation of α 5 strain and recombinant strain
3 结 语
提高己酸乙酯的含量是中国浓香型白酒的主要研究方向之一,其中主要有两个途径:一是提升白酒酵母的产酯能力,二是在酿造工艺通过添加外源己酸来增加己酸乙酯的含量.本研究是通过将两种方式结合,构建了重组菌α5-FAA4ΔFAA3,提高了白酒酵母对外源己酸的摄入能力,进而增加了己酸乙酯合成所需己酰辅酶A 的量,从而促进了己酸乙酯的生成.其中敲除菌株中单敲FAA3 菌株己酸乙酯提高较明显,过表达菌株中单过表达FAA4 菌株己酸乙酯提高较明显,进而构建了过表达FAA4 同时敲除FAA3的重组菌α5-FAA4ΔFAA3,其己酸乙酯生成量达到了17.34 mg/L,相较于原菌α5 提高了57.4%.能够显著提高酿酒酵母在酒精发酵阶段利用外源己酸生成己酸乙酯的能力.
