IL35+B细胞在系统性红斑狼疮患者外周血中表达分析
2020-04-23陆玲娜韩文伦
陆玲娜 韩文伦
系统性红斑狼疮(SLE)是一种自身免疫性疾病,与免疫耐受机制的逐渐恶化有关。目前主要认为B 淋巴细胞多克隆活化与T、B 淋巴细胞凋亡紊乱与系统性红斑狼疮的发病机制有关[1]。研究认为B 细胞通过分泌IL10 参与免疫抑制,并与自身免疫性疾病具有相关性[2]。B 细胞还可以通过分泌IL-35 发挥免疫调节功能[3-4]。IL-35(p35/Ebi3)属于IL-12 家族成员,其特征在于由α 链(p35)和β 链(Ebi3)相互作用形成的异二聚体,被认为主要由调节性T 细胞分泌,并在体外和体内疾病模型被证明具有抑制T 细胞增殖的功能[5]。近年来有研究发现B 细胞也能够分泌IL35,同样具有负性免疫调节作用,且与在动物模型实验中证明B 细胞分泌的IL35 与自身免疫性疾病具有相关性[4]。本文探讨SLE 活动期与静止期CD19+EBI3+p35+B细胞(IL35+B 细胞)的表达变化及临床意义。
1 材料与方法
1.1 临床资料 收集2017 年8 月至2018 年8 月本院系统性红斑狼疮患者41 例,男6 例,女35 例;年龄15~69 岁,平均年龄36.3 岁。均符合1997 美国风湿病学学会制定的诊断标准。SLE 疾病活动性通过疾病活动指数(SLEDAI)判断,其中初发、未治疗的活动期SLE 患者16 例(SLEDAI>9),稳定期患者21 例(SLEDAI ≤9)口服泼尼松5~6g/d 维持治疗。本院同期体检健康者17 例为对照组,男1 例,女16 例;年龄20~75 岁,平均年龄38.4 岁。所有研究对象均采集EDTA 抗凝外周血标本2ml。所有样本均将巨细胞病毒、单纯疱疹病毒、风疹病毒、弓形虫、轮状病毒、柯萨奇病毒、支原体、衣原体、甲型肝炎B、C、D 病毒感染及其他自身免疫性疾病和慢性感染性疾病排除在外。本项目经本院伦理评审委员会批准,所有研究对象均签署知情同意。
1.2 方法 (1)PBMC 制备与刺激:采用密度梯度离心法从EDTA 抗凝全血中分离出PBMC,将分离的PBMC 悬浮在添加10%胎牛血清、2mmol/L 谷氨酰胺和100U/ml 青霉素/链霉素的RPMI-1640 培养基(均购于GIBCO 公司)中,加细胞刺激混合剂(BD 公 司,Cat:550583,), 内 含50ng/ml PMA(phorbol 12-myristate 13-acetate)、1μg/ml 离子霉素和10μg/ml brefeldin A。37℃,5%CO2的培养箱中培养4h。(2)IL35+B 细胞测定:培养后PBMC 加FITC-CD19(Beckman coulter,Cat:A07768)胞外染色15min,使用Cytofix/Cytoperm kit(BD Biosciences,Cat:554714) 固 定破 膜, 加 入PerCP-IL12/IL-35 p35(Cat:IC2191C,R&D Systems),PE-IL12/IL35 EBI3(Cat:360904,Biolegend)胞内染色15min,上机检测。用未刺激的外周血单个核细胞作为同种型对照被用来确认染色的特异性。
1.3 统计学方法 采用SPSS 统计学软件。计量资料以(±s)表示,三组间比较采用Kruskal-Wallis 检验,两组间比较采用Mann Whitney U 检验,相关性检验采用spearman 秩相关。P<0.01 为差异有统计学意义。
2 结果
2.1 系统性红斑狼疮活动期IL35+B 细胞表达 检测三组IL35+Breg表达频率,活动期SLE为(1.063±1.467)%,稳 定 期SLE 为(3.458±3.124)%, 健 康 对 照 组为(4.639±3.047)%。三组比较差异有统计学意义(P=0.0002),活动期SLE 患者IL35+B 细胞表达低于稳定期SLE 与健康对照组(P=0.0019),稳定期SLE 与健康对照组比较差异无统计学意义(见图1)。
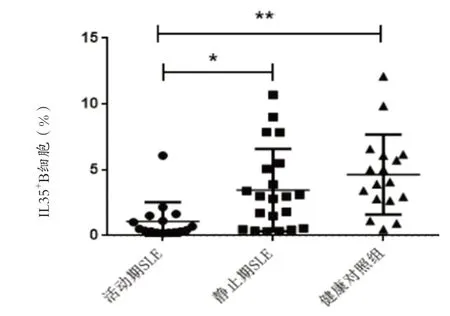
图1 三组IL35+B细胞表达比较
2.2 IL35+B 细胞表达与SLEDAI 评分及其他实验室指标的相关性 SLE 患者IL35+B 细胞的表达与SLEDAI评分呈负相关(r=-0.4663,P=0.0036),而与补体C3、C4 水 平 呈 正 相 关(r=0.5878,P=0.0001;r=0.6242,P<0.0001)。与IgG、IgA、IgM 未见相关性。见图2。
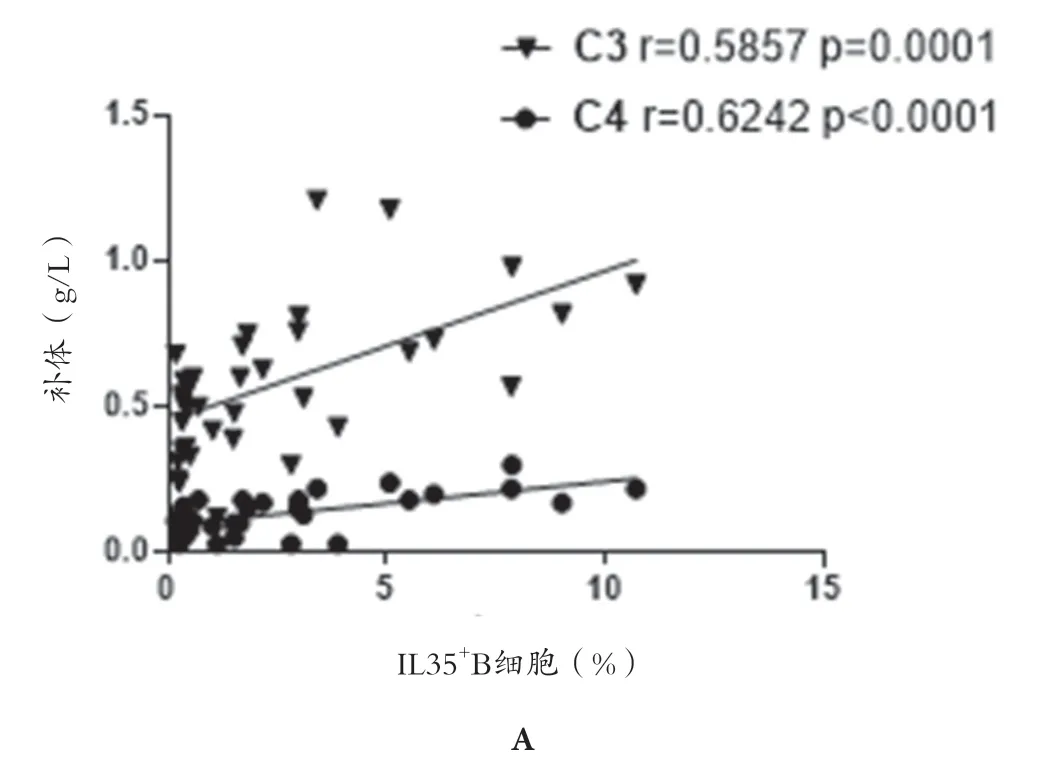
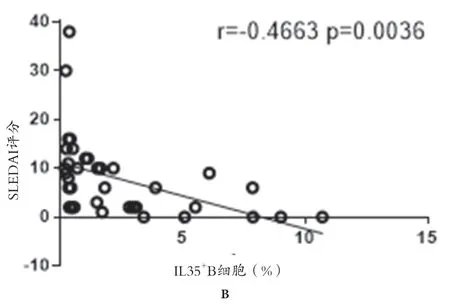
图2 spearman秩相关分析
3 讨论
IL-35 是IL-12 家族的异源二聚体细胞因子的成员。由p35 和Ebi3 两个亚基的组合形成[6]。IL-35 开始被发现仅由T 调节细胞(Treg)产生[7]。但随着研究的深入,发现IL-35 还可以由耐受性树突状细胞[8]和B 细胞产生[9-10]。研究表明,IL-35 在免疫应答中起重要的负性免疫调节作用,IL-35 表达降低与多种炎症状态有关,如炎症性肠病、肝纤维化、心肌炎、脑脊髓炎和自身免疫性疾病,且与疾病的严重程度有相关性[11]。传统认为B 细胞是SLE 发病的中心环节,这可能与B 细胞是固有免疫与适应性免疫之间的重要连接有关,一方面B 细胞作为抗原提呈细胞诱导特异性免疫,另一方面作为体液免疫的效应细胞应答抗原。B 细胞也可以通过Toll 样受体(TLR)的表达和一系列细胞因子的产生对自身或者外来抗原作出反应,而这些细胞因子可以放大或下调免疫应答[12]。但由B 细胞分泌的IL35 在SLE 中的作用尚不明确。
本研究显示,SLE 活动期组IL35+B 细胞表达明显低于稳定期组与健康对照组,而稳定期组与健康对照组差异无统计学意义。且SLE 患者IL35+B 细胞的表达与SLEDAI 评分呈负相关。SLEDAI 是临床上常用于评价SLE 活动度的综合评分系统,评分>9 分为SLE 进入活动期,并随着病情加重而评分上升。研究结果提示随着SLE 活动增强,IL35B+细胞表达下调。提示IL35+B 细胞可能参与SLE 活动期的发生发展。随着B细胞分泌的IL35 水平明显降低,机体内免疫抑制调节功能减弱,促炎反应增强导致细胞因子网络的失衡而诱发SLE[13]。而SLE 治疗有效时可以上调IL35+B 细胞的表达,并能达到健康水平。表明随着SLE 症状的缓解与稳定,机体内抑炎作用增强,促炎作用下调,并重新回到平衡状态。
本资料结果显示,SLE 患者IL35+B 细胞的表达与补体C3、C4 水平呈正相关。经典补体系统参与SLE的发病机制已经建立。SLE 时,由自身抗体和免疫复合物激活的经典补体系统可引起炎症和组织损伤,同时补体C3、C4 被消耗[14]。但作为SLE 生物标志物的C3 和C4 有几个缺点。特别是正常血浆中的C3 和C4的范围较宽,与正常血浆中的C3 和C4 重叠。此外,补体激活过程中消耗的C3 和C4 会导致合成增加,导致蛋白质水平无变化。总的C3 和C4 水平不一定反映整个补体系统激活,虽然可溶性补体分裂产物(如C3a 和C4a)的增加可能在生理上更与补体激活有关,但其在血浆中稳定性差,难以检测。因此目前尚无取代C3 和C4 作为SLE 的生物标志物。IL35+B 细胞的表达是否能作为新的指标有待后期进行大样本的研究。
综上所述,活动期SLE 患者IL35+B 细胞的表达频率明显降低,且与SLEDAI 评分呈负相关,与补体C3、C4 呈正相关。提示IL35+B 细胞在SLE 发病机制中可能具有重要作用,可能成为新的生物学指标。IL35+B 细胞对SLE 的具体调节机制有待进一步研究。
