左归降糖解郁方对糖尿病并发抑郁症胎鼠海马神经元NR及mEPSC的影响
2020-04-22向韵吴梦瑶赵洪庆刘检雷昌孟盼张秀丽凌佳王宇红
向韵 吴梦瑶 赵洪庆 刘检 雷昌 孟盼 张秀丽 凌佳 王宇红
〔摘要〕 目的 探討左归降糖解郁方对模拟糖尿病并发抑郁(diabetes mellitus with depression,DD)症状态下胎鼠海马神经元N-甲基-D-天冬氨酸受体(n-methyl-d-aspartic acid receptor,NR)和微小兴奋性突触后电流(miniature excitatory postsynaptic current,mEPSC)频率及幅度的干预作用。方法 取胎鼠(16~18 d)的海马,进行分离纯化和培养,用神经元特异性烯醇化酶(NSE)免疫细胞化学染色法鉴定。随机把海马原代神经元分6组:空白组、模型组、空白血清组、MK-801组、二甲双胍+氟西汀组、左归降糖解郁方组。根据分组,于空白组加10%的培养液;其他5组加15 mmol/L的高糖和50 ?滋mol/L的皮质酮予以造模;造模后,空白血清组、二甲双胍+氟西汀组、左归降糖解郁方组中分别加10%的空白血清、二甲双胍+氟西汀含药血清、左归降糖解郁方含药血清,MK-801组中加10 ?滋mol/L的MK-801,同时干预18 h。蛋白NR2A、NR2B的表达运用高内涵细胞成像技术(high content analysis,HCA)检测;海马神经元细胞的mEPSC采用全细胞膜片钳技术来记录,并对比不同组间神经元细胞的mEPSC频率和电流幅度。结果 经镜下观察及NSE鉴定,所培养的细胞是海马神经元细胞,阳性率在95%以上。经HCA检测,空白组细胞的胞体明显,形态完整,突触之间形成丰富的神经网络。与空白组比,模型组和空白血清组的海马神经元细胞出现萎缩、突触断裂或神经网络消失,蛋白NR2A、NR2B的荧光值增强(P<0.01);与空白血清组比,MK-801组、二甲双胍+氟西汀组、左归降糖解郁方组细胞突触间的连接恢复,蛋白NR2A、NR2B荧光值减弱(P<0.01或P<0.05)。膜片钳结果显示,对比空白组,模型组、空白血清组的mEPSC频率和幅度上升(P<0.01);与空白血清组比,MK-801组、二甲双胍+氟西汀组和左归降糖解郁方组的mEPSC频率和幅度下降(P<0.01)。结论 左归降糖解郁方抗DD大鼠海马神经元细胞受损的保护作用机制,可能在于其能够调控DD状态下的海马神经元蛋白NR2A、NR2B的表达及突触可塑性功能。
〔关键词〕 糖尿病并发抑郁症;海马神经元;突触可塑性;膜片钳;N-甲基-D-天冬氨酸受体;兴奋性突触后电流;左归降糖解郁方
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.03.006
〔Abstract〕 Objective To investigate the intervention effects of Zuogui Jiangtang Jieyu Fang on the frequency and amplitude n-methyl-d-aspartic acid receptor (NR) and miniature excitatory postsynaptic current (mEPSC) in hippocampal neurons of fetal rat under simulated diabetes mellitus complicated with depression(DD). Methods The hippocampus of fetal rats (16-18 d) was selected, isolated, purified and cultured. The cultured cells were identified by neuron-specific enolase (NSE) immunocytochemical staining. The hippocampal primary neurons were randomly divided into 6 groups of a normal group, a model group, a blank serum group, a MK-801 group, a metformin + fluoxetine group, a Zuogui Jiangtang Jieyu Fang group. According to the grouping situation, the blank group was added 10% culture medium; other five groups were added 15 mmol/L high glucose and 50 μmol/L corticosterone to establish model; After modeling, the blank serum group, the metformin + fluoxetine group and the Zuogui Jiangtang Jieyu Fang group were added 10% volume blank serum, 10% volume metformin + fluoxetine drug content serum, 10% volume Zuogui Jiangtang Jieyu Fang drug content serum, and the MK-801 group was added 10 μmol/L MK-801, intervention for 18 h. The expression of protein NR2A and NR2B were detected by high content analysis (HCA). The mEPSC of hippocampal neuronal cells was recorded using whole cell patch clamp technique, and the mEPSC frequency and current amplitude of neuronal cells in different groups were compared. Results Microscopic observation and NSE identification, the cultured cells were hippocampal neurons, and the positive rate was above 95%. HCA analysis showed that the cell bodies of the blank group were obvious, the morphology was intact, and synapses were interwoven into a rich neural network. Compared with the blank group, hippocampal neurons in the model group and the blank serum group showed atrophy, synaptic rupture or neural network disappeared, and the fluorescence intensity of protein NR2A and NR2B increased (P<0.01); Compared with the blank serum group, the synaptic connections in the MK-801 group, the metformin + fluoxetine group and the Zuogui Jiangtang Jieyu Fang group were recovered, and the fluorescence intensity of protein NR2A and NR2B decreased (P<0.01 or P<0.05). In whole cell patch clamp test, compared with the blank group, the mEPSC frequency and current amplitude of the model group and the blank serum group increased significantly (P<0.01); Compared with the blank serum group, the mEPSC frequency and current amplitude of the MK-801 group, the metformin + fluoxetine group and Zuogui Jiangtang Jieyu Fang group decreased significantly (P<0.01). Conclusion The mechanism of Zuogui Jiangtang Jieyu Fang in protecting hippocampal neurons damage of DD rats may be its regulation of protein NR2A, NR2B and synaptic plasticity in in hippocampal neurons under DD status.
〔Keywords〕 diabetes mellitus with depression; hippocampal neurons; synapse plasticity; patch clamp; n-methyl-d-aspartic acid receptor; miniature excitatory postsynaptic current; Zuogui Jiangtang Jieyu Fang
糖尿病是继心脑血管疾病和恶性肿瘤后的第三大类疾病,糖尿病并发抑郁症(diabetes mellitus with depression,DD)继发于糖尿病,并发率是非病患的3至5倍[1],且DD患者自杀率高达10%,危险程度远远高于非患者[2]。目前,我国有高达1.14亿的糖尿病患者和1.48亿的糖尿病前期患者[3]。据第52届欧洲糖尿病研究协会年会上公布的国际流行病和治疗研究数据显示,中国2型糖尿病患者抑郁症发生率为10.8%[4],居全球第四。但DD的发病机制不清,至今尚无令人满意的治疗手段。因此,研究DD的发生机制,并在此基础上开展防治具有重要的意义。
在本研究中,以高糖和皮质酮共同体外培养的DD胎鼠海马原代神经元细胞模型为研究对象[5-6],采取高内涵细胞成像分析技术(high content analysis,HCA)检测蛋白NR2A、NR2B的表达,采用全细胞膜片钳技术进行检测海马神经元细胞的微小兴奋性突触后电流(miniature excitatory postsynaptic current,mEPSC)频率及电流幅度,同时用“滋阴益气、化瘀解郁”为治法的左归降糖解郁方反证,探讨DD海马神经元细胞突触可塑性受损的特点、规律,为疾病的有效防治提供新的理论依据与治疗靶点。
1 实验材料
1.1 动物
孕16~18 d的SD雌性大鼠,SPF级,体质量350~450 g;SD雄性大鼠12只,SPF级,体质量200~220 g,均购自湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘)2016-0002,饲养于湖南中医药大学第一附属医院的动物实验中心,使用许可证号为SYXK(湘)2015-0003。
1.2 试剂
Trypsin、Ⅰ型胶原酶(美国Amresco);DMEM/F12(1∶1)、Neurobasal medium、B27 Supplement(美国Gibco);胎牛血清、双抗(Penicillin和Streptomycin,美国 Hyclone);D-glucose、CORT、L-多聚赖氨酸、TTX、PTX(美国Sigma);神经元特异性烯醇化酶(Wellbioscience公司);小鼠抗大鼠β-tubin抗体、DAPI、兔抗大鼠NR2A、兔抗大鼠NR2B(英国Abcam);R-PE标记羊抗小鼠IgG、FITC标记羊抗兔IgG(Proteintech公司)。
1.3 主要药物
左归降糖解郁方(黄芪18 g,贯叶连翘3 g,熟地黄15 g,枸杞12 g,山茱萸12 g,丹参12 g,姜黄9 g,菟丝子9 g,杜仲9 g,牛膝9 g,牡丹皮6 g),以上饮片购于湖南中医药大学的第一附属医院,由医院的制剂科制成1.14 g/mL的口服液;盐酸氟西汀胶囊(规格:20 mg/粒,批号:2087A,法国Patheon);盐酸二甲双胍片(规格:0.25 g/片,批号:1402115,湖南湘雅制药有限公司)。
1.4 主要仪器
Stemi 508体式显微镜(德国Zeiss);研究级倒置显微镜(德国Zeiss);X73倒置荧光显微镜(日本Olympus);高内涵成像分析系统(美国PerkinElmer);Axonpatch 700B膜片钳放大器(东乐自然基因公司);PC-10微电极垂直拉制仪(日本Narishige)。
1.5 主要溶液
海马神经元接种培养液:DMEM/F12∶FBS∶B27∶Glutamax∶双抗=87∶10∶1∶1∶1;海马神经元维持培养液:Neurobasal∶B27∶Glutamax∶双抗=96∶2∶1∶1;海马神经元终止培养液:DMEM/F12∶FBS∶双抗=89∶10∶1;电极记录内液:KCl 145.0 mmol/L,HEPES 10.0 mmol/L,NaCl 5.0 mmol/L,EGTA 5.0 mmol/L,MgATP 4.0 mmol/L,Na2GTP 0.3 mmol/L,pH 7.2;电生理记录外液:NaCl 144.0 mmol/L,KCl 10.0 mmol/L,Glucose 10.0 mmol/L,HEPES 10.0 mmol/L,CaCl2 2.0 mmol/L,pH 7.4。
2 方法
2.1 海馬神经元原代培养
孕16~18 d的SD大鼠,按照4 mL/kg腹腔注射10%的水合氯醛麻醉,待无翻正反射后,开腹腔取胎鼠。取胎鼠的全脑放于DMEM/F12溶液中,在解剖显微镜下分离出海马,剥去多余的脑白质及血膜。将海马剪碎,按1∶1加入0.2 %Ⅰ型胶原酶和0.25%胰蛋白酶,37 ℃消化15 min,终止消化,取上清过200目细胞筛,滤液1 000 r/min离心5 min,弃上清,细胞沉淀重悬,计数,细胞悬液以0.8×105个/mL的密度接种在24孔细胞培养板(0.1 mg/mL 的L-多聚赖氨酸溶液预先包被)中,置37 ℃细胞培养箱中,4 h后全量换成维持培养液,第7天半量更换维持培养液。
2.2 神经元化学鉴定
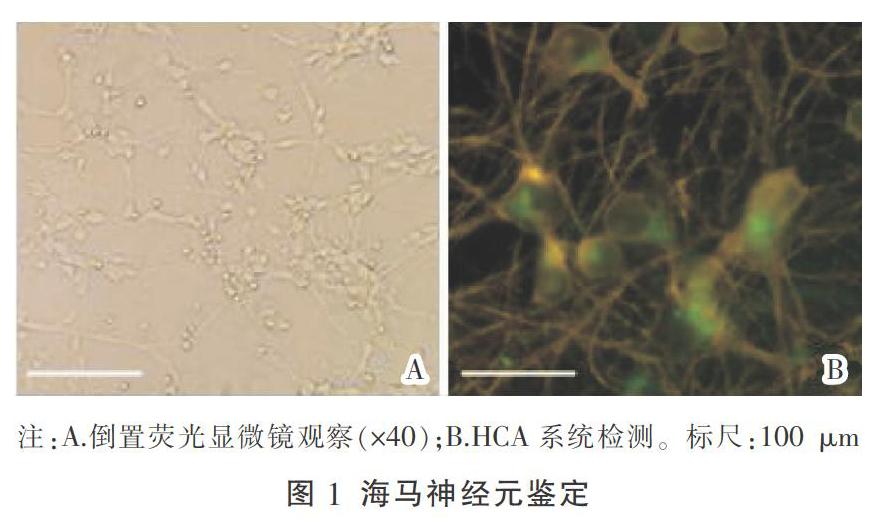
将海马神经元细胞接种到预先包被的96孔培养板中,密度为5×103个/孔,37 ℃培养7 d后,弃培养液,冷的0.01 mol/L PBS洗3次,每次5 min,分别加入4%的多聚甲醛固定30 min、0.25%的Triton X-100作用15 min、5%的BSA封闭30 min,洗3次,加NSE和β-tubin相关抗原抗体(1∶100),4 ℃湿盒孵育过夜,洗3次,加入FITC和R-PE标记的二抗(1∶200),37 ℃孵育1 h,洗3次,加入细胞核染色剂DAPI室温孵育20 min,洗3次,最后每孔加50 μL PBS,HCA观察、拍照、分析。
2.3 制备含药血清
12只SD大鼠,雄性,SPF级,体质量200~220 g,随机分成空白血清组、二甲双胍+氟西汀组、左归降糖解郁方组每组4只。空白血清组灌胃蒸馏水;二甲双胍+氟西汀组用临床等效剂量的二甲双胍(0.18 g/kg)+氟西汀(1.8 g/kg)灌胃;左归降糖解郁方组灌胃给予人临床3倍有效量的左归降糖解郁方溶液(32.82 g/kg),均连续灌胃3 d,2次/d。在最后一次给药1 h后,大鼠腹主动脉采血,静置2 h,离心(10 min,4 500 r/min),取上清液,水浴(56 ℃,30 min),过滤后-80 ℃低温保存。
2.4 分组、造模、干预
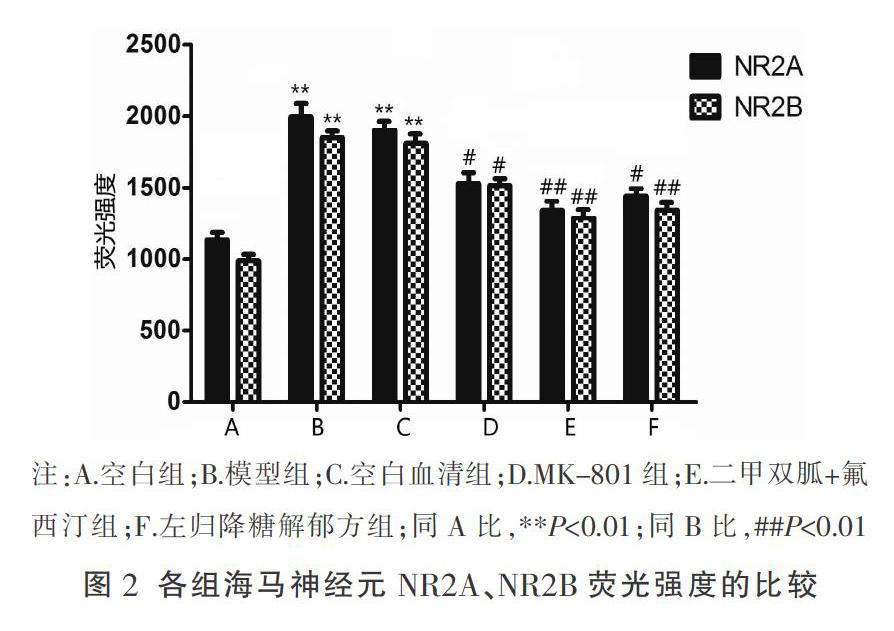
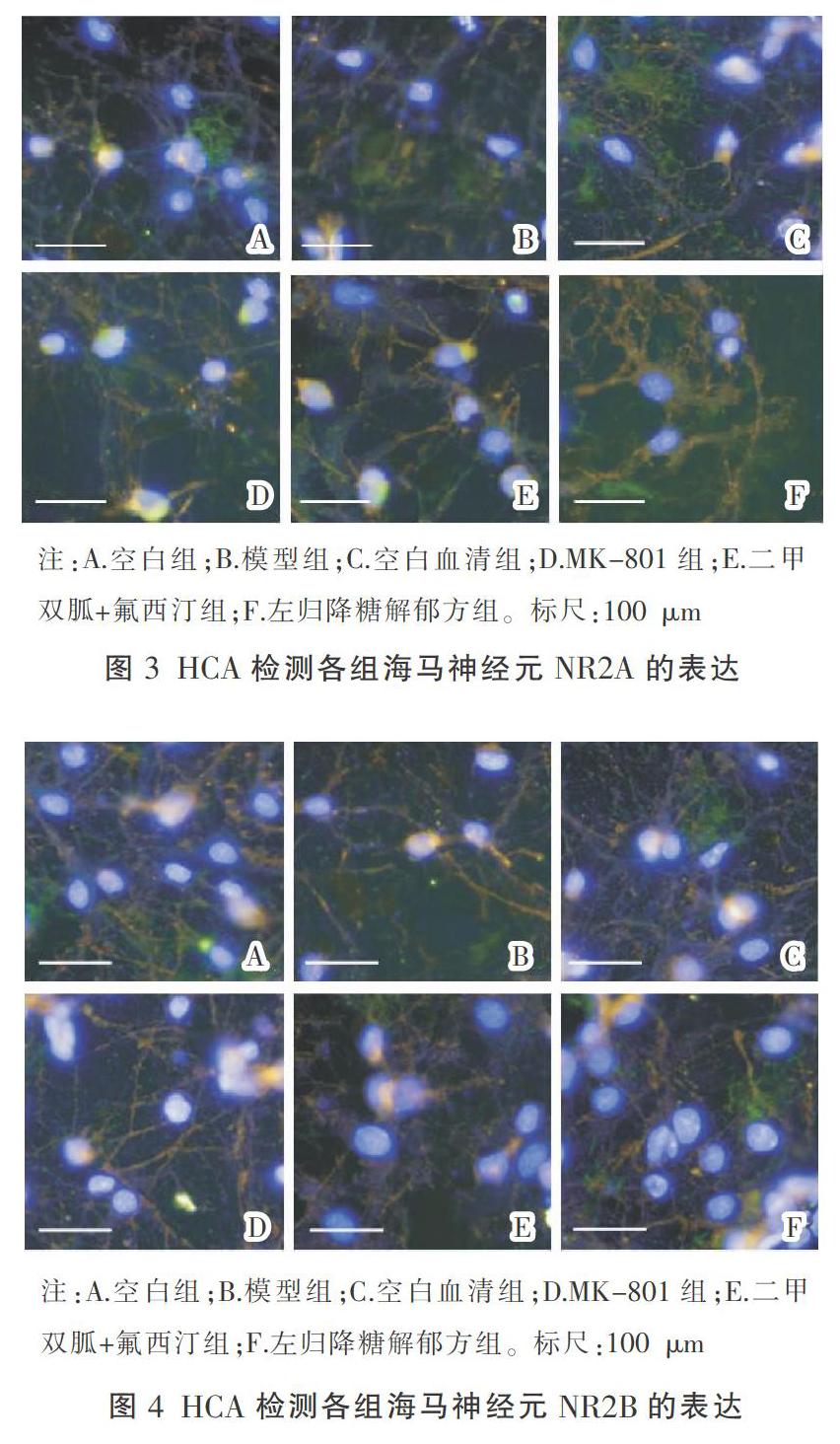
将胎鼠海马神经元原代细胞随机分组:空白组、模型组、空白血清组、MK-801组、二甲双胍+氟西汀组、左归降糖解郁方组。培养海马神经元细胞10 d后,根据分组加入高糖溶液(15 μmol/L)、皮质酮溶液(50 μmol/L)。然后,空白组加入10%的培养液,MK-801组于造模后加入10 μmol/L的NR阻断剂溶液(MK-801),空白血清组、二甲双胍+氟西汀组、左归降糖解郁方组分别加入10%的空白血清、二甲双胍+氟西汀含药血清、左归降糖解郁方含药血清,干预18 h。
2.5 指标检测
2.5.1 HCA检测蛋白NR2A、NR2B的表达 将海马神经元原代细胞培养7 d,根据分组造模18 h,采用NSE进行免疫化学染色,用HCA系统观察、拍照、分析。以荧光强度表示NR2A、NR2B蛋白的表达。
2.5.2 膜片钳电生理检测mEPSC 选择培养第11~14天的海马神经元细胞,检测前18 h细胞造模,检测时TTX工作浓度为1 μmol/L,PTX工作浓度为10 μmol/L。玻璃电极入液电阻显示3~8 MΩ为正常,钳制电位为-60 mV,GΩ封接,破膜,全细胞记录模式记录mEPSC,电极电阻大于20 MΩ、漏电流大于-200 pA 的选择不要,连续记录5 min,每组至少记录8个细胞。
2.6 统计学处理
采用Excel 2016、SPSS 17.0、Clamfit相关软件来进行数据的分析;采用“x±s”的方式表达实验数据;采用ANOVA法检验实验指标;采用LSD法两两比较方差齐,方差不齐则用Dunnett's T3法分析,P<0.05表示差异是有统计学的意义。
3 结果
3.1 海马神经元鉴定
将培养了7 d后的海马神经元置于倒置荧光显微镜下观察,其胞体饱满、突触互相交织,构成了丰富的神经网络。HCA系统检测显示NSE染色后,绿色荧光为阳性者,阳性率高达95%,则该阳性细胞为海马神经元。结果见图1。
3.2 各组NR2A、NR2B蛋白表达的荧光值比较
空白组中神经元的形态完整,突起从横交错形成神经网络。和空白组比较,模型组与空白血清组的数轴突间发生断裂,NR2A、NR2B蛋白的荧光值明显增强,差异有统计学意义(P<0.01);和空白血清组相比,MK-801组、二甲双胍+氟西汀组、左归降糖解郁方组突触网络连接恢复正常,NR2A、NR2B的荧光值呈现减弱趋势,差异具有统计学意义(P<0.01或P<0.05)。结果见图2-4。
3.3 各组海马神经元mEPSC的记录比较
同空白组比,模型组、空白血清组细胞的mEPSC频率和幅度呈上升状态(P<0.01);和空白血清组比较,MK-801组、二甲双胍+氟西汀组、左归降糖解郁方组细胞的mEPSC频率和电流幅度显著下降(P<0.01)。结果见图5-6。
4 讨论
DD的发生和下丘脑-垂体-肾上腺轴(the hypo?鄄thalamic-pituitary-adrenal axis,HPA)的亢进紧密相关,尤其是与促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)[7]、皮质醇(cortisol,COR)的释放相关[8]。海马神经元新生障碍会引发HPA轴的失调,而HPA失调是产生抑郁的主要因素[9]。在学习记忆与情绪信息的处理活动中,海马作为关键脑区参与其中。海马的突触可塑性和长时程增强(long-term potentiation,LTP)、长时程抑制(long-term depres?鄄sion,LTD)分别被认为是学习记忆的生物学基础和细胞分子机制[10]。
NR是一种谷氨酸敏感性的离子通道受体[11],海马神经元的调亡、突触重塑及5-羟色胺系统都能受到NR相关通路的调控,且与HPA轴亢进导致的海马损伤紧密相关。HPA轴激活过度后会引起COR、CRH的含量不断增高,其相关受体糖皮质激素受体的表达下调和促肾上腺皮质素释放激素受体1活化异常,进一步影响NR而导致海马受损。COR含量的增高使糖皮质激素受体的表达下调,促使转录和合成谷氨酰胺合成酶基因相对减少,谷氨酸在细胞内不断累积并向细胞外释放,使兴奋性受体NR的相关蛋白NR2A、NR2B亚单位水平和其受体通道的结合位点数量增多,引发海马的神经兴奋性毒性,导致海马损伤[12]。在突触可塑性过程中NR发挥了关键性作用,是由于其影响着突触可塑性的发动机(调节细胞内Ca2+的浓度),介导突触细胞内部分信号通路,从而影响突触传递的LTP和LTD[13]。
神经元细胞的突触自发性活动包括兴奋性的和抑制性的[14]。神经元兴奋性的突触活动:mEPSC、自发兴奋性突触后电流(spontaneous excitatory postsynaptic current,sEPSC)、自发动作电流(spontaneous action current,sAC)。由神经元突触前膜Glu的释放引起的突触后膜反应称为mEPSC,其频率的变化与突触前谷氨酸释放的频率成正比,而幅度的变化则反映同时刻突触前谷氨酸释放数目和突触后膜受体的数目、反应性的变化[15]。mEPSC不受TTX影響,但在有大量的钠通道参与的sEPSC、sAC反应中,TTX能同时阻断突触前的电压门控性钠通道(即自发动作电位)和突触后的电压门控性钠通道(sEPSC、sAC)。抑制性的活动:微小抑制性突触后电流(miniature inhibitory postsynaptic current,mIPSC)、自发抑制性突触后电流(spontaneous inhibitory postsynaptic current,sIPSC),分别和mEPSC、sEPSC发生的机制相同,但TTX可阻断sIPSC,且抑制性递质GABA可同时介导两者。故在实验中,加阻断剂PTX阻断GABA介导的IPSC反应,加阻断剂TTX阻断mEPSC。
本實验中用HCA检测,结果显示模型组中胎鼠海马神经元较多的出现萎缩和突触断裂,细胞周围碎片明显增多,和空白组相比,模型组的NR2A、NR2B荧光值增强,提示神经元受损和相关蛋白表达异常。而海马神经元的损伤程度在经左归降糖解郁方干预后有所降低,且蛋白NR2A、NR2B的荧光值表达与空白组相接近,提示左归降糖解郁方可防止海马神经元受损,其相关作用机制可能是通过调控NR的相关蛋白。在膜片钳实验中,和空白组比,模型组和空白血清组的海马神经元细胞的mEPSC频率、电流幅度都显著上升,提示在模型组中,由海马神经元突触前膜释放的Glu量增多和突触后膜相关受体反应加强;和空白血清组比较,左归降糖解郁方组的mEPSC频率、电流幅度降低,且与二甲双胍+氟西汀组的结果比较无明显差异,提示左归降糖解郁方可减少释放海马神经元突触前Glu随机量子的数目、减弱突触后受体的过度激活,且MK-801组的结果提示NR可能是导致DD海马神经元受损及参与突触可塑的关键点。
综上,左归降糖解郁方对DD模型细胞的保护机制可能在于其调控NR相关蛋白的表达和调节神经元突触可塑性的功能,后续实验我们将继续从在体水平探讨左归降糖解郁方对DD海马神经元突触可塑性的保护作用。
参考文献
[1] POUWER F. Should we screen for emotional distress in type 2 diabetes mellitus?[J]. Nature Reviews Endocrinology, 2009, 5(12):665-671.
[2] 张 娟,毕 艳,沈山梅,等.2型糖尿病患者抑郁的患病率及相关危险因素分析[J].中华内分泌代谢杂志,2011,2(10):796-799.
[3] SWEILEH W M. Analysis of global research output on diabetes dep?鄄ression and suicide[J]. Annals of General Psychiatry,2018,17(44):ID30386407. https://doi.org/10.1186/s12991-018-0214-2.
[4] European Association for the Study of Diabetes 2016 Annual Meeting[EB/OL].http://blog.sina.com.cn/s/blog_1646131150102x97h.html. 2016-09-20.
[5] 刘 检,王宇红,徐雅岚,等.改良的胎鼠海马神经元原代培养及模拟糖尿病并发抑郁环境对其的损伤作用[J].神经解剖学杂志,2016,32(4):459-465.
[6] 张秀丽,王宇红,杨 蕙,等.左归降糖解郁方对大鼠海马神经元细胞的保护作用[J].湖南中医药大学学报,2014,34(12):8-12+81.
[7] 孙韵君.CRH-CRHR1/GABA信号通路与抑郁症发病的分子机制[D].合肥:中国科学技术大学,2016.
[8] HEIM C, NEMEROFF C B. Neurobiology of posttraumatic stress disorder[J]. CNS Spectrums, 2009,14(Suppl 1):13-24.
[9] 温艳艳,邓晓明.2型糖尿病合并抑郁症的研究进展[J].中国实用医刊,2011,38(5):84-86.
[10] 段婷婷.情绪记忆的海马突触可塑性机制研究[D].合肥:中国科学技术大学,2013.
[11] KAUFMAN A M, MILNERWOOD A J, SEPERS M D, et al. Opposing roles of synaptlc and extrasynaptic NMDA receptor signaling in coculturcd striatal and cortical ncurons[J]. Journal of Neuroscience, 2012, 32(12):3992-4003.
[12] WEILAND N G, ORCHINIK M, TANAPAT P. Chronic corticosterone treatment induces parallel changes in N-methyl-d-aspartate receptor subunit messenger RNA levels and antagonist binding sites in the hippocampus[J]. Neuroscience, 1997, 78(3):653-662.
[13] 赵 江.Ca2+浓度振荡变化对突触可塑性影响的数学模型[J].数理医药学杂志,2008,21(1):1-3.
[14] ZHANG J, YANG Y, LI H, et al. Amplitude/frequency of spontaneous mEPSC correlates to the degree of long-term depression in the CA1 region of the hippocampal slice[J]. Brain Research, 2005,1050(1/2): 110-117.
[15] LONSKAYA I, PARTRIDGE J, LALCHANDANI R R, et al. Soluble ICAM-5, a product of activity dependent proteolysis, increases mEPSC frequency and dendritic expression of GluA1[J]. PLoS One, 2013, 8(7): e69136.
