正交试验法优化红掌‘阿拉巴马’叶片的组织培养体系
2020-04-22向丹,喻娜,赵静,崔帅
向 丹,喻 娜,赵 静,崔 帅
(广安职业技术学院,四川广安 638019)
红掌(Anthurium andraeanum),又名大叶花烛、安祖花、幸运花等,是天南星科花烛属的多年生常绿草本植物。红掌花朵为佛焰苞,色泽艳丽,花色多且花期长,叶柄长,叶形独特而具光泽,是观花观叶皆宜的世界名贵花卉之一。在国内,红掌已经成为极具观赏性和商业开发价值的高档切花和盆栽花卉种类[1],市场需求量大,培育技术应用价值高。
红掌传统的繁殖方式为种子繁殖和分株繁殖[2],传统方法繁殖速度慢,已经不能满足市场对红掌的需求。随着现代生物学技术的发展,植物组织培养技术具有保留亲本优良性状、繁殖速度快的优点,已在植物育种方面广泛运用,也已经成为红掌快繁的主要途径[3]。目前,国内有关红掌组培的研究报道较多,但是在许多报道中未明确红掌的品种,而不同红掌品种、不同外植体部位等需要的组织培养条件是相差很大的,从而导致红掌组培仍然存在许多问题,如不同研究中红掌的组培方法差异大,甚至存在相反的结果[4],组培方法的重现性差[5],愈伤组织诱导和不定分化是影响红掌组培快繁的主要因素。
正交试验设计是一种研究多因素多水平的试验方法,可以在多个影响因素中选出代表性强的试验组合,优化试验方案,比单纯的观察和测量更加精确和更具说服力。以红掌品种阿拉巴马的叶片为材料[6],对红掌愈伤组织诱导和不定芽分化条件的培养基种类、激素种类和浓度、活性炭浓度进行优化,旨在通过正交试验设计,寻找红掌阿拉巴马叶片组织培养过程中愈伤组织诱导和不定芽分化的最优培养基组合,以优化红掌的组培快繁技术。
1 材料与方法
1.1 试验材料
从广安市花卉市场购买红掌阿拉巴马植株,选取生长健壮植株的幼嫩叶片作为外植体,进行愈伤组织诱导试验,再选取愈伤组织开展不定芽诱导分化试验。
1.2 外植体的选取与消毒
从生长健壮的植株上剪下展叶约2 周的幼嫩叶片,用洗洁精洗净叶片表面,在流水下冲洗30min,吸水纸吸干叶片表面水分,用0.1%的HgCl2消毒5min,无菌水冲洗5 次,置于超净台盛有无菌水的无菌瓶中备用。
1.3 愈伤组织的诱导
在超净工作台内切去外植体与药液接触的伤口,用解剖刀把叶片切成1cm×1cm 大小,接种至愈伤诱导培养基内。愈伤组织诱导培养基采用L9(34)正交设计,设3 个因子、3 个水平(表1),每瓶接种3 个外植体,每个处理接种20 瓶,3 次重复。50d 后统计愈伤组织的诱导率。
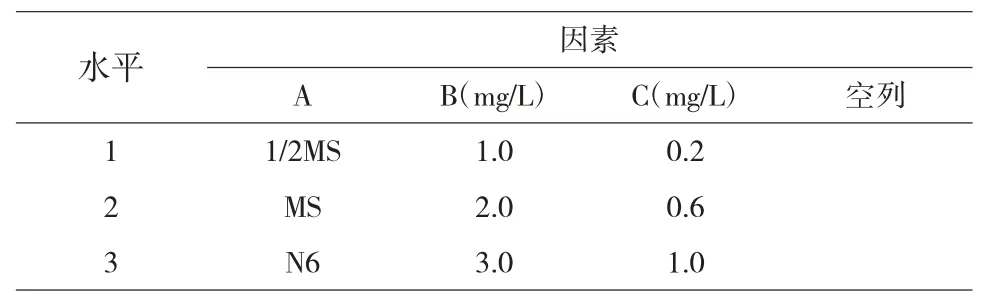
表1 愈伤组织诱导正交实验L9(34)因素和水平
1.4 不定芽的分化
待诱导出的愈伤组织生长至直径约为1.0~1.5cm时,将其切下接种至诱导不定芽分化的培养基中进行继续培养。不定芽分化培养基采用L9(34)正交设计,设3 个因子,3 个水平(表2),每瓶接种3 个不定芽,每个处理接种10 瓶,3 次重复。在继代培养60d 后,统计不定芽分化的情况。
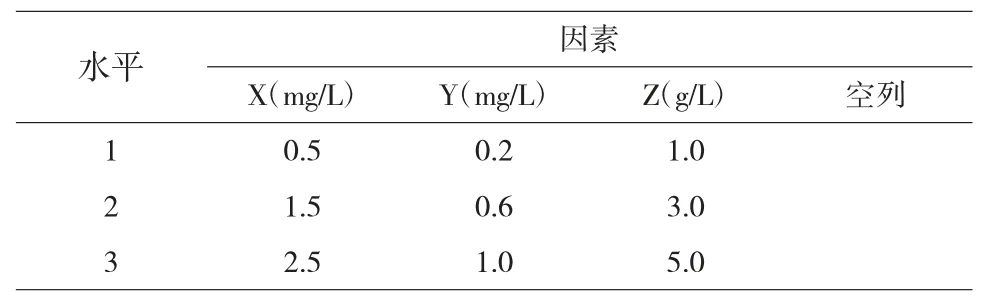
表2 不定芽分化诱导正交实验L9(34)因素和水平
1.5 培养条件
培养基pH 值为5.8,琼脂为6g/L,蔗糖为3%。不定芽分化诱导均以MS 作为基础培养基。接种后的培养瓶置于组培室内,温度为(25±2)℃,光照强度为1500Lx,光照时间为12h/d。
1.6 数据处理与分析
试验数据在Excel 软件上处理后,再用SPSS 软件进行分析。
愈伤组织诱导率(%)=诱导出的愈伤组织数目/接种的外植体数目×100;不定芽分化率(%)=分化不定芽的愈伤组织数/接种的愈伤组织总数×100。
2 结果与分析
2.1 红掌愈伤组织诱导条件的优化
2.1.1 培养基种类对红掌叶片愈伤组织诱导的影响。以1/2MS、MS 和N6 培养基对红掌叶片进行愈伤组织的诱导,结果表明,3 种培养基作用存在显著差异(p<0.05),诱导效果依次为1/2MS>MS>N6(表3、表4),由此可知,以1/2MS 作为培养基进行红掌叶片愈伤组织诱导的效果较好。
2.1.2 6-BA 对红掌叶片愈伤组织诱导的影响。6-BA浓度对红掌叶片愈伤组织诱导率的影响效果表现为2.0 mg/L>1.0mg/L>3.0mg/L(表3、表4),说明6-BA在培养基中的浓度以2.0mg/L 为佳,浓度过低不利于愈伤组织的诱导,浓度高于2.0mg/L 会使愈伤组织的诱导率下降,6-BA 对红掌叶片愈伤组织的诱导作用存在显著差异(p<0.05)。
2.1.3 2,4-D 对红掌叶片愈伤组织诱导的影响。2,4-D浓度对红掌叶片愈伤组织诱导率的影响效果表现为0.6mg/L>0.2mg/L>1.0mg/L(表3、表4),说明2,4-D在培养基中的浓度以0.6mg/L 为佳,低浓度对愈伤组织的诱导效果不明显,浓度高于0.6mg/L 会使愈伤组织的诱导率下降,2,4-D 对红掌叶片愈伤组织的诱导作用存在显著差异(p<0.05)。
由极差分析可知(表3),培养基种类、6-BA 浓度、2,4-D 浓度3 个因素的极差值大小分别为培养基>6-BA>2,4-D,表明培养种类是对愈伤组织诱导影响最大的因素,2,4-D 浓度是对愈伤组织诱导影响最小的因素,这3 个因素对愈伤组织诱导率影响的顺序依次为培养基种类>6-BA 浓度>2,4-D 浓度。而且,A因素在第1 水平的k 值大于第2、3 水平的k 值,B、C 2个因素在第2 水平对应的k 值均大于第1、3 水平的k值。由此确定愈伤组织诱导培养基的最优组合为A1B2C2,即1/2MS+2.0mg/L 6-BA+0.6mg/L 2,4-D。依据正交试验结果,配制最优组合培养基进行验证试验,红掌阿拉巴马叶片的愈伤组织诱导率为88%,说明正交试验结果较好,该培养基组合为最优愈伤组织诱导培养基。
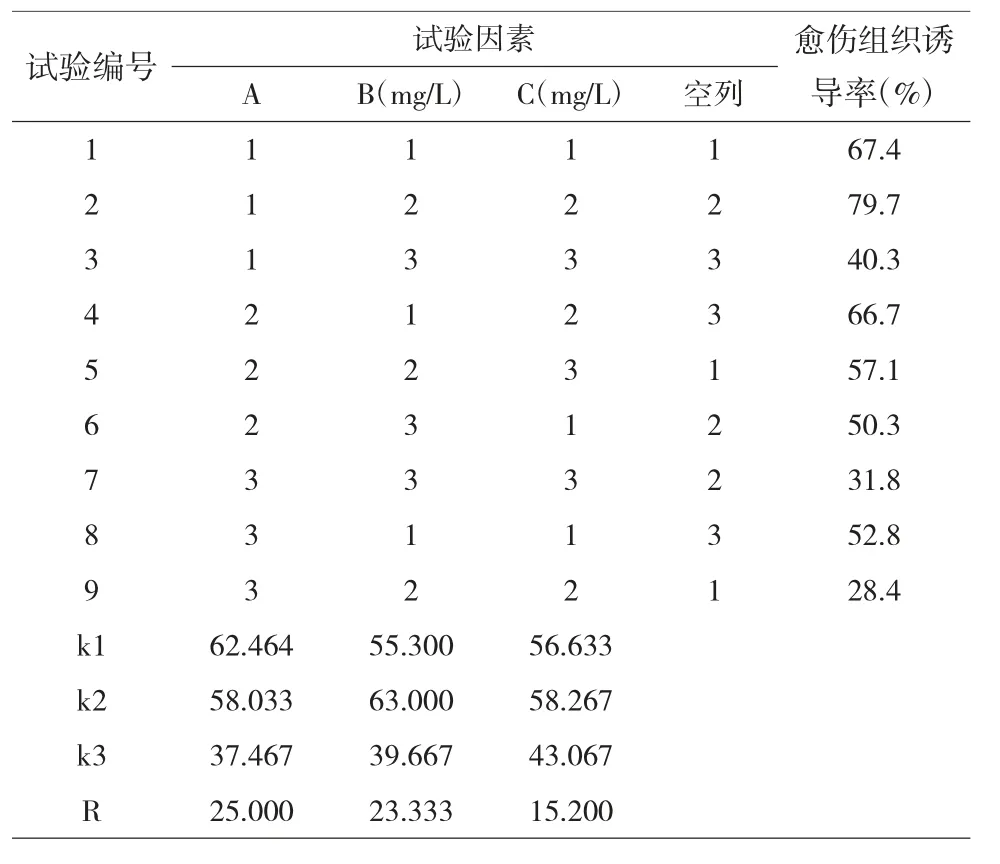
表3 愈伤组织诱导试验设计和极差分析

表4 愈伤组织诱导率方差分析
2.2 红掌不定芽分化条件的优化
2.2.1 6-BA 对红掌不定芽分化率的影响。不同用量的IBA 对红掌不定芽的诱导作用存在显著差异(p<0.05),诱导效果依次为1.5mg/L 6-BA >2.5mg/L 6-BA>0.5mg/L 6-BA(表5、表6),表明IBA 在浓度为1.5mg/L 时对不定芽的诱导效果最佳,浓度过低不利于不定芽的诱导分化,高于1.5mg/L 会降低不定芽的分化率。
2.2.2 IBA 对红掌不定芽分化率的影响。IBA 浓度对红掌不定芽诱导率的影响效果表现为0.2mg/L>1.0mg/L>0.6mg/L(表5、表6),说明IBA 在培养基中的浓度以0.2mg/L 为佳,IBA 对红掌不定芽的诱导作用存在显著差异(p<0.05)。
2.2.3 活性炭对红掌不定芽分化率的影响。活性炭浓度对红掌不定芽诱导率的影响效果表现为1.0g/L>5.0g/L>3.0g/L(表5、表6),说明活性炭在培养基中的浓度以1.0g/L 为佳,浓度升高会使不定芽的分化率下降,活性炭对红掌不定芽的诱导作用存在显著差异(p<0.05)。
由极差分析可知(表5),6-BA、IBA、活性炭3 个因素的极差值大小分别为Y>X>Z,表明IBA 是对红掌不定芽诱导影响最大的因素,活性炭浓度是对红掌不定芽诱导影响最小的因素,即这3 个因素对红掌不定芽分化率影响的顺序依次为IBA 浓度>6-BA 浓度>活性炭浓度。X 因素在第2 水平的k 值大于第1、3 水平的k 值,Y 因素在第1 水平的k 值大于第2、3 水平的k 值,Z 因素在第1 水平对应的k 值大于第2、3水平的k 值,因此,结合各因素极差大小,红掌不定芽分化诱导培养基的最优组合为Y1X2Z1,即MS+1.5mg/L 6-BA+0.2mg/L IBA+1.0g/L 活性炭。依据正交试验结果,配制最优组合培养基进行验证试验,得到红掌阿拉巴马叶片的不定芽诱导率为91%,说明正交试验结果较好,该培养基组合为最优不定芽分化诱导培养基。
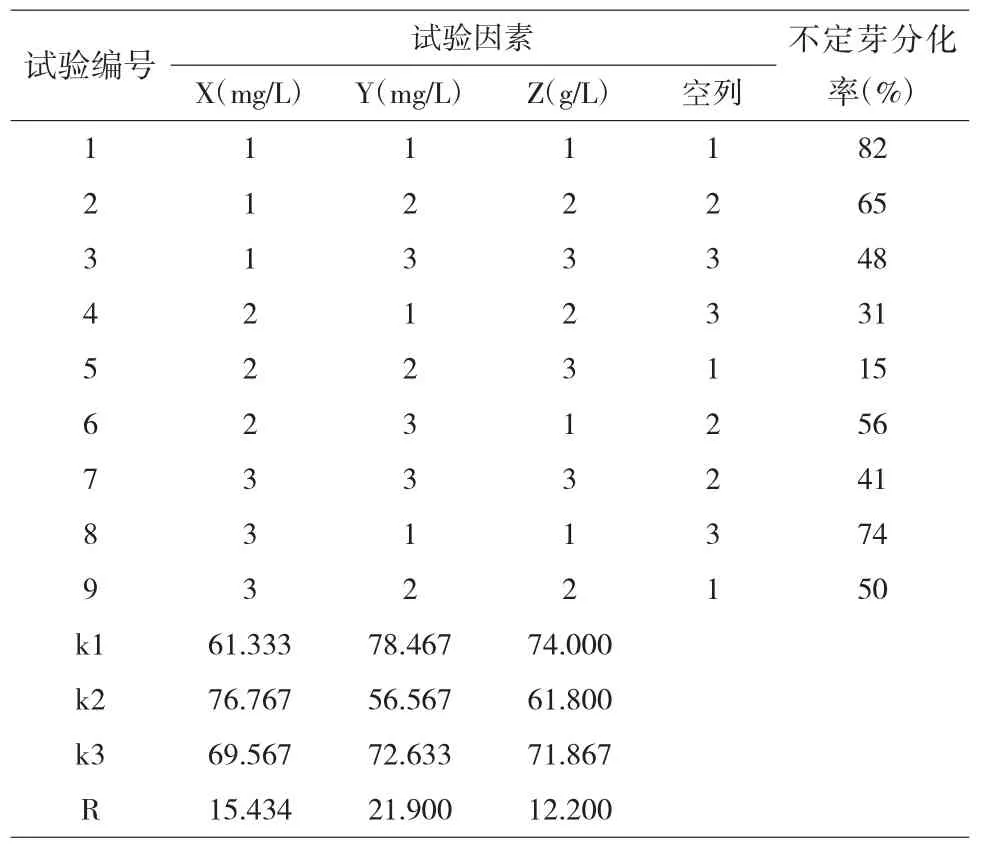
表5 不定芽分化试验设计和极差分析

表6 不定芽分化率的方差分析
3 结论与讨论
正交试验在植物组织培养的研究中已经被广泛应用[7],该试验通过正交设计探讨了不同培养基、激素和活性炭对红掌阿拉巴马叶片组织培养的作用。试验结果表明,培养基种类、激素种类和浓度对红掌愈伤组织的诱导有重要的影响,其中以培养基种类的影响最显著,说明培养基成分是影响红掌愈伤组织诱导的主要因素,这与林茂等[5]研究报道结果一致。1/2MS 基本培养基满足了红掌叶片最基本的生理活动,还需要搭配合适的植物激素以满足愈伤组织的形成和增殖。6-BA是植物组织培养过程中常用的细胞分裂素[8],2,4-D 是对愈伤组织诱导形成效果较好的生长素[9]。正交优化试验结果表明,各因素作用效果依次为培养基种类>6-BA浓度>2,4-D浓度,培养基组合为1/2MS+2.0mg/L 6-BA+0.6mg/L 2,4-D。
在愈伤组织形成之后2,4-D 对不定芽的生长有抑制作用,因此在诱导不定芽分化时选用IBA 作为生长素[10]。红掌次生代谢会产生较多酚类物质,容易引起组培过程中外植体发生褐化,影响不定芽的分化,活性炭是良好的吸附剂,可以有效抑制外植体褐化病提高不定芽的分化率。正交优化试验结果表明,影响不定芽分化因素的作用效果依次为IBA>6-BA>活性炭,培养基组合为MS+1.5mg/L 6-BA+0.6mg/L IBA+1.0g/L 活性炭。
在后续的研究中可将外植体部位也作为一个试验因素,探寻红掌阿拉巴马组培的最适外植体部位,进一步探讨各因素之间的交互作用,精确各因素用量的最佳组合,并将这种研究思路推广至其它红掌品种,为实现红掌组培快繁的标准化和大规模繁殖提供理论依据。
