通过GbF3'H基因单独沉默及其与GbCHI和GbDFR基因共沉默研究其在海岛棉中抗枯萎病功能
2020-04-22李玉霞曲延英艾海提艾合买提王慧敏黄启秀陈琴陈全家
李玉霞,曲延英,艾海提·艾合买提,王慧敏,黄启秀,陈琴,陈全家
(新疆农业大学农学院/ 新疆农业大学农业生物技术重点实验室,乌鲁木齐830052)
目前陆地棉(Gossypium hirsutum)和海岛棉(G.barbadense)是生产上主要的两大栽培种。 海岛棉在纤维长度、断裂比强度和细度等方面比陆地棉更优异,而枯萎病也是海岛棉生产中危害最为严重、造成经济损失最大的病害之一[1-2]。 棉花枯萎病菌 (Fusarium oxysporiumf.sp.vasinfectum) 是1 种尖孢镰刀菌萎蔫专化型引起土壤维管束真菌病害[3]。 其主要防治措施有种植抗病品种、选购包衣棉种、适时播种与起垄种植、轮作换茬、清除病株与控制病情、增施有机肥和药剂防治[4-6], 但至今没有能够有效防治枯萎病的杀菌剂。 研究表明,植物在抵御病原危害过程中会启动自身的防御体系,发展出基于病原的特异性免疫系统[7]。因而研究海岛棉抗枯萎病分子机制,通过棉花功能基因组学分析来解析农艺性状调控的基因网络[8-10],进而培育出抗病抗逆高产高效优质的棉花新种质,是防治枯萎病的1 种最经济有效的方法[11-12]。
在我国海岛棉的主要生产区新疆南疆,近年来枯萎病危害日益加重,对海岛棉产量和纤维品质造成了很大影响,因而近几年对于海岛棉抗枯萎病的研究逐渐增多,也取得了初步进展。 本实验室前期转录组测序和抗病表达谱数据筛选出来的类黄酮代谢途径关键基因GbF3'H、GbCHI和GbDFR与抗病性有关。 研究表明, 类黄酮3'- 羟化酶(Flavonoid 3'-hydroxylase,F3'H)是细胞色素 P450 酶家族(Cytochrome P450,CYP450)的单加氧酶,在植物次生代谢和逆境调控方面起重要作用,它催化柚皮素和二氢山奈素的B 环3'位置羟基化,从而与柚皮素和二氢山奈素氧化形成的一系列类黄酮途径中重要中间产物的结构稳定性和抗氧化功能密切相关[13-14]。 前人的研究证实GbCHI基因是花色素苷合成途径早期的关键酶之一,其表达效率直接影响植物花和果实的色泽和质量[15-16]。 调控CHI基因的表达对于类黄酮合成有一定的影响[17],诱导CHI基因表达能增加类黄酮的含量,相反抑制CHI基因的表达则会降低类黄酮含量,这在矮牵牛[18]、银杏(Ginkgo bilobaL.)[19]和甘草(Glycyrrhiza uralensisFisch)[20]等植物中均得到证明。 二氢黄酮醇-4-还原酶(DFR)是植物花青素合成途径中的关键酶,它在不同植株间具有高度的同源性[21]。有研究表明,DFR 功能的缺失会使植物的组织或器官的颜色变浅或者呈现无色。 所以,应用植物基因工程来改变植物组织或器官的颜色大多围绕DFR 开展工作[22-25]。 根据植物中的类黄酮代谢途径[26],GbF3'H、GbCHI和GbDFR这 3 种基因之间的关系是:(1)GbCHI基因为GbDFR和GbF3'H的上游调控基因;(2) 同时GbCHI基因通过调控GbF3'H基因进而调控GbDFR基因;(3)GbF3'H基因也调控GbDFR基因。
由于 F3'H 催化生成的圣草酚(Eriodictyol)和二氢栎皮黄酮(Dihydroquercetin)是花青素和原花青素生物合成的重要中间产物,目前对F3'H基因的研究主要集中在花青素代谢支路, 包括F3'H基因的表达量与植物不同器官颜色的相关性和F3'H基因对花色的修饰、对环境的应答、对逆境的抵抗等[27-31],而对海岛棉F3'H基因抗枯萎病性的研究尚且很少。 因此,本研究利用烟草脆裂病毒(Tobacco rattle virus,TRV)载体构建病毒诱导的基因沉默 (Virus-induced gene silencing,VIGS)体系,在海岛棉中有效沉默GbF3'H基因,并利用TRV 载体可以在同一棉株上对多个靶基因序列进行同时沉默的特性[32],在同一株海岛棉中同时沉默GbF3'H、GbCHI和GbDFR基因,研究GbF3'H基因单独沉默, 以及GbF3'H、GbCHI和GbDFR这3 种基因共沉默对海岛棉抗枯萎病性的影响,为后续研究海岛棉基因的抗枯萎病功能、创制新的海岛棉抗枯萎病种质资源和进行海岛棉功能基因组学研究奠定基础。
1 材料与方法
1.1 供试材料
海岛棉抗病材料06-146,由新疆农业大学作物遗传育种实验室保存。 病毒载体(pTRV1、pTRV2)及白化阳性对照载体(pTRV2-CLA1),由南京农业大学郭旺珍教授赠予。 农杆菌菌种(GV3101)和枯萎病菌(生理小种 7 号),由本实验室保存。 DNA 琼脂糖回收试剂盒、质粒小提试剂盒、多糖多酚植物总RNA 提取试剂盒是购自天根 (Tiangen) 生化科技有限公司。 pEASY-T1 Cloning Kit、TransStart Tip Green qPCR SuperMix购自北京全式金生物技术有限公司,逆转录试剂盒 (RevertAid First strand cDNA Synthesis kit)、XbaⅠ酶、KpnⅠ酶、T4DNA 连接酶购于 Thermofish 公司,硫酸卡那霉素(Kanamycin)、庆大霉素硫酸盐(Gentamycin sulfate)、吗啉乙磺酸(2- (N-morpholino) ethane sulfonic acid,MES)、MgCl2、乙酰丁香酮(Acetosyringone)购自国内生物公司。
Luria-Bertani(LB)培养基固体 / 液体:酵母提取物5 g (英国OXOID 公司), 胰蛋白胨10 g(英国 OXOID 公司),氯化钠 10 g,琼脂粉(固体)15 g,用蒸馏水定容至1 L。
马铃薯葡萄糖琼脂 (Potato dextrose agar,PDA)培养基固体 / 液体:马铃薯 200 g,葡萄糖20 g,琼脂粉(固体)20 g,用蒸馏水定容至1 L。
1.2 VIGS目的片段的获得及载体构建
以本实验室前期的转录组数据和荧光定量筛选为基础[26],利用转录组测序拼接得到的Unigene 序列,结合NCBI 数据库中Blast 搜索结果,获得类黄酮代谢途径关键基因的编码区,提取经枯萎病菌处理后的海岛棉06-146 下胚轴的RNA,逆转录成cDNA 为模板,通过聚合酶链式反应(Polymerase chain reaction,PCR)克隆海岛棉类黄酮代谢途径关键基因GbF3'H的开放阅读框(Open reading frame,ORF)序列,进行琼脂糖凝胶纯化回收, 回收产物用于转化大肠杆菌,用测序正确的GbF3'H基因大肠杆菌菌液提取质粒,用于扩增构建VIGS 载体所需的片段。从海岛棉GbF3'H基因的保守区域中选取带特异位点的395 bp 核苷酸序列设计引物,并在引物的5'端分别加入限制性内切酶XbaⅠ和KpnⅠ的酶切位点和保护碱基(表1),扩增海岛棉GbF3'H基因ORF 上位于27~421 bp 的片段, 目标扩增片段长度为395 bp,送北京六合华大基因科技有限公司测序正确后,提取质粒,用XbaⅠ和KpnⅠ双酶切,酶切产物进行琼脂糖电泳胶回收。 同时,用XbaⅠ和KpnⅠ双酶切VIGS 病毒载体pTRV2质粒,并进行胶回收。 上述双酶切后的目的片段与载体使用T4DNA 连接酶进行连接, 连接产物转化至大肠杆菌中,通过菌液PCR 筛选阳性克隆,提取质粒,经酶切验证获得重组质粒pTRV2-GbF3'H,将提取的质粒转入农杆菌,扩大培养农杆菌菌液用于后续试验。
1.3 棉花种植与培养
挑选饱满脱绒种子,75%(体积分数)酒精消毒后,30%(体积分数)过氧化氢浸泡4~5 h,无菌水冲洗多次后浸泡30 h,将露白的种子播种于土壤中(黑土与蛭石体积比1∶1),置于人工气候室培养(23 ℃恒温,16 h 光照 /8 h 黑暗)。 每隔 5~6 d 浇一次水, 待棉苗2 片子叶平展开而真叶尚未伸出时,即可用于VIGS 操作。
1.4 农杆菌介导的VIGS方法
在100 mL LB 液体培养基中加入50 mg·L-1卡那霉素、50 mg·L-1庆大霉素、10 mmol·L-1MES、20 μmol·L-1乙酰丁香酮,然后接入 1%(体积分数)携带有目的片段的沉默载体菌液,28 ℃、220 r·min-1培养至OD600为 1.2~1.5。 离心收集菌体细胞悬浮于 VIGS 重悬液中(10 mmol·L-1MgCl2,10 mmol·L-1MES,200 μmol·L-1乙酰丁香酮), 调节侵染液最终浓度至OD600为1.5 左右,黑暗中静置3~4 h。
设置以下处理:阴性对照(TRV::00)、阳性对照(白化表型)、GbF3'H基因单独沉默处理(记为“F3'H”)和 3 种基因(GbF3'H、GbCHI、GbDFR)共沉默处理(记为“共沉默”)。 前3 个处理方法是将pTRV1分 别 与 pTRV2、pTRV2-CLA1 、TRV2-GbF3'H 的农杆菌重悬液以1∶1 比例混合后注射棉花子叶;3 种基因共沉默处理方法是将pTRV1与 pTRV2-GbF3'H、pTRV2-GbCHI、pTRV2-GbDFR按3∶1∶1∶1 混合后注射棉花子叶。
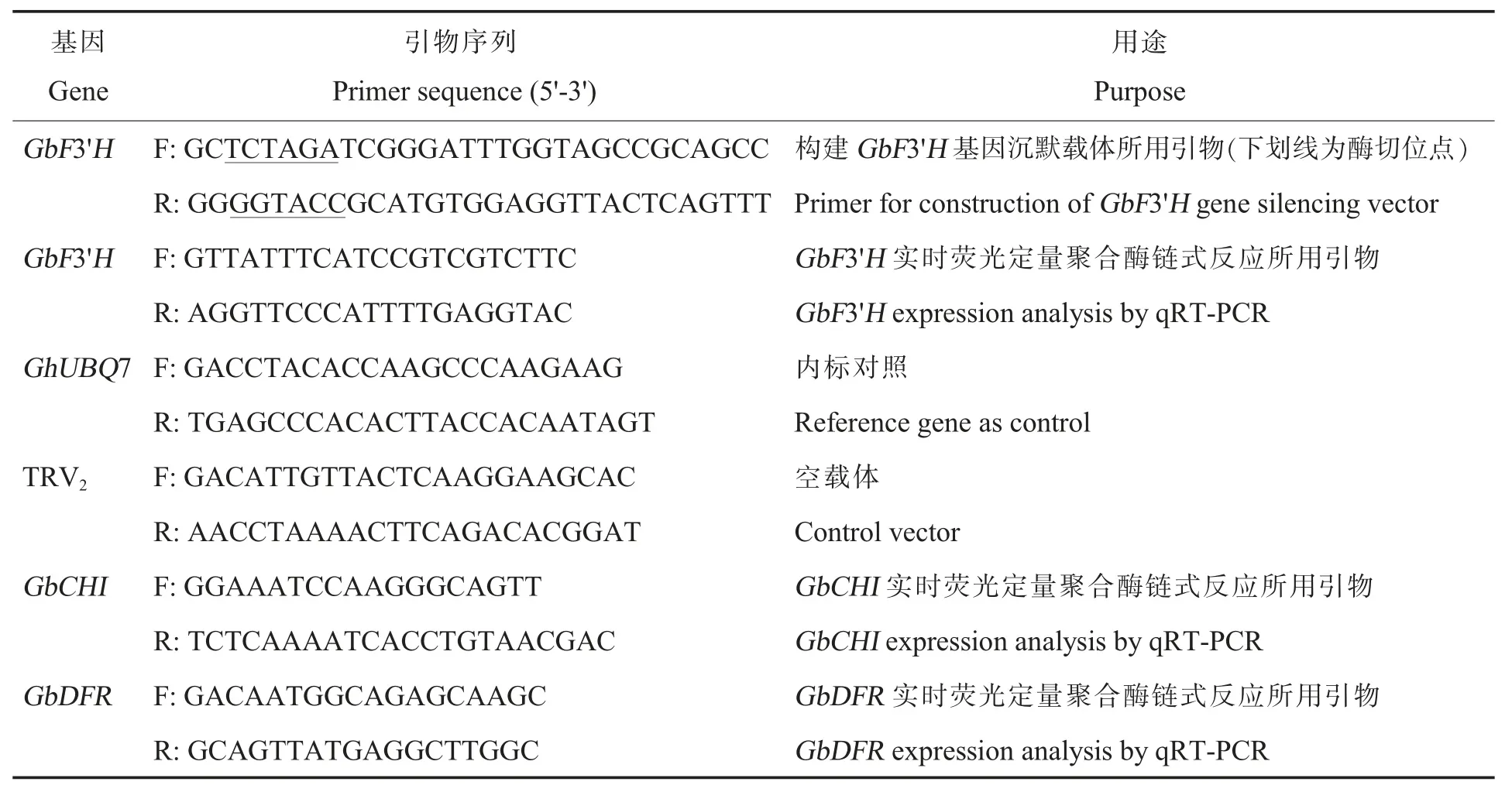
表1 本研究所用引物Table 1 Primers used in this study
接种操作:每个处理50 株,3 个重复,采用注射器针头刺破法,造成微创伤口,刺破不刺穿子叶背面, 用无针头的注射器从伤口打入侵染液,暗处理1 d 后,置于上述人工气候室培养。
1.5 沉默效率的检测
棉株注射病毒15 d 后,观察pTRV2-CLA1 幼苗真叶的颜色变化, 并分别采取空载体对照组、单基因沉默组、共沉默组棉株的根、茎和叶,每组3 株组成混池。 混池分别提取总RNA,逆转录合成 cDNA。 利用美国 ABI 公司 7500 Fast System荧光定量PCR 仪,以棉花GhUBQ7 为内参基因,通过实时荧光定量qRT-PCR 检测沉默后目的基因的表达,所用引物见表 1。用 2-△△CT法计算各基因的相对表达水平。
1.6 棉花枯萎病菌生理小种7号接种及抗性鉴定
枯萎病菌菌株接种于PDA 固体培养基表面,23~25 ℃培养 2 周, 转移至液体培养基以60 r·min-1振荡培养 7~9 d,4 层纱布过滤,调节至孢子含量2×107mL-1,现配现用。
在侵染野生型(Wild type,WT)、空载体对照组(TRV::00)、GbF3'H单基因沉默组和 3 种基因共沉默组15 d 后, 进行枯萎病菌接菌处理,25 d后观察并统计发病情况, 每个处理50 株,3 个重复,每株选取3~4 片叶,每个处理共选取500 片叶。 采用0~4 级方法统计病情指数[33]。
1.7 统计分析
用IBM SPSS Statistics 21 软件进行统计分析。
2 结果与分析
2.1 海岛棉GbF3'H基因用于VIGS目的片段的克隆及沉默载体构建
提取经枯萎病菌处理后的海岛棉06-146 下胚轴的RNA,逆转录成cDNA 为模板,扩增获得构建VIGS 载体所用的GbF3'H基因395 bp 的目的片段(图1 A)。 沉默载体构建好后,提取质粒,用XbaI 和KpnI 双酶切进行验证。 酶切片段大小与克隆片段一致, 证明pTRV2-GbF3'H 载体构建成功(图1 B)。 将正确的 pTRV2-GbF3'H 重组质粒转化入农杆菌GV3101 中, 用TRV2通用引物进行菌液PCR 检测,以及用TRV2通用引物对空载体进行菌液PCR 检测(图1 C),正确的阳性克隆用于后续的侵染, 测序证明重组载体pTRV2-GbF3'H 构建正确(图1 D)。
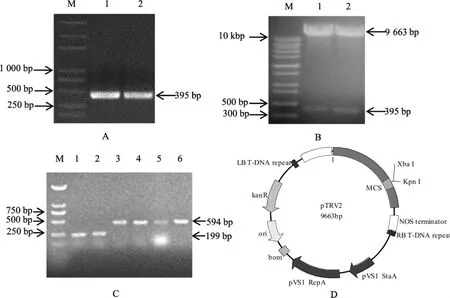
图1 GbF3'H 基因沉默序列的克隆及VIGS 载体构建Fig.1 Cloning of GbF3'H gene silencing sequence and construction of VIGS vector
2.2 棉花TRV-VIGS体系的建立
注射TRV::00 的棉花叶片未呈现白化,表型与野生型无异。 而注射pTRV2-CLA1(阳性对照)的植株,棉花中叶绿素合成相关基因GhCLA1 表达被沉默,棉花的叶绿素合成受到干扰,新出现的真叶表现为叶脉及边缘白化,逐渐扩散到整个叶片,从第2 片真叶起,表型明显,嫩叶的白化比老叶更明显,新生叶几乎完全白化(图2 A),而且基因沉默后海岛棉植株的叶片变小, 株型紧凑,子叶以上的茎变为白色。 统计表明, 注射pTRV2-CLA1 的 96 株海岛棉全部白化。 沉默GbF3'H基因的 150 株海岛棉, 及GbF3'H、GbDFR和GbCHI基因共沉默的150 株海岛棉,都比野生型海岛棉的株型紧凑,叶片变小(图2 B)。表明本研究所用的VIGS 技术体系对目的基因沉默效果显著。
2.3 目的基因的沉默效率

图2 利用VIGS 沉默目的基因后的海岛棉植株表型Fig.2 Phenotype of G.barbadense plants after silencing the target genes using VIGS
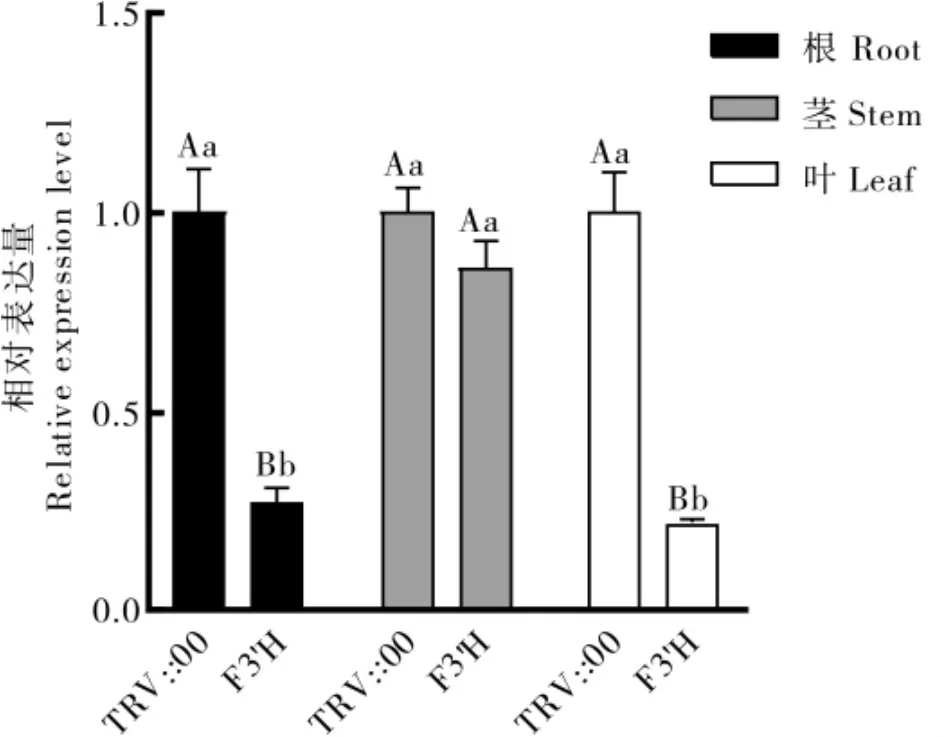
图3 GbF3'H 基因沉默后其在海岛棉根、茎和叶中的表达量Fig.3 Expression of the GbF3'H gene in roots, stems and leaves of G.barbadense after VIGS
注射 TRV::F3'H 载体后,GbF3'H基因在海岛棉根、茎和叶中都有沉默表现, 沉默效果是叶>根>茎,其中在根和叶中与TRV::00 处理比较, 差异达到极显著水平, 而在茎中与TRV::00处理比较没有显著性差异 (图3)。 TRV::F3'H、TRV::CHI 和 TRV::DFR 共侵染的海岛棉中GbF3'H、GbCHI和GbDFR基因在根、茎和叶中的表达量均比 TRV::00 处理低。 其中:GbF3'H基因在海岛棉中的沉默效果是叶>根>茎, 且在根、茎和叶中的表达量与TRV::00 处理比较,均差异达到极显著水平;GbCHI基因在海岛棉中的沉默效果是叶>茎>根, 且在叶中的表达量与TRV::00 处理比较,差异达到显著水平,在根和茎中与TRV::00 处理比较, 没有显著性差异;GbDFR基因在海岛棉中的沉默效果是叶>根>茎,且在茎和叶中的表达量与TRV::00 处理比较,分别达到差异极显著水平和显著水平, 在根中与TRV::00 处理没有显著性差异(图4)。 单独沉默处理和3 种基因共沉默处理的GbF3'H基因在海岛棉根、茎和叶的表达趋势一致。
2.4 沉默基因棉株对枯萎病抗性鉴定结果分析
抗病性鉴定结果(图5)显示,接种枯萎病菌后25 d 时, 不同处理病情指数大小分别为WT(15.75)<TRV::00(15.9)<F3'H(29.5)<共沉默(39.9), 即注射基因沉默的棉苗发病比空载体对照棉苗严重,3 种基因共沉默处理比单独沉默GbF3'H基因处理病情更严重,病情指数更高。 说明这3 种基因对提高海岛棉总体抗性的作用要大于GbF3'H单个基因。

图4 共沉默后GbF3'H、GbCHI 和GbDFR 基因在海岛棉根、茎和叶中的表达量Fig.4 Expression of the GbF3'H, GbCHI and GbDFR genes in roots, stems and leaves of G.barbadense after co-silencing
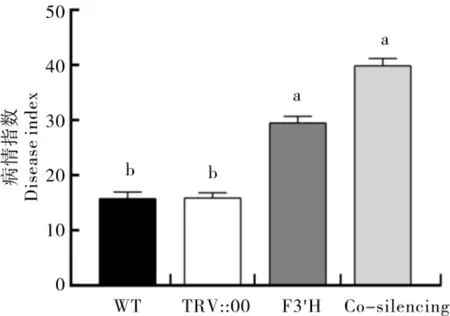
图5 海岛棉基因沉默植株接种枯萎病菌后25 d 时的病情指数分析Fig.5 Analysis of disease index at 25th day after inoculation with Fusarium wilt for the gene silencing G.barbadense plants
3 讨论
海岛棉中GbF3'H基因属于P450 家族。P450家族是超基因家族,按功能主要分为参与生物合成和生物解毒两大类[34]。GbF3'H基因不仅是类黄酮代谢途径中的关键基因,还在花色和果实的着色,以及逆境调控方面起重要作用。 关于类黄酮代谢途径相关基因与植物抗病性的关系前人也做过研究,但主要集中在陆地棉中。 目前关于海岛棉GbF3'H基因应对非生物胁迫的研究取得一定进展,但是其作用机制研究还比较少。
本试验在前期转录组测序的基础上分析出类黄酮代谢途径与海岛棉抗病有关,对类黄酮代谢途径相关基因进行克隆,并利用病毒介导的基因沉默方法,沉默所研究的基因。 本研究和前人利用VIGS 方法研究基因功能的不同点是: 本研究在同一株海岛棉中同时沉默GbF3'H、GbCHI和GbDFR这3 种基因,将基因沉默所需的时间、人力和物力最小化, 对功能基因组研究非常有利[32]。 对沉默基因棉株进行枯萎病菌接菌处理,病情指数大小分别为 WT (15.75)<TRV::00(15.9)<F3'H(29.5)<共沉默(39.9),即基因沉默的棉苗发病比空载体对照棉苗严重,3 种基因共沉默处理比单独沉默GbF3'H基因处理病情更严重。 说明这3 种基因对提高海岛棉总体抗性的作用要大于单基因GbF3'H。 本研究进一步证实类黄酮代谢途径对海岛棉抵抗枯萎病起积极作用。但抗病基因在棉花中是如何调控棉花激活免疫反应提高抗病性还有待深入研究。
目前,海岛棉中存在大量尚未发现的抗病相关基因。VIGS 可用于瞬时下调基因表达,用于确定基因对特定表型的影响。 这对于候选基因确定和选择具有控制病害潜力的基因尤其有用[35]。随着VIGS 病毒载体的不断开发,VIGS 体系已经应用于不同植物,尤其是用常规方法难以进行基因功能研究的,例如樱桃果实品质基因功能的研究[36]。因此,利用VIGS 方法,挖掘棉花中抗旱、耐盐、改良纤维品质、抗病相关等特异功能基因显得尤为重要。
4 结论
利用VIGS 技术, 初步确定GbF3'H基因与海岛棉对枯萎病的抗性有关, 且可与GbCHI、GbDFR基因协同作用增强抗病性, 可为今后海岛棉功能基因组学研究提供参考。
