黄地安消胶囊对糖尿病认知功能障碍大鼠神经保护作用及机制研究
2020-04-21宣玮婷高华武方朝晖
宣玮婷,蔡 标,叶 婷,高华武,方朝晖,叶 树,3,王 艳,汪 瀚
(1.安徽中医药大学中西医结合学院,安徽 合肥 230012;2.安徽中医药大学第一附属医院,安徽 合肥 230031;3.安徽省中医药科学院中西医结合研究所,安徽 合肥 230012;4.安徽省中药复方重点实验室,安徽 合肥 230012)
糖尿病认知功能障碍(diabetic cognitive dysfunction,DCD)是2型糖尿病(type 2 diabetes melllitus,T2DM)一种严重的并发症,慢性高血糖和高脂血症是引起DCD的主要诱因[1-3]。慢性高血糖可触发神经损伤和内皮功能障碍,导致认知功能障碍的发生[4-7]。慢性高血糖症可促进β-淀粉样蛋白(β-amyloid,Aβ)沉积,增加神经细胞的敏感性,从而对脑微血管内皮细胞产生Aβ神经毒性[8]。Aβ沉积是痴呆发生发展的关键,也是导致其他病理改变的起始环节[9]。因此,改善高血糖及清除Aβ沉积,能有效治疗糖尿病引起的认知功能障碍。此外,高血糖刺激会加重内质网应激,促进细胞凋亡,进一步加重T2DM患者神经细胞损伤,使突触结构和功能受损,进而影响学习记忆能力[10-11]。
黄地安消胶囊由黄连、生地黄、麦冬、葛根、枇杷叶、三七组成,具有清热解毒、益气养阴、活血通络之效,同时具有降低血糖、血脂和脑保护作用[12]。然而,黄地安消胶囊治疗DCD的作用机制还不明确。本实验采用腹腔注射链脲佐菌素(streptozocin,STZ)联合双侧海马注射Aβ25-35建立DCD大鼠模型[13],期间给予不同剂量黄地安消胶囊,观察黄地安消胶囊对DCD海马神经细胞的影响,以凋亡信号Bax/Bcl-2为靶点探究其机制,为临床治疗DCD提供新方法。
1 材料
1.1 实验动物 健康SPF级9周龄雄性SD大鼠70只,体质量为220~250 g,购自浙江省实验动物中心[生产许可证号为SCXK(浙)2014-0001],实验前适应性喂养7 d。本实验获得安徽中医药大学实验动物伦理委员会的批准。
1.2 实验药物 黄地安消胶囊(批号20150921):由安徽中医药大学第一附属医院提供;多奈哌齐(批号1604044):卫材(中国)药业有限公司;二甲双胍(批号AAZ5285):美国Merck Serono公司。
1.3 试剂与仪器 Aβ25-35、STZ:美国Sigma公司;Bcl-2、Bax兔抗大鼠抗体:Bioworld公司;Trizol试剂:美国Ambion公司;cDNA逆转录试剂盒:美国Thermo scientific公司;SYBR染料:日本TOYOBO公司;脑立体定位仪:美国Stoelting公司;RM2016病理切片机:上海徕卡仪器有限公司;GA3型血糖仪及试纸:中国三诺生物传感股份有限公司;042B R12088电泳仪:美国Bio-Rad公司;K3型酶标仪:美国Thermo Fisher Scientific公司;FCM凝胶成像仪:美国 Protein Simple公司;7500 Real-time PCR仪:美国Applied Biosystems公司;Eclipse E100光学显微镜:日本尼康公司。
2 方法
2.1 动物分组 将大鼠随机分为7组:正常组、模型组、黄地安消高剂量组(12 g/kg,相当于临床等效量8倍)、黄地安消中剂量组(6 g/kg,相当于临床等效量4倍)、黄地安消低剂量组(3 g/kg,相当于临床等效量2倍)、二甲双胍组(540 mg/kg,相当于临床等效量3倍)、多奈哌齐组(1.4 mg/kg,相当于临床等效量3倍),每组10只。
2.2 大鼠模型复制[13]除正常组外,其余6组大鼠予高脂饲料(饲料配方:70%常规饲料,10%猪油,5%蛋黄粉,0.5%胆固醇,10%蔗糖)喂养,喂养周期为4周。各组大鼠于第4周末进行模型复制,在模型复制前1天17:00开始禁食不禁水,第2天9:00一次性腹腔注射STZ溶液(35 mg/kg),STZ腹腔注射后72 h即检测空腹血糖,高于11.1 mmol/L进入下一步实验。经10%水合氯醛(380 mg/kg)腹腔注射麻醉后,将大鼠固定在脑立体定位仪上,用微量注射泵分别将10 μL(5 μg)Aβ25-35缓慢注入双侧海马(以前囟为原点,向后4.4 mm、旁开2.2 mm为穿刺点,自脑表面进针3.0 mm)。以学习记忆减退、神经细胞出现损伤及海马CA1区Aβ沉积增多为模型复制成功的标志。各组注射Aβ25-35前1周开始灌胃给予相应药物,连续28 d。正常组给予基础饲料喂养,不予任何处理。
2.3 Morris水迷宫法检测大鼠逃避潜伏期 给药第23天开始进行训练,前4天常规训练,每日1次,分别从水迷宫的4个象限将大鼠背对隐藏在水面下的平台放入水中,记录大鼠90 s寻找到水下平台所需时间,为逃避潜伏期。若大鼠找不到平台,将其引至平台,记录逃避潜伏期为90 s。第5天,测试大鼠从第3象限找到平台的时间,为最终数据。数据的采集和处理由Morris水迷宫图像自动监视处理系统完成。
2.4 检测空腹血糖变化 分别于模型复制前、模型复制后及给药后,各组大鼠尾静脉无菌操作后用采血针取血,用血糖仪测定各组大鼠禁食12 h的空腹血糖。
2.5 苏木精-伊红(hematoxylin-eosin,HE)染色检测海马神经细胞损伤情况 将固定的脑组织包埋,切片厚度为5 μm,行常规HE染色,光学显微镜下观察大鼠海马CA1区神经细胞损伤情况并拍照。
2.6 免疫荧光法检测大鼠海马中Aβ沉积 “2.3”“2.4”“2.5”实验结果表明,黄地安消中剂量组具有最好的药效,故进行机制探讨时选择黄地安消中剂量组进行后续的实验。PBS冲洗3次,每次5 min;加入BSA孵育30 min;加入Aβ抗体孵育24 h;洗涤后,加入二抗孵育50 min;PBS洗涤后,加入DAPI孵育50 min;冲洗并盖上抗荧光淬灭剂封片;采用荧光显微镜采集图像,用IPP 6.0软件进行计算。
2.7 Western blot法检测海马组织中Bcl-2、Bax蛋白表达水平 经提取海马组织总蛋白,分离总蛋白,转膜,封闭,加入一抗Bcl-2、Bax,加入二抗IgG,加入ECL试剂,曝光并拍照,凝胶图像处理系统分析灰度值。β-actin作为内参。实验重复3次。
2.8 荧光定量PCR法检测海马组织中Bcl-2、Bax mRNA的含量 采用Trizol法提取海马总mRNA,用逆转录试剂盒逆转录成cDNA。采用7500 Real-time PCR仪检测,反应条件包括逆转录反应和逆转录酶失活反应,每个样本重复3个孔。本研究所用的引物序列:
Bax:上游5′- CCAGGACGCATCCACCAAG AAG-3′,下游5′- GCTGCCACACGGAAGAAGAC C-3′;
Bcl-2:上游5′-ACGGTGGTGGAGGAACTCT TCAG-3′,下游5′-GTGCAGATGCCGGTTCAG GTAC-3′;
β-actin:上游5′-TTGATTTGGCTGGTAGA A-3′,下游5′-ATGGCAGAAGATTGAGAA-3′。 采用2-ΔΔCt法计算mRNA相对表达水平。

3 结果
3.1 各组大鼠逃避潜伏期比较 与正常组比较,模型组大鼠逃避潜伏期显著增加(P<0.05);与模型组比较,黄地安消高、中剂量组,二甲双胍及多奈哌齐组逃避潜伏期均减少(P<0.05)。见表1。

表1 各组大鼠逃避潜伏期比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.2 各组大鼠空腹血糖水平比较 模型复制前各组大鼠空腹血糖比较,差异均无统计学意义(P>0.05);模型复制后,与正常组比较,模型组大鼠空腹血糖明显升高(P<0.05);给药28 d后,与模型组比较,黄地安消高、中剂量组,二甲双胍组及多奈哌齐组大鼠空腹血糖水平均降低(P<0.05)。见图1。

注:A.正常组;B.模型组;C.黄地安消高剂量组;D.黄地安消中剂量组;E.黄地安消低剂量组;F.二甲双胍组;G.多奈哌齐组;与正常组比较,*P#P<0.05

3.3 各组大鼠海马神经细胞损伤情况比较 正常组细胞排列紧密,神经细胞和细胞核形态完整。模型组神经细胞排列紊乱,细胞形态发生明显变化,细胞间隙变大,数量减少,多见体积缩小、胞核固缩伴有破裂的死亡的神经细胞。黄地安消中剂量组、二甲双胍组大鼠海马神经细胞排列较紧密,染色均匀,神经细胞损伤较少。黄地安消高、低剂量组大鼠海马有部分神经细胞出现损伤,多奈哌齐组大鼠海马可见部分损伤的神经细胞。见图2。
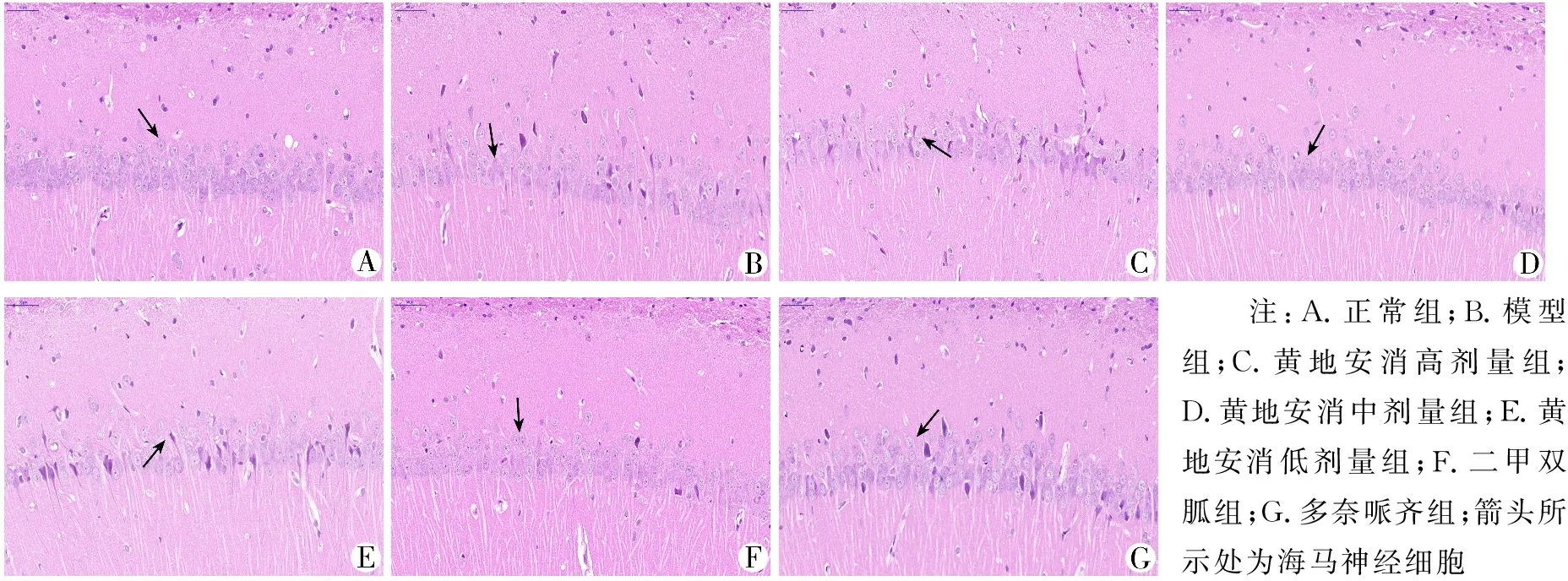
注:A.正常组;B.模型组;C.黄地安消高剂量组;D.黄地安消中剂量组;E.黄地安消低剂量组;F.二甲双胍组;G.多奈哌齐组;箭头所示处为海马神经细胞
图2 各组大鼠海马神经细胞组织学变化(HE染色,10×40倍)
3.4 各组大鼠海马Aβ沉积情况 正常组大鼠海马CA1区Aβ沉积较少,模型组大鼠海马CA1区发现大量Aβ沉积,而黄地安消胶囊中剂量组、二甲双胍和多奈哌齐组大鼠海马CA1区Aβ沉积较少。见图3。
3.5 各组大鼠海马组织中Bax、Bcl-2蛋白表达水平比较 与正常组比较,模型组Bax蛋白表达水平明显增加(P<0.05),Bcl-2蛋白表达水平明显减少(P<0.05);与模型组比较,黄地安消中剂量组、二甲双胍组、多奈哌齐组Bax蛋白表达水平均明显降低(P<0.05),Bcl-2蛋白表达水平均明显升高(P<0.05)。见图4。
3.6 各组大鼠海马组织中Bax、Bcl-2 mRNA含量比较 与正常组比较,模型组海马组织中Bax mRNA含量明显增加(P<0.05),Bcl-2 mRNA含量明显降低(P<0.05);与模型组比较,黄地安消中剂量组、二甲双胍组、多奈哌齐组Bax mRNA含量均明显降低(P<0.05),Bcl-2 mRNA含量均明显升高(P<0.05)。见图5。
4 讨论
认知功能下降和T2DM关系密切。研究[14-15]表明,糖尿病影响神经系统。高血糖被认为是糖尿病患者认知能力下降的一个决定性原因,因此,控制血糖对改善糖尿病引起的认知功能障碍是很有必要的[4]。此外,有研究[16]证实,海马细胞凋亡是引起海马神经细胞数目减少,海马萎缩,继而引起认知功能障碍的重要原因之一。因此,高血糖引起的Aβ沉积导致的认知功能障碍是本实验重点研究对象。本实验采用腹腔注射STZ溶液联合Aβ25-35双侧海马注射进行模型复制后,模型组大鼠学习记忆能力明显下降,空腹血糖水平升高,海马神经细胞出现损伤,Aβ沉积增加,表明本实验成功复制DCD动物模型。

注:A.正常组;B.模型组;D.黄地安消中剂量组;F.二甲双胍组;G.多奈哌齐组;箭头所示处为Aβ沉积处
图3 各组大鼠海马Aβ沉积情况(DAPI染色, 10×40倍)



注:A.正常组;B.模型组;D.黄地安消中剂量组;F.二甲双胍组;G.多奈哌齐组;与正常组比较,*P#P<0.05

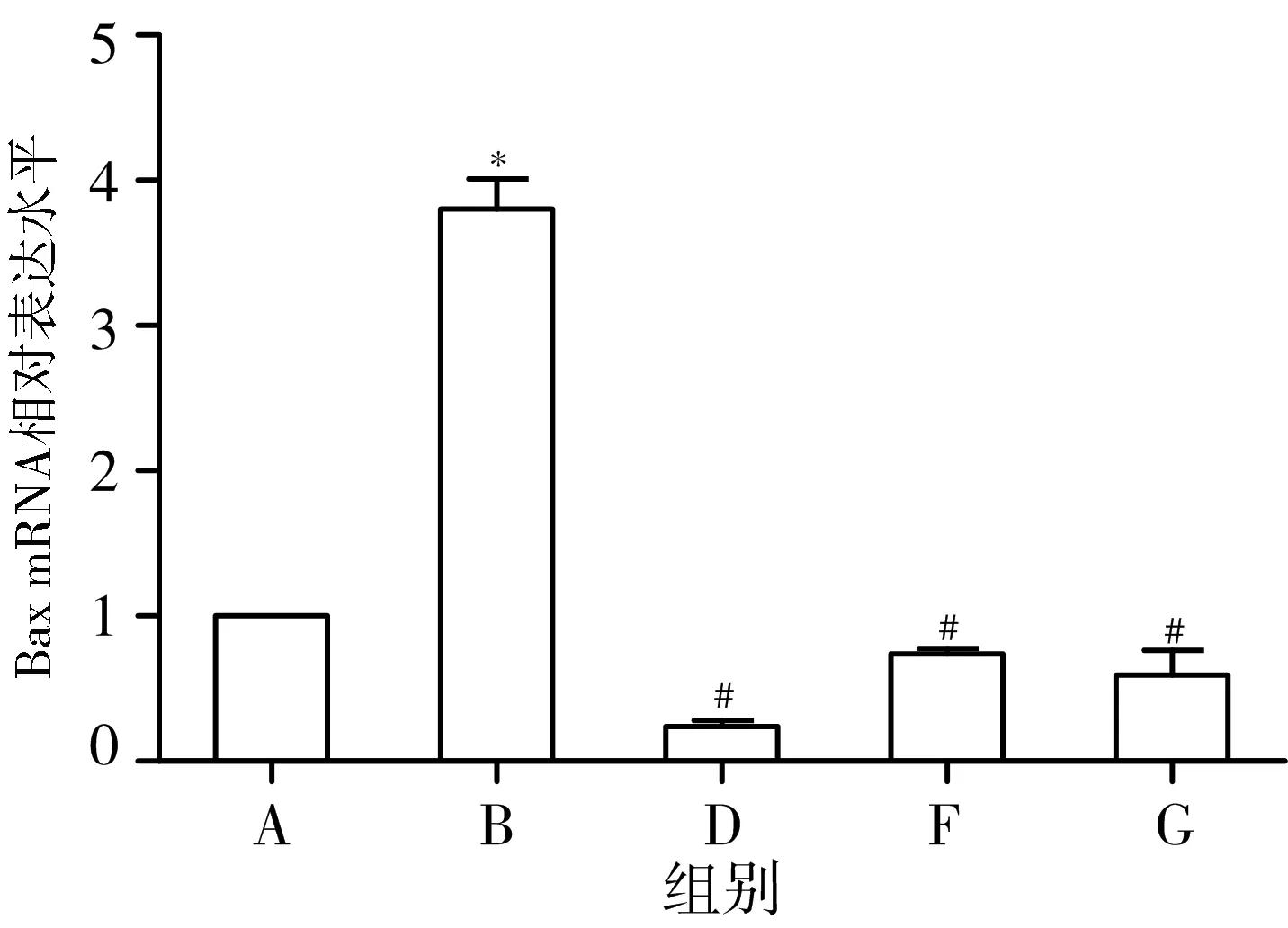
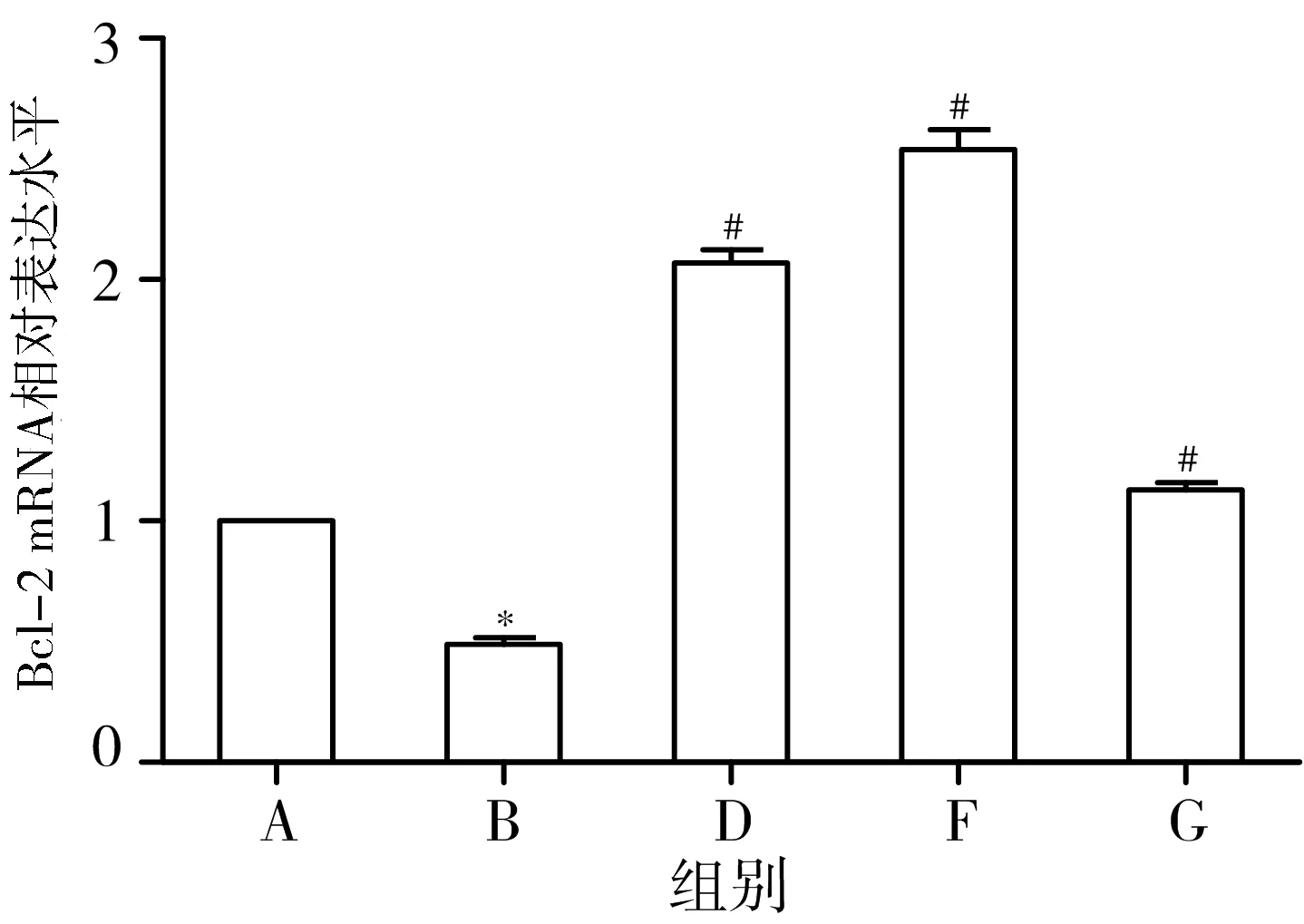
注:A.正常组;B.模型组;D.黄地安消中剂量组;F.二甲双胍组;G.多奈哌齐组;与正常组比较,*P#P<0.05

黄地安消胶囊是安徽中医药大学第一附属医院院内制剂,以黄连清热燥湿、泻火解毒,清解肺胃之燥热;生地黄清热生津、滋阴养血,养心、肾之阴;葛根解肌退热、生津止渴,清退肺胃之热;麦冬养阴润肺、益胃生津、清心除烦;枇杷叶清降肺胃之气;三七化瘀止血;全方共奏清热解毒、养阴生津、活血通络之功效。黄地安消胶囊能够改善胰岛素抵抗,保护胰岛β细胞功能,降低血糖。本研究显示,黄地安消胶囊可明显改善DCD动物模型学习记忆能力,减少海马神经损伤,降低空腹血糖,减少Aβ沉积。
内质网应激在T2DM的发生和发展过程中发挥了重要作用,其启动的凋亡途径是近几年来新发现的一种凋亡途径[17]。Bcl-2和Bax为Bcl-2家族的两个成员,共同调节细胞的凋亡过程。其中Bax是一种促凋亡蛋白,促进细胞凋亡的发生,而Bcl-2是一种抗凋亡蛋白,抑制细胞凋亡的发生。当Bcl-2表达较多时,与Bax形成异源二聚体,减缓细胞凋亡;当Bax表达增多时,形成大量Bax同源二聚体,诱发细胞凋亡[18-19]。本实验结果表明,模型组大鼠Bax蛋白表达量及mRNA含量均明显升高,而Bcl-2蛋白表达量及mRNA含量均明显降低。经黄地安消胶囊治疗后,模型组Bax蛋白表达量及mRNA含量均明显降低,Bcl-2蛋白表达量及mRNA含量均明显升高。
本次研究结果表明,黄地安消胶囊可通过降低血糖,保护神经细胞及清除Aβ沉积来改善认知功能障碍,调节Bax/Bcl-2凋亡信号通路可能是其潜在的作用机制。
