HPLC特征指纹图谱结合化学计量学评价不同寄主来源的桑寄生药材质量
2020-04-20卢森华甘洋萦唐莲张凤懿苏本伟
卢森华 甘洋萦 唐莲 张凤懿 苏本伟

摘 要 目的:評价不同寄主来源的桑寄生药材质量,建立具有寄主针对性的桑寄生药材质量评价方法。方法:采用高效液相色谱(HPLC)法测定,色谱柱为CAPCELL PAK C18 MGⅡ,流动相为甲醇-0.2%磷酸水溶液,流速为1.0 mL/min(梯度洗脱),测定波长为254 nm,柱温为30 ℃。以16批不同寄主来源的桑寄生药材为样品(桑树寄主、柳树寄主、茶树寄主、枫香树寄主的桑寄生各4批),采用《中药色谱指纹图谱相似度评价系统》(2004A 版)生成HPLC特征图谱并进行相似度评价,再通过与对照品比对进行色谱峰的指认。采用IBM SPSS 19.0软件对结果进行聚类分析和主成分分析。结果:从建立的共有特征图谱中标定出了11个共有峰,并指认了8、10、11号峰分别为芦丁、槲皮苷和槲皮素;16批样品的相似度均大于0.9,不同寄主来源的桑寄生在化学成分种类上基本一致(各共有峰相对保留时间的RSD为0.03%~0.40%),但同一成分的含量差异较大(各共有峰相对峰面积的RSD为27.00%~64.20%)。聚类分析将16批不同寄主来源的桑寄生分成3类;主成分分析结果提示,槲皮苷、槲皮素和芦丁对桑寄生品质有明显的影响,可作为桑寄生质量评价指标,且枫香树寄主桑寄生样品的整体质量最好(综合评分最高)。结论:HPLC特征指纹图谱结合化学计量的方法可作为不同寄主来源的桑寄生药材质量评价和控制的技术方法。
关键词 桑寄生;不同寄主;高效液相色谱法;指纹图谱;聚类分析;主成分分析;质量评价
ABSTRACT OBJECTIVE: To establish a host specific method for the quality evaluation of Taxillus chiueusis by evaluating the quality of T. chiueusis from different hosts sources. METHODS: HPLC was adopted with CAPCELL PAK C18 MGⅡ column, mobile phase consisted of methanol-0.2% phosphoric acid, volume flow 1.0 mL/min (gradient elution), detection wavelength of 254 nm, column temperature of 30 ℃. Totally of 16 batches of T. chiueusis from different hosts sources were collected as sample (4 batches from tea host, maple host, willow host and mulberry host respectively). HPLC characteristic chromatogram was established with TCM Chromatogram Fingerprint Similarity Evaluation System (2004A edition), and similarity evaluation was performed. The peak was identified by comparison with the reference substance. IBM SPSS 19.0 software was used for cluster analysis and principal component analysis. RESULTS: Totally 11 common peaks were demarcated, peak No. 8, 10, 11 were identified as rutin, quercetin and quercitin. The similarity of 16 batches of samples was more than 0.9. The chemical components of T. chiueusis from different hosts sources were basically the same(RSDs of relative time of commom peaks were 0.03%-0.40%), but the contents of the same component were quite different(RSDs of relative peak area of commom peaks were 27.00%-64.20%). By cluster analysis, 16 batches of T. chiueusis from different hosts sources were divided into 3 types. The results of principle component analysis showed that quercetin, quercitin and rutin had significant effect on the quality of T. chiueusis, which could be used as the quality evaluation index, and the whole quality of maple host was the best (the highest comprehensive score). CONCLUSIONS: HPLC fingerprint combined with chemometrics can be used to evaluate the quality of T. chiueusis from different hosts sources.
KEYWORDS Taxillus chiueusis; Different hosts; HPLC;Fingerprint; Cluster analysis; Principal component analysis; Quality evaluation
桑寄生又称广寄生,为桑寄生科钝果寄生属植物桑寄生[Taxillus. chinensis ( DC.) Danser]的枝叶,其味苦、甘,性平,具有祛风湿、补肝肾、强筋骨、安胎等功效,常用于治疗风湿痹痛、腰膝酸痛、头昏目眩、筋骨痿弱、肢体偏枯、崩漏下血、便血、产后乳汁不下、胎动不安等症[1-2]。现代药理研究表明,桑寄生具有显著的抗氧化、抗病毒、抗肿瘤、抗衰老以及降血脂、降血压、降血糖等生物活性[3]。桑寄生属于半寄生性植物药材,常寄生于桑树(即桑树寄主桑寄生)、柳树(即柳树寄主桑寄生)、茶树(即茶树寄主桑寄生)、枫香树(即枫香树寄主桑寄生)等植物上。2015年版《中国药典》(一部)对桑寄生药材的寄主没有明确规定,只要药材基源为桑寄生[T. chinensis(DC.) Danser]均可入药[4]。
寄主植物的复杂多样性构成了桑寄生药材重要的生物学特征,是影响桑寄生质量最直接的因素[5]。多项研究表明,寄主植物通过寄主与桑寄生药材之间在化学成分、药理作用等方面的特殊关系影响着桑寄生的药材质量[6-7]。同时,因不同寄主来源的桑寄生药材在药理和药效方面存在差异,可能在不同程度上影响桑寄生药材质量的安全性和有效性[8]。因此,必须要对桑寄生寄主进行规范,才能实现对桑寄生药材质量的有效控制。但目前不同寄主来源的桑寄生药材质量有何差异还缺乏系统性研究报道。中药指纹图谱是运用高效液相色谱(HPLC)等技术对中药化学信息以图形的方式进行表征并加以描述,能够成为中药自身的“化学条形码”,是一种综合分析多种成分的有效手段[9]。再加上化学计量学(聚类分析和主成分分析等)在处理中药指纹图谱等多维数据的分析中具有明显优势[10]。基于此,本文拟建立HPLC特征指纹图谱,并结合化学计量学方法评价不同寄主来源的桑寄生的药材质量,为不同寄主来源桑寄生药材的质量评价提供一种科学的技术方法。
1 材料
1.1 仪器
UltiMate3000型HPLC仪(美国Thermo Fisher Scientific公司);HH-S6型数显恒温水浴锅(金坛市医疗仪器厂);Synergy?UV型超纯水机(美国Millipore公司);KQ- 500GDV型超声波清洗器(昆山市超声仪器有限公司);XS-205Du型电子分析天平(瑞士Mettler-Toledo公司);CX-200型高速多功能粉碎机(上海缘沃工贸有限公司)。
1.2 药品与试剂
16批不同寄主来源的桑寄生样品均采集自广西各地,药材来源主要是采购和野外采集,所有样品经广西中医药大学李永华研究员鉴定均为桑寄生科钝果寄生属植物桑寄生[T. chinensis (DC.) Danser]的干燥带叶茎枝;芦丁对照品(批号:100080-201409,纯度:91.9%)、槲皮苷对照品(批号:111538-201606,纯度:90.6%)、槲皮素对照品(批号:100081-201509,纯度:98.1%)均购自中国食品药品检定研究院标准物质和标准化管理中心;乙腈、甲醇(德國默克股份两合公司,色谱纯);磷酸(天津市光复精细化工研究所,优级纯);其余试剂均为分析纯,水为超纯水。不同寄主来源桑寄生药材的基源信息见表1。
2 方法与结果
2.1 色谱条件
色谱柱:CAPCELL PAK C18 MGⅡ(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.2%磷酸水溶液(B)(V/V),梯度洗脱(0~5 min,20%A;5~49 min,20%A→80%A;49~50 min,80%A→20%A);流速:1.0 mL/min;检测波长:254 nm;柱温:30 ℃;进样量:5 ?L。
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取槲皮苷对照品11.36 mg、芦丁对照品10.25 mg、槲皮素对照品11.15 mg,分别置于不同20 mL量瓶中,加适量甲醇超声(功率:500 W,频率:40 kHz)5 min使溶解,再用甲醇稀释至刻度,摇匀,即得各单一对照品溶液。再分别精密量取上述单一对照品溶液各1.0 mL,置于同一10 mL量瓶中,再用甲醇定容,摇匀,即得混合对照品溶液(每1 mL溶液中含槲皮苷51.5 ?g、芦丁47.1 ?g、槲皮素54.7 ?g)。
2.2.2 供试品溶液 取桑寄生样品约2.0 g,精密称定,置于250 mL具塞平底烧瓶中,精密加入25%盐酸-甲醇(1 ∶ 4,V/V)溶液25 mL,称定质量,在恒温(90 ℃)水浴锅中水浴加热回流提取2 h,冷却后再次称定质量,并用25%盐酸-甲醇(1 ∶ 4,V/V)溶液补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3 方法学考察
2.3.1 精密度试验 分别精密吸取“2.2.2”项下同一供试品溶液,按“2.1”项下色谱条件连续进样6次,记录色图谱。以11号峰(槲皮素峰)作为参照峰计算样品中各共有峰的相对保留时间和相对峰面积[10]。结果显示,11个共有峰相对保留时间的RSD为0.01%~0.40%(n=6)、相对峰面积的RSD为0.05%~1.80%(n=6),表明本方法精密度较好。
2.3.2 重复性试验 取桑寄生样品(编号:S1)6份,每份约2.0 g,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录色谱图。以11号峰(槲皮素峰)作为参照峰计算样品中各共有峰的相对保留时间和相对峰面积[10]。结果显示,11个共有峰相对保留时间的RSD为0.05%~0.50%(n=6)、相对峰面积的RSD为1.30%~5.60%(n=6),表明该方法重复性较好。
2.3.3 稳定性试验 取“2.2.2”项下供试品溶液,分别于室温下放置1、2、4、6、12、24 h后,按“2.1”项下色谱条件进样测定,记录色谱图。以11号峰(槲皮素峰)作为参照峰计算样品中各共有峰的相对保留时间和相对峰面积[10]。结果显示,11个共有峰相对保留时间的RSD为0.05%~0.50%(n=6)、相对峰面积的RSD为0.10%~3.00%(n=6),表明供试品溶液在室温下放置24 h内稳定性较好。
2.4 HPLC特征指纹图谱的建立与分析
2.4.1 HPLC特征指纹图谱的生成 取16批不同寄主来源的桑寄生样品各约2.0 g,分别按“2.2.2”项下方法制备供试品溶液,然后按“2.1”项下色谱条件进样测定,记录色谱图。将16批不同寄主来源桑寄生样品的图谱及数据在Chromeleon变色龙7色谱数据系统中生成后缀为.cdf的文件,将此文件数据导入《中药色谱指纹图谱相似度评价系统》(2004A 版)中,建立16批不同寄主来源桑寄生的HPLC叠加色谱图[11]。以编号S1的样品图谱作为参照图谱,设置时间窗宽度为0.1 min,进行多点校正和自动谱峰匹配生成桑寄生样品的共有模式,并采用中位数法生成对照指纹图谱(SR)[11]。16批不同寄主來源的桑寄生样品HPLC叠加色谱图见图1,对照指纹图谱见图2。
2.4.2 相似度评价 以对照指纹图谱为参照,进行16批不同寄主来源桑寄生样品的整体相似度评价。结果,16批不同寄主来源桑寄生样品的图谱与对照指纹图谱的相似度均大于0.9,表明构建的桑寄生对照指纹图谱具有一定的代表性,也表明不同寄主来源桑寄生样品之间差异不大,主要化学成分具有一致性。16 批不同寄主来源桑寄生样品相似度评价结果见表2。
2.4.3 共有峰的指认及相关分析 在16批不同寄主来源桑寄生样品的图谱中共标定了11个共有峰。通过与混合对照品溶液的HPLC色谱图(按“2.1”项下色谱条件进样)对比,指认了8号峰为芦丁、10号峰为槲皮苷、11号峰为槲皮素。槲皮素是2015年版《中国药典》(一部)中桑寄生的含量测定指标[4],加之槲皮素峰在色谱图中保留时间适中、响应值较大、对称因子及分离度等均符合要求[12],且为所有桑寄生样品共有,因此本研究选用槲皮素峰(11号峰)作为参照峰(S),计算16批不同寄主来源桑寄生样品中11个共有峰的相对保留时间和相对峰面积。结果显示,16批桑寄生样品中11个共有峰相对保留时间的RSD仅为0.03%~0.40%,相差较小;而相对峰面积的RSD为27.00%~64.20%,相差较大。由此可知,不同寄主来源的桑寄生样品在化学成分种类上具有一致性,但同一成分的含量差异明显。混合对照品溶液的色谱图见图3;16 批不同寄主来源的桑寄生样品共有峰相对保留时间测定结果见表3,相对峰面积测定结果见表4。
2.5 化学计量学分析
2.5.1 聚类分析 运用IBM SPSS 19.0统计分析软件,以16批不同寄主来源桑寄生样品的11个共有峰的峰面积作为变量,采用组间连接聚类方法,以平方Euclidean距离为度量标准进行系统聚类分析[13]。结果,当分类距离d=15时,16批次不同寄主来源的桑寄生样品可聚为3类:编号为S1~S4的样品聚为第一类,均为桑树寄主桑寄生样品;编号为S9~S15的样品聚为第二类,为茶树寄主桑寄生和枫香树寄主桑寄生样品;编号为S5~S8和S16的样品聚为第三类,除编号为S16的样品为枫香树寄主桑寄生样品外其余均为柳树寄主桑寄生样品。16批不同寄主来源的桑寄生样品聚类分析树状图见图4。
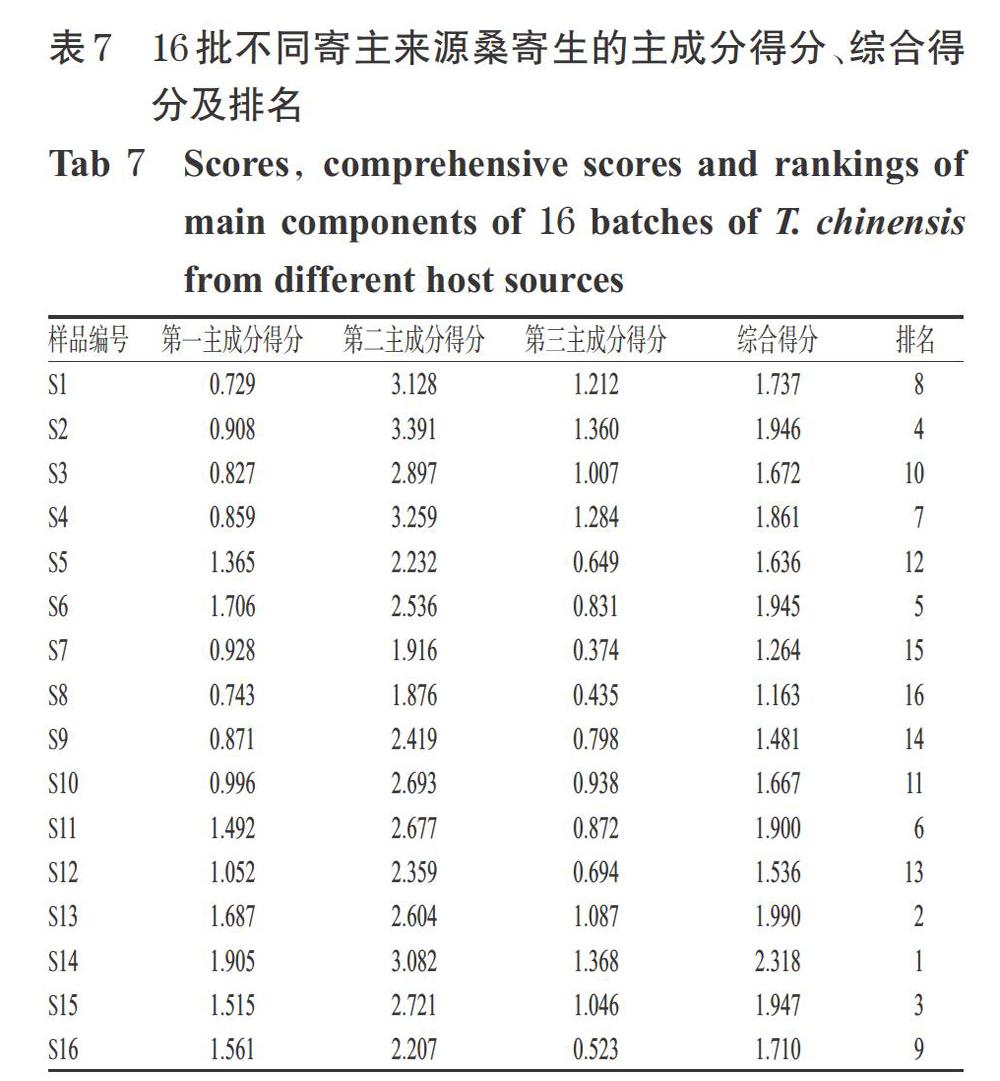
2.5.2 主成分分析 以主成分的特征根和贡献率作为选择主成分的依据,将16批不同寄主来源桑寄生样品的11个共有峰的峰面积(16×11阶原始数据矩阵)导入IBM SPSS19.0统计分析软件进行因子分析[14]。结果,提取到3个主成分因子,其特征根>0.9,累积方差贡献率为83.664%,表明前3个主成分因子即可以代表样品80%以上的信息;主成分因子1、2、3可作为桑寄生药材的评价指标,适用于主成分分析。3个主成分因子的特征值和方差贡献率见表5。
以主成分因子为变量绘制公因子碎石图。结果显示,最先提取到的3个主成分因子的斜率最大,表明所提取的3个主成分可以最大程度地反映桑寄生药材的品质。然后将得到的成分矩阵进行正交旋转,得到11个指标在3个主成分中的旋转矩阵。结果显示,第一主成分的信息主要来自于色谱峰5、6、7、3、2;第二主成分的信息主要来自于色谱峰10(槲皮苷)、11(槲皮素)、8(芦丁)和9,此类峰的峰面积较大,表示成分含量较高,对桑寄生品质有明显的影响;第三主成分的信息主要来自色谱峰4、1。根据旋转成分矩阵可推测,槲皮苷、槲皮素和芦丁对桑寄生品质有明显的影响,可作为桑寄生质量评价指标。公共因子碎石图见图5,旋转成分矩阵见表6。
以X1、X2、X3代表3个主成分来作为16批桑寄生样品成分所表达的信息,以其11个共有峰的峰面积(A)为变量(标准化处理后峰面积,并非原始峰面积),建立品质评价模型[15]。得到第一主成分的线性关系表达式为:X1=-0.246A1+0.738A2-0.838A3-0.199A4+0.899A5+0.891A6+0.846A7-0.099A8+0.159A9-0.113A10+0.242A11;第二主成分的线性关系表达式为:X2=0.166A1+0.016A2-0.195A3+0.377A4-0.168A5-0.116A6+0.211A7+0.890A8+0.716A9+0.933A10+0.890A11;第三主成分的线性关系表达式为:X3=0.784A1-0.382A2+0.232A3+0.810A4-0.295A5+0.189A6-0.083A7+0.401A8+0.541A9+0.322A10-0.110A11。将上述表达式与所对应的3个主成分的方差贡献率作内积后,得到桑寄生质量综合评价函数的表达式为:X(综合得分)=(41.497%X1+33.379%X2+8.788%X3)/83.664%,综合得分越高表示药材样品的整体质量越好[15]。结果显示,3批枫香树寄主桑寄生样品(S13~S15)的综合得分位列前3名,表明这3批样品的整体质量较好。16批不同寄主来源桑寄生主成分得分、综合得分及排名见表7。
3 讨论
在前期研究中,笔者参考文献方法[6-8]分别考察了提取溶剂(甲醇、70%甲醇、甲醇-25%盐酸溶液等)、提取方法(超声和回流)和提取时间(30、60、120 min)等对桑寄生化学成分溶出的影响。结果发现,以甲醇-25%盐酸(4 ∶ 1,V/V)为溶剂回流2 h提取时,桑寄生样品溶液色谱图中峰数最多,且峰面积较大。此外,笔者还考察了测定波长(220、254、330 nm)、色谱柱(ZORBAX SB-C18、CAPCELL PAK C18 MGⅡ)、柱温(25、30 ℃)、进样体积(5、10 ?L)、流动相体系(甲醇/乙腈-水/0.2%磷酸水溶液不同比例梯度洗脱)对桑寄生HPLC指纹图谱分离效果的影响。结果,在本试验确定的色谱条件下,HPLC特征指纹图谱基线平稳,分离度及峰形均良好。
本试验中选择每种寄主来源样品各4批为代表,建立了不同寄主来源桑寄生的HPLC指纹图谱。相似度评价结果显示,16批不同寄主来源的桑寄生样品在化学成分种类上基本一致,但含量差異较大。聚类分析结果显示,16批次不同寄主来源的桑寄生样品可共聚为3类(d=15时)。但当分类距离d=5时,第一类又可聚为2小类,S2~S4聚为一小类(桑树寄主桑寄生),S1单独聚为另一小类(桑树寄主桑寄生);第二类又可聚为2小类,S9~S12聚为一小类(茶树寄主桑寄生),S13~S15聚为另一小类(枫香树寄主桑寄生);第三类又可聚为3小类,S7、S8聚为一小类(柳树寄主桑寄生),S5、S6聚为另一小类(柳树寄主桑寄生),S16单独聚为一小类。这表明聚类分析(d=5)基本可识别不同寄主来源的桑寄生。主成分分析结果提示,槲皮苷、槲皮素和芦丁对桑寄生品质有明显的影响,可作为桑寄生质量评价指标,并且以枫香树寄主桑寄生样品的整体质量最好。
中药指纹图谱是对现行中药质量控制方法的有益补充和提高[9],虽然尚无法完全确定中药物质群体的化学组成,但对于中药质量控制具有积极的促进作用[16]。本研究建立了以相似度评价、聚类分析和主成分分析为核心的化学模式识别方法,对不同寄主来源的桑寄生质量进行研究,可为该药材的质量评价提供参考,也可为提高其质量控制标准提供一定的方法支持。
参考文献
[ 1 ] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:605-610.
[ 2 ] 南京中医药大学.中药大辞典[M].上海:上海人民出版社,2006:2788-2790.
[ 3 ] 苏本伟,朱开昕,裴河欢,等.基于寄主差异的中药桑寄生研究进展[J].时珍国医国药,2016,27(7):1716-1719.
[ 4 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:299-300.
[ 5 ] 朱开昕,卢栋,裴河欢,等.桑寄生在广西的分布及其寄主状况调查[J].广西中医药,2010,33(2):59-61.
[ 6 ] 李永华,卢栋,朱开昕,等.桑寄生及其夹竹桃科寄主植物强心苷含量相关性研究[J].时珍国医国药,2010,21(6):1397-1398.
[ 7 ] 周汉华,刘晓龙,钱海兵,等.不同寄主上的桑寄生药材毒性的比较研究[J].中国实验方剂学杂志,2013,19(24):274-277.
[ 8 ] 张慧,黄蜚颖,苏本伟,等.寄主对桑寄生药材质量的影响[J].世界科学技术-中医药现代化,2016,18(7):1182- 1187.
[ 9 ] 刘文,蒋世云.中药指纹图谱研究与应用进展[J].中国药房,2011,22(19):1819-1822.
[10] 梁爽,甘洋萦,卢森华,等.基于HPLC结合化学计量学的壮瑶药小槐花指纹图谱研究[J].南京中医药大学学报,2019,35(2):210-213.
[11] 张志,吕建伟,覃开羽,等.基于HPLC结合化学计量学的银菊合剂指纹图谱研究[J].湖北农业科学,2019,58(16):110-114.
[12] 钮松召,崔颖,卢菲,等.蒙药山川柳的HPLC指纹图谱建立、相似度评价和聚类分析[J].中国药房,2019,30(8):1091-1094.
[13] 靳贝贝,裴香萍,梁惠珍.青皮药材的HPLC指纹图谱建立及聚类分析和主成分分析[J].中国药房,2018,29(24):3336-3339.
[14] 黄华花,王明军,黄鸣清,等.金橘药材的UPLC指纹图谱建立、聚类分析及主成分分析[J].中国药房,2019,30(12):1661-1665.
[15] 傅静,张莹,李宇辉,等.基于聚类分析和主成分分析的壮瑶药三妹木HPLC指纹图谱研究[J].中国药房,2019,30(17):2355-2359.
[16] 杨方良,张晶,孙国祥,等.中药组方指纹图谱研究方法和思路[J].色谱,2016,34(7):715-725.
(收稿日期:2019-12-14 修回日期:2020-03-04)
(编辑:林 静)
