检测谷胱甘肽还原酶活性水平在乙型肝炎辅助诊断中的应用
2020-04-20李淑丽陆善词王军杨海辉何娟梁连辉高文军
李淑丽 陆善词 王军 杨海辉 何娟 梁连辉 高文军

【摘要】 目的 探討检测血清谷胱甘肽还原酶(GR)活性水平在乙型肝炎辅助诊断中的应用价值。方法 选取140例确诊为乙型肝炎的患者作为阳性组, 另选取同期430例表观健康者作为对照组, 检测两组研究对象的血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、GR以及总胆红素(TBIL)水平。采用组间比较和分层比较评估GR活性水平与由乙型肝炎引起肝损伤的关联性和诊断效能。结果 两组研究对象的年龄、ALT、AST、TBIL、ALP和GR检测结果均呈非正态分布。对照组研究对象年龄中位数为35.0岁, 略高于阳性组的33.0岁, 但两组比较差异无统计学意义(P>0.05);阳性组ALT、AST、TBIL、ALP、GR水平均显著高于对照组, 差异具有统计学意义(P<0.05)。对ALT、AST、TBIL、ALP和GR进行受试者工作特征(ROC)曲线分析, 可知血清GR活性水平对乙肝患者肝损伤的诊断界值为61.5 U/L, 曲线下面积(AUC)为0.882[95%CI=(0.845, 0.919), P<0.05], 灵敏度为78.6%, 特异度为89.3%。对不同生物标志物的ROC曲线进行比较, ALT和AST的AUC最大, 但两者比较差异无统计学意义(P>0.05);GR的AUC次于ALT和AST, 但优于TBIL和ALP, 比较差异均具有统计学意义(P<0.05);TBIL和ALP的AUC较差, 两者比较差异无统计学意义(P>0.05)。将阳性组研究对象按GR活性水平四分位数间距(Q)进行分层:ALT和AST活性水平均随GR活性水平的升高而升高(P<0.05), 在Q1~Q2区间内升高较缓(P>0.05), 在Q3~Q4区间内迅速升高(P<0.05);TBIL和ALP在Q1~Q3区间内趋势不显著(P>0.05), 仅有Q4与其他层级相比有显著升高(P<0.05);年龄未显示出明显的趋势(P>0.05)。结论 血清GR活性水平升高与由乙型肝炎引起的肝损伤显著相关, 检测血清GR活性水平可作为辅助诊断、治疗各类肝病、评估肝损伤程度的方法。
【关键词】 谷胱甘肽还原酶;肝损伤;乙型肝炎
DOI:10.14163/j.cnki.11-5547/r.2020.09.003
【Abstract】 Objective To discuss the application value of serum glutathione reductase (GR) activity level in the auxiliary diagnosis of hepatitis B. Methods There were 140 patients with hepatitis B selected as the positive group and concurrent 430 patients with apparent health as the control group. The levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase (ALP), GR and total bilirubin (TBIL) of the two groups were detected. Inter-group comparison and stratified comparison were used to evaluate the correlation and diagnostic efficacy of GR activity level with liver injury caused by hepatitis B. Results The age, ALT, AST, TBIL, ALP and GR test results of the two groups showed non-normal distribution. The median age of the control group was 35.0 years old, which was slightly higher than 33.0 years of the positive group, but there was no significant difference between the two groups (P>0.05). The levels of ALT, AST, TBIL, ALP and GR in the positive group was significantly higher than those in the control group, and the difference was statistically significant (P<0.05). The receiver operator characteristic (ROC) curve analysis of ALT, AST, TBIL, ALP and GR showed that the diagnostic threshold of serum GR activity for liver injury in patients with hepatitis B was 61.5 U/L, area under the curve (AUC) was 0.882 [95%CI=(0.845, 0.919), P<0.05], sensitivity was 78.6%, and specificity was 89.3%. Comparing the ROC curves of different biomarkers, AUC of ALT and AST had the highest diagnostic efficacy, but there was no statistically significant difference between the two (P>0.05). AUC of GR was inferior to ALT and AST, but it was better than TBIL and ALP, and the difference was statistically significant (P<0.05). AUC of TBIL and ALP were worse, and the difference was not statistically significant (P>0.05). The positive group were stratified according to the quartile interval (Q) of GR activity level: ALT and AST activity levels increased with the increase of GR activity level (P<0.05), increased slowly in the interval of Q1-Q2 (P>0.05), and increased rapidly in the interval of Q3-Q4 (P<0.05). TBIL and ALP did not show significant trends in the Q1-Q3 interval (P>0.05). Only at Q4 it showed a significant increase compared to other levels (P<0.05), and age did not show a significant trend (P>0.05). Conclusion The increase of serum GR activity was significantly related to liver injury caused by hepatitis B. The detection of GR activity in serum can be used as an assistant method to diagnose, treat various liver diseases and evaluate the degree of liver injury.
【Key words】 Glutathione reductase; Liver injury; Hepatitis B
肝脏病变包括甲型肝炎(甲肝)、乙型肝炎、丙型肝炎(丙肝)、肝硬化、脂肪肝、肝癌、酒精肝等多种形式[1], 是一种常见的危害性极大的疾病, 肝损伤是这类疾病的主要临床表征之一[2]。谷胱甘肽是一种细胞内关键的抗氧化剂, 在代谢清除亲电异源性物质的生理活动中起重要作用[3]。GR可催化氧化型谷胱甘肽(GSSG)转变成还原型谷胱甘肽(GSH)的还原反应, 保持有机体内GSH处于高水平, GSSG处于低水平, 维持体内适当还原态环境[4, 5]。Rall和Backer于上世纪50年代于肝脏内发现GSH和GR[6, 7]。在多种肝脏疾病中, 尤其是传染性肝炎、急性肝炎的初始阶段、肝硬化以及涉及肝脏转移的恶性病变中, 患者血清中的GR活性水平均有显著升高[8, 9]。此外, 在不同的临床环境中, GR与其他肝源型的酶蛋白, 如转氨酶和碱性磷酸酶(alkaline phosphatase, ALP)等在体内的水平有显著差异。在最近的研究中, 在动物模型和临床试验中均证实, GSH对肝损伤有保护和修复作用[10, 11], 因此, GR可作为肝损伤程度的评估指标, 检测血清中的GR活性水平有助于辅助诊断、治疗各类肝病、评估肝损伤程度、监测治疗效果, 为现有常规肝功能检测指标提供补充。在肝炎的诊疗过程中, 往往只注重其传染性, 缺少适宜的生物标志物对由疾病引起的肝损伤程度进行评估和跟踪。本研究以临床确诊的乙型肝炎患者为肝损伤模型, 以自建检测体系调查了血清GR活性水平在表观健康人群与肝损伤个体中的分布水平, 及其与其他常规肝功能检测项目的关联性和差异性, 为临床应用GR辅助诊断、治疗各类肝病、评估肝损伤程度提供依据。现报告如下。
1 资料与方法
1. 1 一般资料 选取2018年3月~2019年4月在广东省中山市第二人民医院确诊为乙型肝炎患者140例作为阳性组, 其中男107例, 女33例;年龄18~83岁。另选取同期该院体检中心表观健康者430例作为对照组, 其中男335例, 女95例;年龄18~83岁。两组研究对象一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。
1. 2 纳入标准 对照组纳入标准:所有入选者年龄均≥18岁;肝功能检测无异常, 结果处于正常参考区间内[丙氨酸氨基转移酶(alanine aminotransferase, ALT):5~40 U/L;门冬氨酸氨基转移酶(aspartate aminotransferase, AST):0~40 U/L;谷氨酰转移酶(GGT):0~55 U/L;总胆红素(total bilirubin, TBIL):1.7~26 μmol/L;ALP:40~150 U/L];乙型肝炎两对半检查结果中乙型肝炎表面抗原(HBSAg)为阴性;丙型肝炎病毒抗体(HCV-IgG)检测结果为阴性。阳性组纳入标准:所有入选者年龄均≥18岁;乙型肝炎两对半检查结果中乙型肝炎表面抗原为阳性, 乙型肝炎E抗原(HBeAg)为阳性, 且乙型肝炎核心抗体(HBcAb)为阳性。
1. 3 方法
1. 3. 1 样本采集 所有研究对象空腹取静脉血, 2 h内离心并分离血清, 在24 h内进行检测的样本可冷藏(2~8℃)保存;24 h内无法测定的样本需冷冻保存(-20 ℃或以下), 不能反复冻融, 冷冻保存的样本最多保存6个月。血清样本体积≥1 ml。
1. 3. 2 生化指标检测 血清GR活性采用GSSG底物法检测, 试剂盒由上海润鸿生物科技有限公司提供, 检测仪器为HITACHI 7180全自动生化分析仪(日本日立公司)。ALT、AST、TBIL和ALP试剂盒由上海执诚生化科技有限公司提供, 检测仪器为日立7180全自动生化分析仪(日本日立公司)或SIEMENS ADVIA1800全自動生化分析仪(德国西门子公司)。乙型肝炎两对半采用cobas e411全自动电化学发光分析仪(瑞士罗氏公司)及配套试剂(电化学发光法)检测。丙型肝炎采用酶联免疫法检测, 试剂盒购自北京万泰生物药业股份有限公司, 检测仪器为BioTek ELX80酶标仪(美国宝特公司)。
1. 4 统计学方法 采用SPSS 20.0软件进行统计分析。采用Kolmogorov-Smirnov法进行正态性检验。正态分布资料采用均数±标准差 ( x-±s)表示, 两组间比较采用t检验, 相关性分析采用Pearson相关分析, 多组间比较采用单因素方差分析。非正态分布资料采用M(P25, P75)表示, 两组间比较采用Mann-Whitney检验, 相关性分析采用Spearman相关分析, 多组间比较采用Kruskal-Wallis检验。采用受试者工作特征(receiver operating characteristic, ROC)曲线确定GR活性水平对乙型肝炎患者的诊断界值。曲线下面积(area under curve, AUC)相互比较采用Delong法。P<0.05表示差异有统计学意义。
2 结果
2. 1 两组各项生化指标测定结果比较 两组研究对象的年龄、ALT、AST、TBIL、ALP和GR检测结果均呈非正态分布。对照组研究对象年龄中位数为35.0岁, 略高于阳性组的33.0岁, 但比较差异无统计学意义(P>0.05);阳性组ALT、AST、TBIL、ALP、GR水平均显著高于对照组, 差异具有统计学意义(P<0.05)。见表1, 图1。
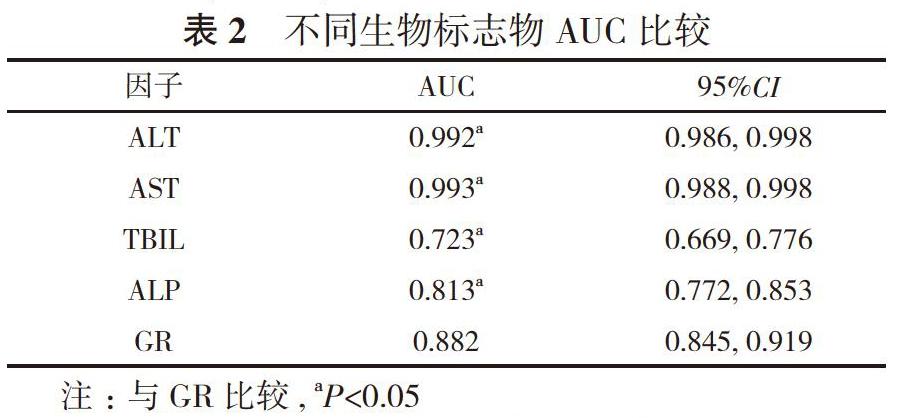
2. 2 不同生物标志物AUC比较 对ALT、AST、TBIL、ALP和GR进行ROC曲线分析, 可知血清GR活性水平对乙型肝炎患者肝损伤的诊断界值为61.5 U/L, AUC为0.882[95%CI=(0.845, 0.919), P<0.05], 灵敏度为78.6%, 特异度为89.3%。对不同生物标志物的ROC曲线进行比较, ALT和AST的AUC最大, 但两者比较差异无统计学意义(P>0.05);GR的AUC次于ALT和AST, 但优于TBIL和ALP, 比较差异均具有统计学意义(P<0.05);TBIL和ALP的AUC较差, 两者比较差异无统计学意义(P>0.05)。见表2。
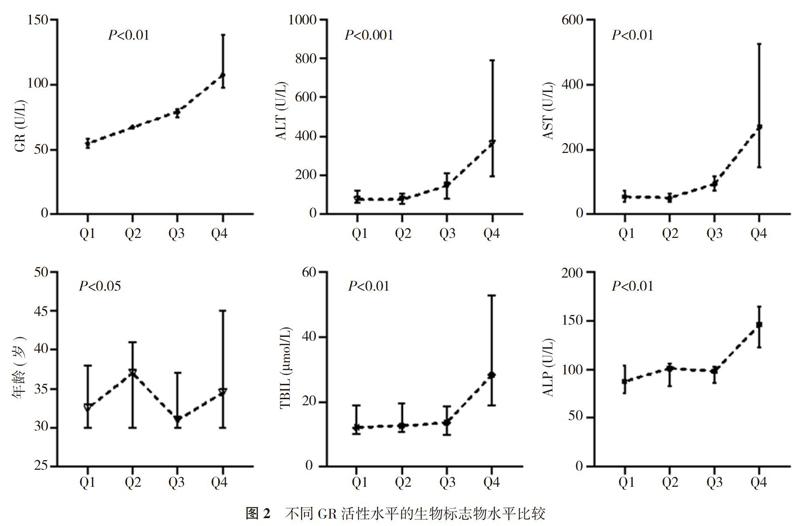
2. 3 不同GR活性水平的生物标志物水平比较 将阳性组研究对象按GR活性水平四分位数间距(Q)进行分层:ALT和AST活性水平均随GR活性水平的升高而升高(P<0.05), 在Q1~Q2区间内升高较缓(P>0.05), 在Q3~Q4区间内迅速升高(P<0.05);TBIL和ALP在Q1~Q3区间内趋势不显著(P>0.05), 仅有Q4与其他层级相比有显著升高(P<0.05);年龄未显示出明显的趋势(P>0.05)。见图2, 表3。
3 讨论
肝脏在有机体的代谢和排毒过程中起关键作用。药物、内源性或异源性物质等多种因素都会引起氧化应激反应, 产生自由基, 导致肝损伤[12]。GSH在肝脏的亲电物质转运系统中起重要作用, 而谷胱甘肽过氧化物酶(Glutathione Peroxidase, GPx)和GR参与调节维持GSH微循环[13], 清除自由基和过氧化物, 抵御各类疾病、内源性和外源性侵入[14]。现有研究表明, 肝损伤患者血清和肝脏中的GR活性水平均显著升高, 且早于血清ALP的活性上升, 其生理过程可能为:肝损伤时, 细胞膜的渗透能力发生变化, 导致GR随ALT等其他肝源性酶一同从这些组织内释放至血液中[9]。进一步研究确认, 肝损伤过程中的氧化应激反应导致了血清中GR活性水平的上升[12]。在由四氯化碳诱导的肝损伤动物模型中, 氧化应激反应促使细胞产生自由基, 损害肝脏;而机体自身的抗氧化保护系统被激活以消除自由基带来的损伤, 在该系统中, GPx借助GSH传递电子消除有机物或无机过氧化物生成GSSG, 而GR则将GSSG还原为GSH循环利用[15], 机体自身通过增加GPx和GR的活性水平改善体内的氧化还原环境, 从而消除有害环境的影响。
本课题组早前已报道, 在表观健康人群中, 男性的血清GR活性水平显著高于女性, 分别为39~72 U/L和41~65 U/L, 且血清GR活性水平升高与肝损伤显著相关, 是由乙型肝炎引起的肝损伤的独立危险因子[16]。本研究将GR活性水平检测初步应用到临床实践中, 结果显示, 两组研究对象的年龄、ALT、AST、TBIL、ALP和GR检测结果均呈非正态分布。对照组研究对象年龄中位数为35.0岁, 略高于阳性组的33.0岁, 但两组比较差异无统计学意义(P>0.05);阳性组ALT、AST、TBIL、ALP、GR水平均显著高于对照组, 差异具有统计学意义(P<0.05)。对ALT、AST、TBIL、ALP和GR进行ROC曲线分析, 可知血清GR活性水平对乙肝患者肝损伤的诊断界值为61.5 U/L, AUC为0.882[95%CI=(0.845, 0.919), P<0.05], 灵敏度为78.6%, 特异度为89.3%。对不同生物标志物的ROC曲线进行比较, ALT和AST的AUC最大, 但两者比较差异无统计学意义(P>0.05);GR的AUC次于ALT和AST, 但优于TBIL和ALP, 比较差异均具有统计学意义(P<0.05);TBIL和ALP的AUC较差, 两者比较差异无统计学意义(P>0.05)。将阳性组研究对象按GR活性水平四分位数间距(Q)进行分层:ALT和AST活性水平均随GR活性水平的升高而升高(P<0.05), 在Q1~Q2区间内升高较缓(P>0.05), 在Q3~Q4区间内迅速升高(P<0.05);TBIL和ALP在Q1~Q3区间内趋势不显著(P>0.05), 仅有Q4与其他层级相比有显著升高(P<0.05);年龄未显示出明显的趨势(P>0.05)。一般认为, 当肝损伤时, 只要1%的肝细胞发生坏死, 血清ALT活性水平即急剧升高, 是最敏感的肝源性生物标志物。而本研究分层结果提示, 当肝损伤发生时, 血清GR活性水平升高可能更早于ALT和AST, 因为当GR活性水平变化显著时, 血清ALT和AST活性水平尚未出现显著性变化。而TBIL和ALP则相对更加滞后。该现象可能与这些活性酶的释放机制有关:GR与ALT和AST一样, 在肝损伤初期, 细胞膜通透性增强时, 自肝细胞释放至血清中;而ALP经胆管排泄, 肝损伤时, 肝细胞对其摄取发生功能异常, 从而使ALP在脂膜上渗析进入血液循环。
综上所述, 在乙型肝炎病程中, 血清GR活性水平升高与肝损伤显著相关, 相比传统生物标志物ALT和AST, 在时效性上更具优势, 检测血清GR活性水平可以作为辅助诊断、治疗各类肝病、评估肝损伤程度的方法。但需要指出的是, 本研究仅采用了最具代表性的“大三阳”型乙型肝炎患者作为研究对象, 未考虑其他肝脏疾病类型, 需在后续研究中进一步验证其临床价值。
参考文献
[1] Xiao J, Wang F, Wong N, et al. Global liver disease burdens and research trends: analysis from a Chinese perspective. J Hepatol, 2019(71):212-221.
[2] Hou X, Ye F, LI X, et al. Immune response involved in liver damage and the activation of hepatic progenitor cells during liver tumorigenesis. Cell Immunol, 2018(326):52-59.
[3] Deponte M. Glutathione catalysis and the reaction mechanisms of glutathione-dependent enzymes. BBA-Gen Subjects, 2013, 1830(5):3217-3266.
[4] Couto N, Wood J, Barber J. The role of glutathione reductase and related enzymes on cellular redox homoeostasis network. Free Radical Bio Med, 2016(95):27-42.
[5] Poprac P, Jomova K, Simunkova M, et al. Targeting free radicals in oxidative stress-related human diseases. Trends Pharmacol Sci, 2017, 38(7):592-607.
[6] Rall TW, Lehninger AL. Glutathione reductase of animal tissues. J Bio Chem, 1952, 194(1):119-130.
[7] Backer E. Glutathione reductase from baker's yeast and beef liver. J Bio Chem, 1955, 217(2):855-866.
[8] Delides A, Spooner RJ, Goldberg DM, et al. Delides A, An optimized semi-automatic rate method for serum glutathione reductase activity and its application to patients with malignant disease. J Clin Pathol, 1976, 29(1):73-77.
[9] Kumata H, Wakui k, Suzuki H, et al. Glutathione reductase activity in serum and liver tissue of human and rat with hepatic damage. Tohoku J Exp Med, 1975, 116(2):127-132.
[10] Koruk M, Taysi S, Cemil Savas M, et al. Oxidative stress and enzymatic antioxidant status in patients with nonalcoholic steatohepatitis. Ann Clin Lab Sci, 2004, 34(1):57-62.
[11] Iskusnykh IY, Popova TN, Agarkov AA, et al. Expression of glutathione peroxidase and glutathione reductase and level of free radical processes under toxic hepatitis in rats. J Toxicol, 2013(2013):870628.
[12] Ivanov AV, Bartosch B, Smirnova OA, et al. HCV and oxidative stress in the liver. Viruses, 2013, 5(2):439-469.
[13] Hopkins FG, Elliott KAC. The relation of glutathione to cell respiration with special reference to hepatic tissue. Proc R Soc B, 1932, 109(760):58-88.
[14] Zhu Z, Du S, Du Y, et al. Glutathione reductase mediates drug resistance in glioblastoma cells by regulating redox homeostasis. J Neurochem, 2017, 144(1):93-104.
[15] Pashkov AN, Popov SS, Semenikhina AV, et al. Glutathione system state and activity of some NADPH-producing enzymes in rats liver under melatonin action at norm and toxic hepatitis. Bull Exp Biol Med, 2005, 139(5):520-524.
[16] 李淑麗, 陆善词, 王军, 等. 表观健康成人血清谷胱甘肽还原酶参考区间的建立. 检验医学, 2019, 34(10):908-912.
[收稿日期:2020-01-17]
