MDA-MB-231细胞在乏氧条件下通过外泌体传递miR-221、miR-222增强乳腺癌细胞侵袭和迁移能力
2020-04-20秦爱伟于梦雨盖程程李文通吕世军
秦爱伟,于梦雨,盖程程,李文通,吕世军
乳腺癌是女性常见的恶性肿瘤,且发病率和病死率均逐年增高,肿瘤转移是导致癌症死亡的主要原因[1]。肿瘤由于细胞快速分裂和异常血管形成而出现严重乏氧,肿瘤乏氧通常与患者预后不良有关[2]。miR-221和miR-222是X染色体上2个高度同源的miRNA,有研究表明,miR-221、miR-222在ER阴性乳腺癌细胞系明显上调[3-4]。外泌体是一种细胞分泌的直径40~100 nm的微小囊泡,囊泡中含有的核酸可作为信号分子传递给其他细胞,该过程在肿瘤的生长和转移中起重要作用[5-6]。乏氧细胞可能通过外泌体将miR-221、miR-222传递给其他细胞,进而增强肿瘤细胞的侵袭和迁移能力。本文对MDA-MB-231细胞进行乏氧处理,检测其侵袭和迁移,着重探讨乳腺癌细胞MDA-MB-231在乏氧条件下分泌的外泌体对肿瘤细胞侵袭和迁移的影响。
1 材料与方法
1.1 材料细胞:人三阴型乳腺癌细胞系MDA-MB-231,购自上海细胞生物研究所。试剂:RPMI 1640培养基、胎牛血清、胰蛋白酶购自美国Hyclone公司;一抗:β-actin、CD81、TSG101、E-cadherin、N-cadherin和vimentin购自Abcam公司;二抗:鼠、兔二抗购自Abcam公司;Pierce ECL化学发光液购自美国Thermo公司;PKH26购自上海懋康生物公司;细胞凋亡-Hoechst染色试剂盒购自碧云天生物研究所;BCA试剂盒和MTT购自美国Sigma公司;miR-221、miR-222抑制剂(分别为221i和222i)和Lipofectamine 2000,均购自美国Invitrogen公司。
1.2 方法
1.2.1MDA-MB-231细胞乏氧处理 正常对照组在37 ℃、5%CO2的湿化培养箱中培养。MDA-MB-231细胞置于低氧培养箱中,使细胞暴露于持续低氧(0.1% O2)条件下,其他条件与对照组细胞相同。
1.2.2外泌体的提取及鉴定 提取外泌体前,用无血清培养基培养细胞48 h。采用差速离心法分离外泌体,分别以300g×10 min、1 000g×20 min、10 000g×30 min的速度从上清液中去除细胞碎片和大泡。然后以100 000g的速度离心1 h,纯化并收集外泌体。用透射电镜和动态光散射对外泌体进行表征。用RIPA裂解缓冲液裂解外泌体,Western blot法检测提取的外泌体中TSG101和CD81蛋白的表达。
1.2.3外泌体摄取 为了观察MDA-MB-231细胞对外泌体的摄取情况,MDA-MB-231细胞种于6孔板(2×105个/孔)中,采用亲脂荧光染料PKH26对外泌体进行染色,然后透析去除游离染料,加入孔中,孵育4 h后,PBS洗涤细胞3次,用荧光显微镜观察。
1.2.4敲除miR-221、miR-222 采用添加10%胎牛血清的RPMI 1640培养基,将MDA-MB-231细胞接种于6孔板中。采用Lipofectamine 2000转染细胞,每孔使用等量的anti-miR-221、anti-miR-222或anti-miR对照。6 h后,培养基改为添加2%胎牛血清的RPMI 1640。转染后24 h或48 h收集细胞,用于后续分析。
1.2.5细胞划痕实验 将MDA-MB-231细胞接种于6孔板培养液中,培养至80%。用200 μL无菌枪头在孔中央创建划痕,然后用PBS冲洗脱落细胞。在实验组中加入乏氧处理细胞的外泌体,然后在0 h和48 h评估细胞迁移情况。
1.2.6Transwell侵袭实验 将对照组和实验组细胞进行胰酶消化和细胞计数,上腔室涂Matrigel基质胶,将300 μL MDA-MB-231细胞悬液(1×105个/孔)接种于上室,下室加入500 μL含10% 胎牛血清的RPMI 1640培养基,置于37 ℃培养24 h,用4%多聚甲醛固定细胞,0.1%结晶紫染色。然后对侵入下层的细胞进行计数。
1.2.7qRT-PCR 使用Trizol试剂按照试剂盒说明书从细胞中提取总RNA,采用7500 RT-PCR系统,对MDA-MB-231细胞miR-221、miR-222的表达进行检测。GAPDH作为miR-221、miR-222的内源性对照,PCR引物序列如下。GAPDH(正义链):5′-TTGTCAAGCTCGTTTCTTGGT-3′;GAPDH(反义链):5′-CCTAGTCTCCATGGTCTCACT-3′。 miR-221(正义链):5′-ACACTCCAGCTGGGAGCTACATTGTCTGCT GG-3′;miR-221(反义链):5′-CTCAACTGGTGTCGTG GA-3′。 miR-222(正义链):5′-ACACTCCAGCTGGG AGCTACATCTGGCTACTG-3′; miR-222(反义链):5′-CTCAACTGGTGTCGTGGA-3′。
1.2.8Western blot法 将细胞裂解后,采用BCA法检测蛋白浓度,并将其浓度调至相同水平。用10%聚丙烯酰胺凝胶电泳分离裂解产物,并将凝胶印迹转移PVDF膜上。将膜置于5%脱脂奶粉中封闭;分别与E-cadherin、N-cadherin和vimentin的一抗(1 ∶1 000)杂交,4 ℃过夜孵育。置于二抗中室温孵育2 h,ECL显色,以β-actin(1 ∶4 000)为内参对条带进行灰度值分析。
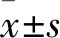
2 结果
2.1 外泌体鉴定和细胞摄取动态光散射分析显示外泌体的平均直径为(80.69±18.11) nm(PDI为0.419),透射电镜结果显示外泌体形态为具有膜结构的囊泡,与动态光散射测定的外泌体大小相似(图1A)。Western blot结果显示,外泌体中不含β-actin,说明外泌体没有被细胞器污染;与细胞裂解液相比,外泌体中TSG101和CD81特异标志物更丰富,证实分离的颗粒为外泌体(图1B)。
本实验将PKH26标记的外泌体加入MDA-MB-231细胞中,4 h后结果显示被标记的外泌体(红色荧光颗粒)已被细胞摄取(图1C)。

图1 外泌体鉴定和细胞摄取:A.动态光散射检测的外泌体大小和分布及透射电镜下外泌体的形态;B.Western blot测定外泌体中TSG101和CD81蛋白表达;C.MDA-MB-231细胞对PKH26标记外泌体的摄取情况
2.2 乏氧处理增强MDA-MB-231细胞迁移和侵袭能力MDA-MB-231细胞通过乏氧处理后,其迁移能力(图2)和侵袭(图3)有所增强。
2.3 乏氧细胞分泌的外泌体加速肿瘤细胞EMTWestern bolt结果显示乏氧肿瘤细胞来源的外泌体,显著上调MDA-MB-231细胞中N-cadherin和vimentin的表达,同时我们量化了EMT相关生物学标志物E-cadherin、N-cadherin和vimentin水平的变化(图4)。
2.4 乏氧细胞释放外泌体转运miR-221、miR-222促进肿瘤细胞EMT采用qRT-PCR验证miR-221、miR-222在乏氧肿瘤细胞和正常肿瘤细胞之间的差异表达,乏氧细胞中的miR-221、miR-222相对于正常肿瘤细胞有所增加;应用miR-221和miR-222反义抑制剂的Lipofectamine 2000敲除内源性miR-221和miR-222,结果显示:降低乏氧肿瘤细胞内miR-221、miR-222的表达(图5)。敲除miR-221、miR-222的乏氧细胞迁移和侵袭能力有所减弱,而加入敲除miR-221、miR-222的乏氧细胞外泌体后,MDA-MB-231细胞的迁移(图6)和侵袭(图7)能力并无明显改变。

图2 细胞划痕实验检测MDA-MB-231细胞经乏氧处理后的迁移能力:A.常氧组(0 h);B. 乏氧组(0 h);C.常氧组(48 h);D. 乏氧组(48 h)
图3 Transwell侵袭实验检测MDA-MB-231细胞经乏氧处理后的侵袭能力:A.常氧组,B.乏氧组

图4 Western blot法加入乏氧肿瘤细胞分泌的外泌体后MDA-MB-231细胞中EMT相关蛋白(E-cadherin、N-cadherin和vimentin)的表达:A.电泳图;B.柱状图

图5 miR-221、miR-222在不同处理后的表达
3 讨论
乳腺癌是最常见的恶性肿瘤之一,其发病率逐年上升,三阴型乳腺癌是一种特殊类型的乳腺癌,其特征是ER、PR以及HER-2表达均缺失。与ER、PR和HER-2均阳性乳腺癌相比,三阴型乳腺癌预后较差[7]。肿瘤的预后差可能是由于肿瘤细胞在乏氧状态下,更易发生抗肿瘤免疫[8],并且肿瘤转移前可在某些特定器官和组织构建转移前肿瘤微环境,外泌体通过传递信息影响靶细胞的功能,参与上述过程的调控[9]。外泌体是一种能够被大部分细胞所分泌的微小囊泡,可将细胞内的物质传递出去;除传递miRNA外,还可以递送多种物质,如蛋白质、脂类、DNA、mRNA等,并通过信息传递,在癌细胞与微环境之间发挥作用[10-11]。

图6 MDA-MB-231细胞迁移:A.加入空白Lipofectamine 2000(0 h);B.加入miR-221、miR-222抑制剂(0 h);C.加入空白Lipofectamine 2000(48 h);D.加入miR-221、miR-222抑制剂(48 h);E.空白对照组(0 h);F.加入敲除miR-221和miR-222的肿瘤细胞外泌体(0 h);G.空白对照组(48 h); H.加入敲除miR-221和miR-222的肿瘤细胞外泌体(48 h) 图7 MDA-MB-231细胞的侵袭:A.加入空白Lipofectamine 2000;B.加入miR-221、miR-222抑制剂;C.空白对照组;D.加入敲除miR-221和miR-222后的肿瘤细胞外泌体
本实验检测MDA-MB-231细胞在乏氧条件下产生的外泌体对肿瘤细胞EMT的影响。结果表明,乏氧促进肿瘤细胞的侵袭和迁移。同时,本组发现在乏氧条件下MDA-MB-231细胞产生的外泌体也促进肿瘤细胞的EMT进展。miR-221和miR-222是X染色体上2个高度同源的miRNA,它们具有相同的种子序列,并充当1个基因簇(miR-221、miR-222)[12]。miR-221、miR-222的过表达发生于大多数上皮性肿瘤中[13]。miR-221、miR-222在ER阴性乳腺癌细胞系和原发肿瘤组织中表达上调[14]。本实验分析miR-221、miR-222对乳腺癌细胞的作用机制,其中PTEN作为抑癌基因已被确定为miR-221、miR-222的直接靶点[15-16]。本实验对MDA-MB-231细胞进行乏氧培养,发现其迁移和侵袭能力明显增强,随后检测细胞中miR-221、miR-222表达水平,发现乏氧培养的MDA-MB-231细胞中miR-221、miR-222水平显著上调。我们将乏氧MDA-MB-231细胞中的miR-221、miR-222沉默,发现细胞的迁移和侵袭明显减弱,提示miR-221、miR-222对乏氧肿瘤细胞的迁移和侵袭有促进作用。将乏氧MDA-MB-231细胞分泌的外泌体加入未做乏氧处理的肿瘤细胞共培养,发现肿瘤细胞的迁移和侵袭明显增强,提示外泌体所携带的miR-221、miR-222能够提高肿瘤细胞的迁移和侵袭能力。
本实验结果表明乏氧培养MDA-MB-231细胞分泌的外泌体可通过转运miR-221、miR-222促进肿瘤细胞的迁移和侵袭,miR-221、miR-222促进三阴型乳腺癌细胞的存活、迁移和侵袭,有望成为三阴型乳腺癌新的治疗靶点。
