肺神经内分泌肿瘤中INSM1的表达及其临床意义
2020-04-20章如松夏秋媛周晓军
程 凯,章如松,王 璇,魏 雪,夏秋媛,沈 勤,周晓军,饶 秋
胰岛素瘤相关蛋白1(insulinoma-associated protein 1, INSM1)是一种具有锌指结构域的转录因子,在多种组织的神经内分泌分化中起重要作用[1-2]。最近有研究表明,INSM1在神经内分泌肿瘤中高表达,可以作为神经内分泌肿瘤的鉴别诊断标志物[3-6]。目前各研究结果尚存在一定的差异,且缺乏中国大陆人群的数据报道。因此,本文采用手工免疫组化EnVision两步法检测肺小细胞癌、大细胞神经内分泌癌、肺类癌等组织中INSM1的表达,并与传统的神经内分泌标志物进行对比分析,以期进一步明确INSM1在临床病理诊断中的价值。
1 材料与方法
1.1 材料收集2010~2018年中国人民解放军东部战区总医院(原南京军区南京总医院)病理科存档的石蜡包埋标本196例,包括肺小细胞癌26例,大细胞神经内分泌癌23例,肺类癌23例,肺腺癌72例,肺鳞癌52例。所有标本均行HE染色,并且经本院两位高年资病理医师确诊。
1.2 主要试剂一抗:鼠抗人单克隆抗体INSM1购自Santa Cruz公司(稀释度1 ∶300);即用型单抗Syn、CgA、CD56,均购自北京中杉金桥公司。HRP标记的鼠兔通用型二抗及DAB显色液均购自DAKO公司。
1.3 免疫组化免疫组化染色采用EnVision两步法,3~4 μm厚石蜡切片经脱蜡,水化,行高温高压抗原修复(10%柠檬酸盐抗原修复缓冲液,pH 6.0);每张切片滴加50 μL一抗,4 ℃孵育过夜,PBS冲洗;滴加50 μL EnVision试剂,室温下孵育30 min;PBS冲洗,DAB显色,苏木精衬染。
1.4 结果判读INSM1阳性定位于细胞核,Syn和CgA阳性定位于细胞质,CD56阳性定位于细胞质和细胞膜,>1%的肿瘤细胞着色即判读为阳性。
1.5 统计学分析采用STATA 12.0软件进行统计学分析,并采用Graphpad 7.0制图,P<0.05为差异有统计学意义。采用χ2检验分析INSM1在不同类别肿瘤中的表达差异,采用确切概率法分析INSM1与传统抗体的敏感性和特异性的差异,采用Kappa一致性检验分析4 ℃和37 ℃免疫组化检测INSM1表达的一致性。
2 结果
2.1 INSM1在肺肿瘤组织中的表达本实验从整体分析INSM1在肺神经内分泌肿瘤与肺腺癌和肺鳞癌中表达的差异。INSM1在神经内分泌肿瘤中呈较强的细胞核着色,在个别肺腺癌和肺鳞癌中呈较弱的细胞核着色。72例肺神经内分泌肿瘤(包括肺小细胞癌、大细胞神经内分泌癌和肺类癌)中有63例表达INSM1,总阳性率为87.5%,在肺腺癌中的阳性率约为2.8%,在肺鳞癌中的阳性率为1.9%。INSM1在肺神经内分泌肿瘤中的阳性率高于肺腺癌和肺鳞癌(P<0.000 1,表1,图1)。

表1 肺神经内分泌肿瘤、肺腺癌与肺鳞癌中INSM1的表达
2.2 INSM1与传统神经内分泌标志物敏感性比较本实验发现,INSM1在肺小细胞癌中敏感性为88.5%,与Syn以及CD56相同,显著高于CgA(P=0.026 6,图2A);INSM1在肺大细胞神经内分泌癌中的敏感性为78.3%,与Syn以及CD56相似,显著高于CgA(P=0.015 6,图2B);INSM1在肺类癌中的敏感性为95.6%,与Syn、CgA、CD56差异无统计学意义(P>0.999,图2C)。在同一病例中,INSM1和Syn及CD56的表达较一致,未发现互补作用。此外,INSM1在肺小细胞癌、大细胞神经内分泌癌和肺类癌中的敏感性,差异无统计学意义(P>0.05,表2)。
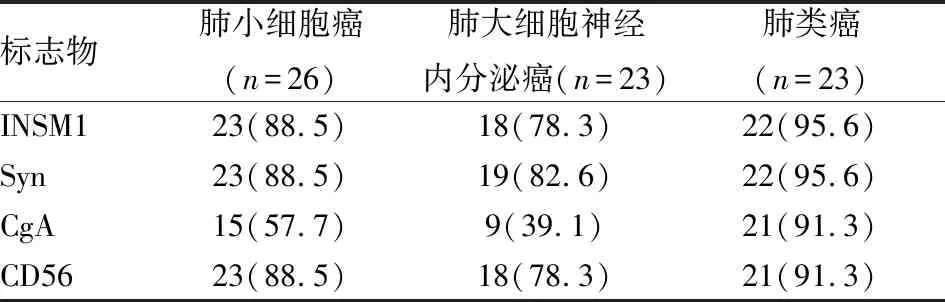
表2 INSM1与传统神经内分泌标志物敏感性比较[n(%)]
敏感性=真阳性例数/真阳性例数+假阴性例数
2.3 INSM1与Syn、CgA和CD56在肺腺癌和肺鳞癌中的特异性比较本组实验检测72例肺腺癌和52例肺鳞癌中INSM1、Syn、CgA和CD56的表达。肺腺癌和肺鳞癌合计124例,其阳性率分别约为2.4%、8.9%、0.8%和11.3%。本实验结果显示:INSM1、Syn、CgA和CD56在肺神经内分泌肿瘤诊断中的特异性分别为97.6%、91.1%、99.2%和88.7%。INSM1的特异性显著高于CD56(P=0.01),与Syn和CgA差异无显著性(P=0.051,P=0.622,表3)。

图1 A.INSM1在肺小细胞癌中的表达,EnVision两步法;B.INSM1在肺大细胞神经内分泌癌中的表达,EnVision两步法;C.INSM1在典型肺类癌中的表达,EnVision两步法;D.INSM1在非典型肺类癌中的表达,EnVision两步法;E.ISNM1在肺腺癌中的表达,EnVision两步法;F.INSM1在肺鳞癌中的表达,EnVision两步法

图2 A.INSM1、Syn、CgA及CD56在肺小细胞癌中的表达;B.INSM1、Syn、CgA及CD56在肺大细胞神经内分泌癌中表达;C.INSM1、Syn、CgA及CD56在肺类癌中的表达

表3 INSM1、Syn、CgA和CD56在肺腺癌和肺鳞癌中的特异性比较
*表示INSM1组与其他各组单独比较的结果P值;特异性=真阴性例数/真阴性例数+假阳性例数
2.4 INSM1的实验条件在4 ℃孵育一抗过夜,INSM1在肺小细胞癌、肺大细胞神经内分泌癌和肺类癌中的阳性率分别为88.5%、78.3%和95.6%。另采用37 ℃ 1 h孵育一抗,结果发现INSM1在肺小细胞癌、肺大细胞神经内分泌癌和肺类癌中的阳性率为84.6%、52.2%和30%。在4 ℃孵育过夜条件下,INSM1阳性率高于37 ℃ 1 h。对两种实验条件的检测结果进行一致性分析发现,肺小细胞癌中两者的一致性较好(κ=0.835 4),肺大细胞神经内分泌癌和低级别神经内分泌癌中的一致性较差(κ=0.286 8,κ=0.039 0)。
3 讨论
神经内分泌肿瘤是一组异质性较大的上皮源性肿瘤,可以表现为惰性的生物学行为,早期也可发生转移,迅速播散。其共同特征为神经和内分泌分化,如具有分泌颗粒、突触样囊泡和分泌氨基酸或肽类激素等[7]。近期,哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂依维莫司,经美国食品药品管理局批准用于晚期或进展期、分化好的无功能性神经内分泌肿瘤的治疗,包括肺神经内分泌肿瘤[8]。更多的药物临床实验也在进行中。因此,对肺神经内分泌肿瘤的精准诊断,成为临床病理工作的重点。肺神经内分泌肿瘤包括典型类癌、非典型类癌、小细胞癌和大细胞神经内分泌癌以及特发性弥散性神经内分泌细胞增生,占全部肺肿瘤的15%~20%[9]。从形态学特征分析,神经内分泌癌与肺腺癌和肺鳞癌有较大差异,而对于某些低分化癌,单纯依据形态学难以鉴别。免疫组化染色能够提供较大帮助。目前,临床工作中通常开展Syn、CgA、CD56及TTF1用以鉴别肺神经内分泌肿瘤;但是一部分神经内分泌肿瘤不表达神经内分泌的相关标记。因此,结合已经发表的相关研究结果,本实验采用免疫组化EnVision两步法探讨INSM1在肺肿瘤中的表达模式,以期明确其临床病理诊断价值。

作者检测INSM1在196例肺肿瘤中的表达定位于细胞核,而传统的神经内分泌抗体(Syn、CgA和CD56)呈细胞质或细胞膜着色。因此,INSM1比传统的神经内分泌标志物更容易判读。在72例肺神经内分泌肿瘤中,63例可见INSM1阳性,阳性率为87.5%。在肺腺癌和肺鳞癌中只有个别出现弱阳性染色。在不进行统计分析的情况下,即可看出表达差异。本组纳入的72例神经内分泌肿瘤,包含26例小细胞癌,23例大细胞神经内分泌癌,13例非典型类癌和10例典型类癌。依据预后及生物学行为,本实验将非典型类癌和典型类癌合并为低级别神经内分泌肿瘤进行统计学分析。INSM1、Syn和CD56在小细胞癌中的敏感性均为88.5%,均显著高于CgA。在大细胞神经内分泌肿瘤中,INSM1的敏感性和CD56相同,略低于Syn,但是显著高于CgA。在肺类癌中,四者差异无显著性。此外,INSM1的特异性显著高于CD56,与CgA相似。虽然本实验中INSM1的特异性和Syn差异无显著性,INSM1在肺腺癌和肺鳞癌中的阳性率低于Syn,本组结论和Mukhopadhyay等的研究结果较为一致;但是在实验条件相似的情况下,Mukhopadhyay等在肺大细胞神经内分泌癌中得到的阳性率(75%,18/24)低于Rooper等的研究结果(91.3%,21/23)。因此,本组结果更倾向于样品本身的异质性引起实验结果的差异。每项实验均检测20余例样本,数量尚少,因此也可能出现结论不一致。本组结果认为INSM1在大细胞神经内分泌癌中的阳性率为78.3%(18/23),虽然敏感性低于小细胞癌,但是与Syn的敏感性并无差异。
值得一提的是,以往研究多采用全自动免疫组化染色平台进行制片。但是,国内还有一定数量的医院或第三方检测机构未引进全自动免疫组化染色平台。因此,我们采用手工免疫组化染色法开展实验。结果显示,手工染色结果与以往多数文献报道的数据相似。在37 ℃ 1 h孵育一抗,INSM1在肺小细胞癌、肺大细胞神经内分泌癌和肺类癌中的阳性率为84.6%、52.2%和30%;显著低于4 ℃过夜孵育一抗INSM1的阳性率。进一步行一致性分析发现,两种检测条件下,肺小细胞癌的一致性较好(κ=0.835 4),肺大细胞神经内分泌癌和低级别神经内分泌癌中的一致性较差(κ=0.286 8,κ=0.039 0)。有文献报道一抗室温孵育1 h和4 ℃过夜相比,其阳性细胞表达效果欠佳,可能由于抗原抗体结合不够充分[20]。抗原和抗体的结合反应需要在最佳条件(如反应时间、反应温度、抗体浓度等)下才能较好结合,单纯的加快反应速度可能无法达到化学反应终点。因此,37 ℃的条件下孵育一抗可能在一定程度上降低INSM1的检测敏感性,在临床工作中应慎用。
INSM1在胎儿发育过程中高表达,在胎儿出生后表达迅速下降,发育成熟的器官几乎检测不到INSM1[10]。当肿瘤形成后,INSM1又恢复表达。因此,INSM1与肿瘤关系也是值得探讨的问题。如:(1)INSM1是否在肿瘤形成的过程中起关键调控作用?(2)是否与患者预后相关?(3)是否成为新的治疗靶点?本组采用的标本是近几年的病例,随访时间较短,未讨论INSM1的表达和患者预后的相关性。McColl等[21]研究认为,INSM1阴性的肺小细胞癌患者无瘤生存期明显缩短,不表达INSM1的小细胞癌细胞系会出现化疗抵抗,提示INSM1和肺小细胞癌患者的预后相关。Chen等[22]认为音猬因子(sonic hedgehog, SHH)信号通路通过N-myc和Ascl1激活INSM1的表达,INSM1能够进一步通过SHH通路增强N-myc的稳定性。联合选用多种不同的SHH信号通路抑制剂靶向抑制INSM1和N-myc,有可能是肺小细胞癌新的治疗选择。
本实验中INSM1在同一病例中未发现与Syn及CD56有互补作用。检索相关文献,亦未见相关报道。但是鉴于神经内分泌肿瘤类型较多,本组检测标本有限,有必要在后续的实验中加大样本量进一步探讨该问题。
总之,INSM1是一种较为可靠的肺神经内分泌肿瘤标志物,其敏感性和Syn及CD56相似,特异性与CgA无明显差异。因此,INSM1可以作为传统神经内分泌肿瘤标志物的补充标记;甚至作为神经内分泌肿瘤鉴别诊断的一线抗体单独使用,以减少组织样本的用量并节约检测成本[17]。由于INSM1是细胞核着色抗体,在某些情况下(如细胞量少、存在广泛坏死、标本挤压等)比胞质着色抗体更易判读。但是INSM1免疫组化染色的研究尚属早期,INSM1与Syn、CD56等标志物是否有互补作用尚需进一步分析,后期需进一步扩大样本数量以及样本类型,以明确INSM1在神经内分泌肿瘤中的表达模式。
