阿帕替尼联合TACE治疗原发性肝癌有效性和安全性meta分析
2020-04-20沈艳峰侯峰岩段小婷
陈 成,沈艳峰,董 云,侯峰岩,段小婷
原发性肝癌(primary liver cancer,PLC)是我国常见恶性肿瘤。目前肝动脉介入治疗如经导管动脉灌注化疗(transcatheter arterial chemo-injection,TAI)、经导管动脉栓塞术(transcatheter arterial embolization,TAE)、经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE),是治疗无法手术切除的中晚期肝癌常用方法,主要通过减少、阻断肿瘤血供使肿瘤缺血、缺氧坏死。新型血管生成抑制剂甲磺酸阿帕替尼(apatinib mesylate,简称阿帕替尼)通过与血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)-2结合,竞争性抑制其与血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)结合,进而抑制肿瘤VEGF增殖、迁徙和管腔形成,并影响肿瘤细胞代谢周期,促进其凋亡。近年有较多文献报道阿帕替尼联合TACE治疗PLC不仅取得了满意效果,而且未明显增加TACE术后不良反应。本研究采用meta分析方法总结国内外多篇随机对照试验(randomized controlled trial,RCT)文献,评价阿帕替尼联合TACE治疗PLC的有效性和安全性,以期提供循证医学依据,指导临床应用。
1 材料与方法
1.1 文献检索
两名本研究者单独采用计算机检索PubMed、Cochrane library、NCKI、万方、维普(VIP)数据库,然后合并检索结果。文献类型:阿帕替尼联合TACE(实验组)/单纯 TACE(对照组)治疗PLC的RCT研究文献,无论是否采用盲法/分配隐藏。检索时限:2015年1月1日至2019年5月1日。采用“题名/关键词”进行检索,中文检索词:肝癌(原发性肝癌、肝细胞癌、肝肿瘤),肝动脉化疗栓塞(经导管肝动脉碘油化疗栓塞术、TACE、TAE),阿帕替尼。英文检索词:hepatocellular carcinoma、hepatic carcinoma、liver cancer、liver neoplasms、HCC、TACE、apatinib、transcatheter arterial chemoembolization。
1.2 文献纳入和排除标准
纳入标准:①患者年龄25~85岁,性别不限,均经血清甲胎蛋白(AFP)、影像学(彩色超声、CT、MR、DSA)检查或肝穿刺活检病理证实为PLC;②无手术切除适应证,但有行TACE 适应证,无禁忌证;③Karnofsky功能状态(KPS)评分≥60,预计生存时间>2个月;④有多组病例构成,只选择所需两组,其组间均衡性好,具可比性。排除标准:①干预措施为非阿帕替尼联合TACE与TACE比较;②非RCT研究;③文献属综述、非临床报道、病例报道、重复文献、无评价指标、会议摘要。
1.3 治疗和研究方法
TACE:改良Seldinger技术经股动脉穿刺,穿刺插管成功后分别行肝动脉、肠系膜上动脉及其分支造影,明确肝内肿瘤位置、具体形态和供血情况等,结合患者具体情况确定灌注化疗药物剂量和栓塞药物剂量,常用灌注化疗药物为蒽环类药物、5-FU、奥沙利铂、洛铂等,栓塞剂为碘化油辅以明胶海绵或三丙烯明胶微粒(embosphere)等,术后常规行保肝、止吐、护胃等对症支持治疗。阿帕替尼服用方法:TACE第1次治疗后第3或4日开始服用,起始剂量250 mg/d或500 mg/d,饭后30 min口服,用药期间视患者耐受情况调整剂量;若耐受良好或有轻度不良反应可维持原剂量,若出现明显不良反应则减量继续观察或停药观察;下一周期治疗前第3或4日停药,一般不超过1个月。血液采集:采集患者治疗前后晨起空腹静脉血4 mL,静置30 min,3 000 r/min离心10 min(离心半径8 cm)分离血清待检。
1.4 结局评价指标
①疗效评定标准:参照WHO制定的肿瘤客观疗效评价标准进行评价,可分为完全缓解(CR)、部分缓解(PR)、无变化(SD)、进展(PD),其中近期疗效包括客观缓解率(ORR)和疾病控制率(DCR),ORR=(CR+PR)/总病例数 ×100%,DCR=(CR+PR+SD)/总病例数×100%。②血清AFP含量检测:采用化学发光法,以全自动免疫分析仪检测。③VEGF和基质金属蛋白酶(MMP)-9含量检测:采用酶联免疫法。④所有患者随访6个月或12个月。⑤不良反应指标:患者栓塞后综合征(肝区疼痛、食欲下降、发热、恶心呕吐),药物不良反应(手足综合征、高血压、蛋白尿、腹泻、皮疹、乏力、瘙痒、口腔黏膜炎、血细胞减少)等,参照WHO抗癌药物不良反应分度标准判定。
1.5 文献中资料提取和质量评价
两名评价员按照Cochrane 系统评价手册(5.0版)中RCT质量评价标准,独立对检索所得所有文献进行资料提取、质量评价并交叉核对,存在分歧时通过讨论或由第三者决定是否纳入。纳入文献通过“偏倚风险评估”工具进行质量评价:①随机分配法选择;②是否做到分配方案隐藏;③对研究对象、治疗方案实施者、研究结果测量者是否采取盲法;④结果数据完整性;⑤选择性报告研究结果;⑥其他偏倚来源。针对每项研究结果,对以上6条作出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的判断。文献质量分为A、B、C 3级:A级完全符合上述6条质量标准,即为“正确或充分”者(偏倚较小);B级至少1条不符合质量标准,即为“部分满足”者(偏倚中等); C级完全不符合以上质量标准(偏倚较大)。
1.6 统计学方法
采用RevMan 5.3软件对有效数据进行meta分析。对纳入研究以Chi2检验作异质性分析,若纳入研究间不存在明显异质性(P≥0.1,I2≤50%),采用固定效应模型,反之则采用随机效应模型;计数资料以比值比(OR)表示,计量资料以标准化均数差(SMD)表示,各效应量均以95%可信区间(CI)表示;纳入文献以漏斗图法评估发表偏倚;所有纳入指标均为双侧检验。P<0.05表示差异有统计学意义。
2 结果
2.1 文献检索结果
通过检索数据库,先阅读文章题目和摘要,排除重复文献、综述、基础实验、非RCT及不符合纳入标准等文献,初步筛选出可能符合标准的14篇文献;阅读全文后排除3篇(无相关指标1篇,干预措施不符1篇,数据存在问题1篇)。最终纳入11篇文献(10篇有近期疗效观察指标,1篇缺乏近期疗效指标,仅作AFP分析),共720例患者,其中阿帕替尼联合TACE组(实验组)、TACE组(对照组)患者分别为363例、357例。
2.2 文献基本特征和质量评价
纳入文献11篇均为实验组与对照组比较文献,其基本特征见表1。11篇中6篇提及随机分组,3篇为回顾性分析,2篇未描述;均未提及失访和退出病例,均未提及分配隐藏、盲法、意向性分析情况。11篇中评为B级6篇,C级5篇,见表2。
2.3 meta分析结果
纳入文献中有10篇文献[1-10]报道的实验组与对照组治疗PLC相比较的ORR(P=0.93,I2=0%)和DCR(P=0.65,I2=0%)不存在明显异质性;固定效应模型分析显示,两组治疗PLC相比较的ORR(OR=3.26,95%CI=2.22~4.79,P<0.001)和DCR(OR=3.72,95%CI:2.51~5.52,P<0.001)显著提高(图1);漏斗图分析显示ORR和DCR图形分布对称性好,提示本研究结果受发表偏倚影响较小(图2)。其中有 2 篇文献[3,10]分别分析 3、6、12 个月两组治疗PLC 相比较的ORR和DCR,结果显示均无明显异质性,3个月内差异均无统计学意义,而6、12个月内差异均有统计学意义(图3)。
纳入文献中分别有 2 篇[4,9]、4 篇[4,7-9]报道了6、12个月肝癌患者生存率情况,各研究间均无统计学异质性(6个月P=0.94,I2=0%;12个月P=0.98,I2=0%);固定效应模型分析显示,实验组与对照组相比明显提高患者生存率(6个月OR=2.89,95%CI=1.36~6.15,P=0.006;12个月 OR=3.06,95%CI=1.69~5.53,P=0.000 2),见图 4。
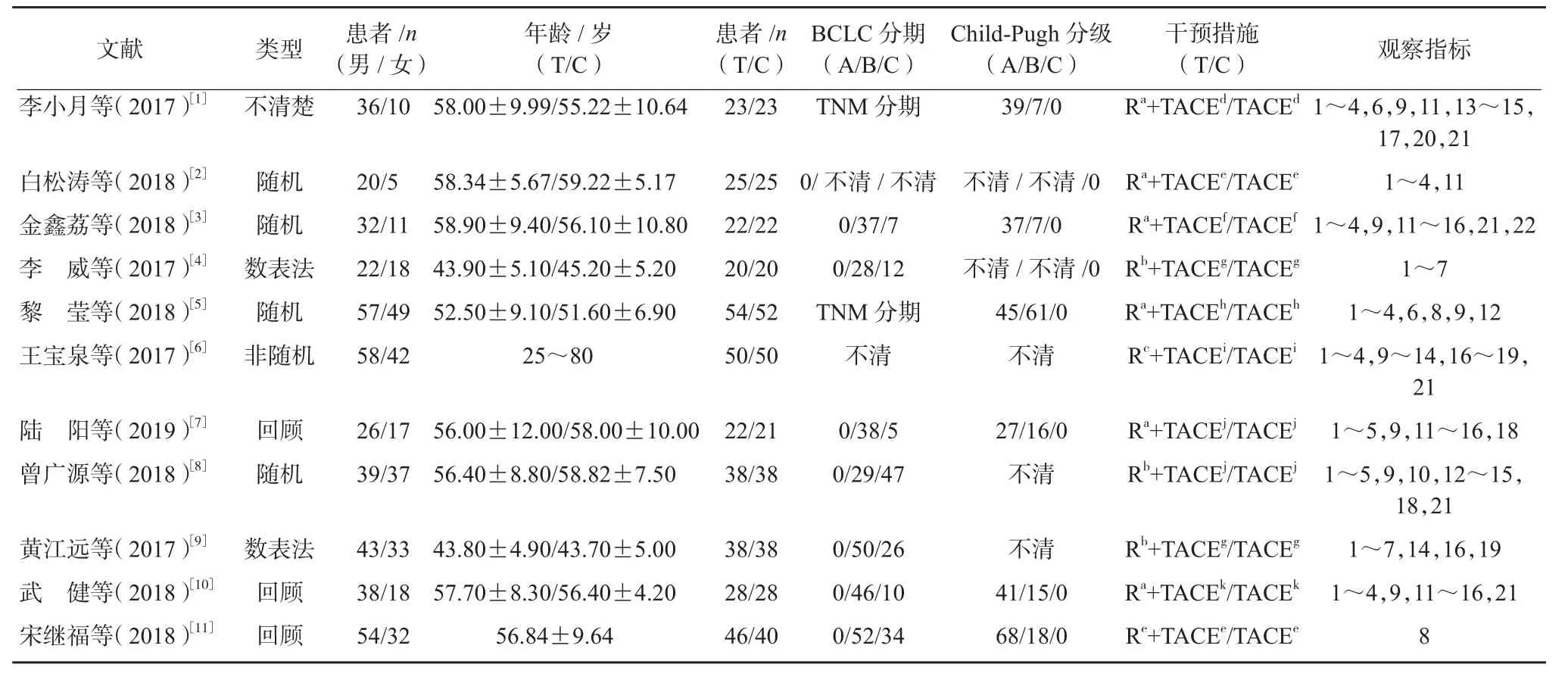
表1 纳入文献基本特征

表2 纳入文献质量评价

图1 实验组与对照组ORR和DCR比较

图2 实验组与对照组ORR和DCR比较漏斗图

图3 实验组与对照组3、6、12个月ORR和DCR比较
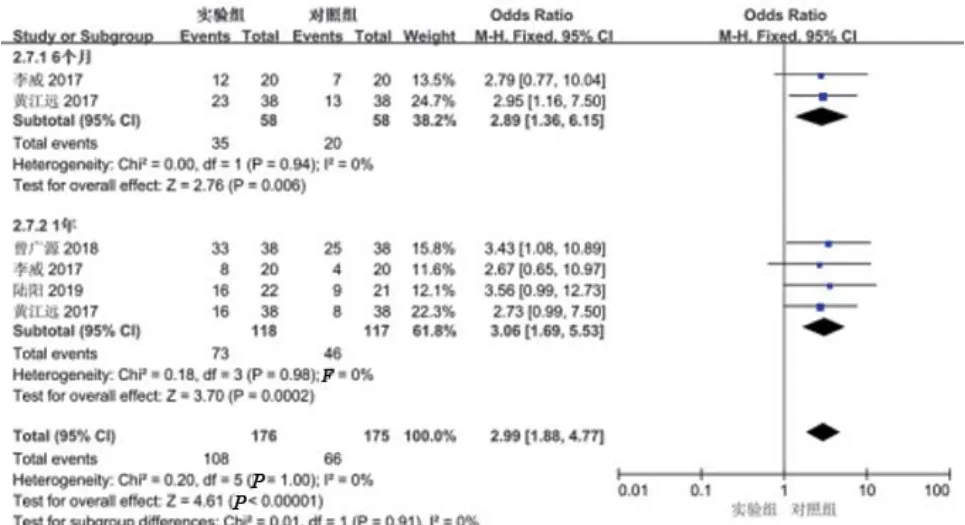
图4 实验组与对照组患者生存率比较
纳入文献中有2篇[4,9]报道了实验组与对照组治疗PLC相比较的MMP-9水平,研究间均无异质性。固定效应模型分析显示,两组间治疗前差 异 无 统 计 学 意 义(OR=-0.00,95%CI=-0.37~0.36,P=0.98),治疗后差异有统计学意义(OR=-2.56,95%CI=-3.05~-2.06,P<0.001);两组各治疗前后差异均有统计学意义(实验组OR=3.92,95%CI-3.29~4.56,P<0.001;对 照 组 OR=1.34,95%CI=0.93~1.74,P<0.001),见图 5。
纳入文献中有 4 篇[1,4-5,9]报道了实验组与对照组治疗PLC相比较的VEGF值,除治疗前无异质性,各研究间均有明显异质性。随机效应模型分析显示,两组间治疗前差异无统计学意义(OR=0.05,95%CI=-0.18~0.29,P=0.65),治疗后差异有统计学意义(OR=-3.59,95%CI=-6.0~1.14,P=0.004);两组各治疗前后差异有统计学意义(实验组OR=4.76,95%CI=2.17~7.34,P=0.001;对照组OR=1.11,95%CI=0.08~2.14,P=0.03),见图 6。
纳入文献中有2篇[5,11]报道了实验组与对照组治疗PLC相比较的AFP值,两组治疗前后均无异质性,固定效应模型分析显示两组间治疗前差异无统计学意义(OR=-0.00,95%CI=-0.28~0.28,P=0.99),治疗后差异有统计学意义(OR=-0.69,95%CI=-0.99~-0.40,P<0.001);但两组各治疗均有明显异质性,随机效应模型分析显示两组各治疗前后差异有统计学意义(实验组 OR=5.19,95%CI=2.70~7.68,P<0.001;对照组 OR=4.42,95%CI=1.56~7.27,P=0.002),见图7。
纳 入 研 究 中 分 别 有 7 篇[1,3,5-8,10]、2 篇[6,8]、6篇[1-3,6-7,10]、6 篇[3,5-8,10]文献报道了两组相比较的术后肝区疼痛、食欲下降、发热、恶心呕吐数据,各研究间均无明显异质性。固定效应模型分析显示,两组术后栓塞后综合征差异均无统计学意义(P>0.05),见图8。

图5 治疗前后MMP- 9比较

图6 治疗前后VEGF比较

图7 治疗前后AFP比较

图8 两组术后栓塞后综合征比较
纳 入 研 究 中 分 别 有 6 篇[1,3,6-8,10]、3 篇[6-8]、2 篇[6,9]、7 篇[1,3,6-10]、5 篇[1,3,7-8,10]、5 篇[3,6-7,9-10]、2篇[1,6]、2 篇[1,3]、5 篇[1,3,6,8,10]文献报道了两组相比较的药物不良反应(手足综合征、乏力、瘙痒、高血压、蛋白尿、腹泻、皮疹、口腔黏膜 炎、血细胞减少)数据。两组在手足综合征、乏力、瘙痒、高血压方面存在明显异质性,随机效应模型分析显示两组手足综合征、高血压差异有统计学意义(P<0.05),乏力、瘙痒发生率差异无统计学意义(P>0.05);各研究间均无明显异质性,固定效应模型分析显示,实验组蛋白尿、腹泻、皮疹发生率均明显高于对照组(P<0.01),口腔黏膜炎、血细胞减少发生率差异无统计学意义(P>0.30),见图9。

图9 两组药物不良反应比较
3 讨论
肝癌是我国常见消化道恶性肿瘤之一,发病率、死亡率均较高。其发病隐匿,发现时已属中晚期,手术切除率仅为20%左右,且对全身化疗不敏感,疗效差。肝肿瘤血流75%~80%来自肝动脉,TACE为中晚期肝癌最有效治疗方式[12-13]。有研究表明,TACE通过减少、阻断肿瘤血供有效地破坏肝主瘤及子灶,近期疗效显著,但也会产生一些问题:①诱导VEGF生成,促使门静脉供血和侧支循环建立,难以使肿瘤全部坏死,可能有癌细胞残存,从而促进肿瘤转移、复发和扩散,影响远期疗效;②也有可能存在术后肝区疼痛、肝功能异常,伴随一些栓塞后综合征如发热、恶心呕吐等,以及骨髓抑制如白细胞减少、血红蛋白减少、血小板减少等不良反应,进而影响患者生活质量[14]。因此,探讨在不增加患者不良反应和提升生活质量情况下提高TACE疗效的联合治疗方法,具有临床意义。
VEGF在人体正常细胞和肿瘤细胞均能产生,其基因组位于人类基因组6p21.3位,据估计约有30多个单核苷酸多态性,其中VEGF-2578C/A和VEGF-1154G/A的多态性与肿瘤大小、分期密切相关,同时与HCC患者生存时间成反比[15]。VEGF有两种酪氨酸激酶受体[16],即VEGFR-1和VEGFR-2,其中VEGFR-2主要表达于血管内皮细胞,在调节血管生成、细胞增殖和VEGF弥散中发挥重要作用,因此VEGFR-2被认为与肿瘤血管生成关系最为密切[17-18]。也有研究表明,VEGFR和RAS-Raf-MEKERK、P13K-AKT-mTOR等信号转导通路在HCC组织中均高表达,提示VEGF和VEGFR介导的信号转导通路在调控肿瘤血管生成过程中发挥重要作用[19]。
阿帕替尼化学名称为N-[4-(氰基环戊基)苯基][2-[(4-吡啶甲基)氨基](3-吡啶)]甲酰胺甲磺酸盐,分子式为C25H27N503S,分子量为493.58。其作为我国独立自主研发、拥有自主知识产权的一种小分子VEGFR-2酪氨酸激酶抑制剂,可高度选择性地与VEGFR-2结合,以竞争性抑制VEGF与VEGFR-2结合及其后者的自动磷酸化,以及下游ERKl/2-MAPK、P13K-AKT-mTOR信号转导通路活化,并可引起细胞周期抑制蛋白p21、p27上调,细胞素Cyclin B1、Cdc2下调,阻滞细胞周期于G2/M期,抑制肿瘤新生血管生成,从而影响肿瘤生长[20]。阿帕替尼治疗过程中常见不良反应包括血液学毒性(粒细胞减少、血小板减少、白细胞减少和凝血功能异常等)和非血液学毒性(高血压、蛋白尿、手足皮肤反应、乏力及恶心、呕吐、腹泻等)。有研究证明,阿帕替尼对多种人类肿瘤如结肠癌、肺癌,裸小鼠移植瘤有显著抑瘤作用,也可增强多西他赛、奥沙利铂、阿霉素和5-Fu等细胞毒性药物的疗效[21]。Lin等[22]研究显示,阿帕替尼可明显抑制小鼠肝癌H22皮下移植瘤生长,且抑制作用呈现明显的剂量依赖性。姜增凯等[23]研究表明,阿帕替尼对人肝癌HepG2系肿瘤细胞增殖、移行愈合率有明显抑制作用,且随着药物浓度增加其抑制作用增强,也可上调p53、caspase-3、caspase-8基因表达,促进细胞凋亡。Peng等[24]研究显示,肝内胆管细胞癌组织中VEGF和磷酸化VEGFR-2与正常肝组织相比明显增多,阿帕替尼可明显促进试管内细胞凋亡和抑制活体内异体瘤细胞生长,提示阿帕替尼是通过抑制自分泌VEGF信号通路抑制抗细胞凋亡细胞生长而发挥作用。
近年来阿帕替尼联合TACE与单纯TACE治疗PLC的对比研究文献较多,但样本量均较小,因此本研究通过meta分析方法收集阿帕替尼联合TACE与TACE治疗无法行手术治疗的中晚期PLC临床RCT文献,旨在总结阿帕替尼联合TACE治疗PLC的有效性和安全性。本研究按纳入和排除标准筛选文献后共纳入11篇RCT文献(共720例患者),均为干预措施为阿帕替尼联合TACE组与TACE比较的文献,可行漏斗图分析,结果显示对称较好,提示发表偏倚较小。Meta分析结果显示,术后3个月阿帕替尼联合TACE组治疗患者ORR、DCR、生存率均明显优于TACE组,差异有统计学意义,提示阿帕替尼联合TACE治疗可显著提高患者远期疗效,延长生存期;无论两组各治疗前后还是两组间比较,治疗后患者血清中VEGF、MMP-9、AFP表达水平均有明显降低,其中联合治疗组尤为明显,表明联合治疗可显著降低患者肿瘤标志物水平,降低复发、转移可能;在栓塞后综合征(肝区疼痛、食欲下降、发热、恶心呕吐)方面,两术式差异无统计学意义;在药物不良反应方面,联合治疗会显著增加手足综合征、高血压、蛋白尿、腹泻、皮疹发生率,不增加乏力、瘙痒、口腔黏 膜炎、血细胞减少发生率。
综上所述,本研究表明阿帕替尼联合TACE治疗PLC在有效性,生存期,降低AFP、VEGF、MMP-9表达水平方面均优于单纯TACE治疗,但会适当增加一些不良反应,提示联合治疗可显著提高PLC患者远期疗效和生存期,降低复发和转移,其不良反应尚可耐受;同时,为临床治疗中晚期PLC提供新的循证医学证据,也为大样本量多中心随机对照前瞻性临床研究提供理论基础,以便进一步增强论证强度、明确结论,从而指导临床治疗。
猜你喜欢
——评《卵巢恶性肿瘤诊疗手册》
