用冶金级氢氧化铝制备高纯氢氧化铝及氧化铝
2020-04-20郑继明李思佳耿继业李义兵赵解扬苏积波
郑继明,李思佳,耿继业,李义兵,赵解扬,苏积波
(1.桂林理工大学 材料科学与工程学院,广西 桂林 541000;2.百色百矿集团有限公司,广西 百色 533000)
高纯氧化铝粉体具有普通氧化铝无法比拟的光、电、磁、热和机械性能,在高技术新材料领域和现代工业中有着广泛应用[1]。目前,国内外生产高纯氧化铝的方法有多种,较常用的有醇铝水解法[2]、硫酸铝铵热解法[3]、碳酸铝铵热解法[4]、改良拜耳法[5]等,这些方法生产工艺较复杂,成本较高。目前国内生产企业主要采用烧结法或铝酸钠重溶法。
杂质钠、硅、铁严重影响氧化铝质量,目前工业上一般采用含钙物质作为脱杂剂进行深度脱硅、铁。脱杂剂主要有氧化钙、氢氧化钙、碳酸钙和铝酸钙,但这些物质脱硅效果相对较差,深度脱硅时加入量较大,会造成氧化铝损失过大[6-7]。新型铝酸盐类脱硅剂,如水合铝酸钙(C3AH6)、水合碳铝酸钙(HCAC)及水滑石类化合物,可显著提高脱硅效果[8-9]。目前,制备高纯氧化铝脱钠的方法主要有常压洗涤法、热法处理法、中高温焙烧酸洗除碱法及添加剂高温脱钠法,直接利用高温水热法脱钠可以实现深度脱钠,且对设备要求不高,成本低,污染环境小[10-12]。
试验以CaO和Ca-Al水滑石为脱杂剂,研究不同条件下氧化铝的脱杂效果;将脱杂后的铝酸钠溶液进行晶种分解得到氢氧化铝,对种分产物在不同条件下进行水热脱钠处理再经煅烧,制备高纯氧化铝产品。
1 试验部分
1.1 试验原料
试验所用氧化铝由中铝广西分公司(平果铝厂)提供,白度为79%,用氢氧化钠溶液溶解得铝酸钠溶液,溶液苛性比为1.47,溶液中杂质成分为SiO2(0.08 g/L)、Fe2O3(0.02 g/L)。
脱杂剂Ca-Al水滑石由实验室合成[13],分子式为3CaO·Al2O3·CaCl·10H2O。其余试剂均为分析纯。水为高纯水(电导率为0.056 S/cm)。
1.2 试验原理与方法
取一定体积铝酸钠溶液于塑料烧杯中,按一定比例加入脱杂剂CaO或Ca-Al水滑石,在恒温水浴中进行反应,一定时间后过滤,滤液计量体积并分析溶液中的硅、铁浓度变化。试验考察不同条件对脱杂的影响。
选择最佳的脱杂条件进行深度脱杂,得到铝酸钠溶液通过晶种分解得到Al(OH)3。首先利用不同溶液淋洗,干燥后分析产物中的杂质洗涤效果。为实现深度脱钠,试验采用水热处理,将Al(OH)3放入水热反应釜中,选择高纯水和弱酸溶液作为洗涤液,液固体积质量比为5∶1,一定温度下水热反应一定时间后过滤,滤饼用热水洗涤3~4次,洗涤后于80 ℃干燥4 h,分析产物中杂质含量及物相,最后将水热产物煅烧得到氧化铝产品。
1.3 分析方法
采用钼蓝光度法和邻菲罗啉光度法测定铝酸钠溶液及种分产品中SiO2、Fe2O3含量,采用火焰原子吸收光谱法测定产品中Na2O含量,而游离钠离子采用ICP-AES测定。以X射线粉末衍射仪(X,Pert PRO)进行样品物相分析,以扫描电镜(S-4800)对比观察样品形貌变化。试验以SiO2及Fe2O3浓度变化来衡量脱硅效果。
2 试验结果与讨论
2.1 各因素对脱杂的影响
2.1.1 CaO用量对脱杂的影响
量取100 mL铝酸钠溶液于250 mL塑料烧杯中,Na2O、Al2O3质量浓度分别为170、190 g/L,反应温度90 ℃,搅拌加热时间2 h,以CaO为脱杂剂进行除杂。CaO加入量对杂质脱除率的影响试验结果如图1所示。
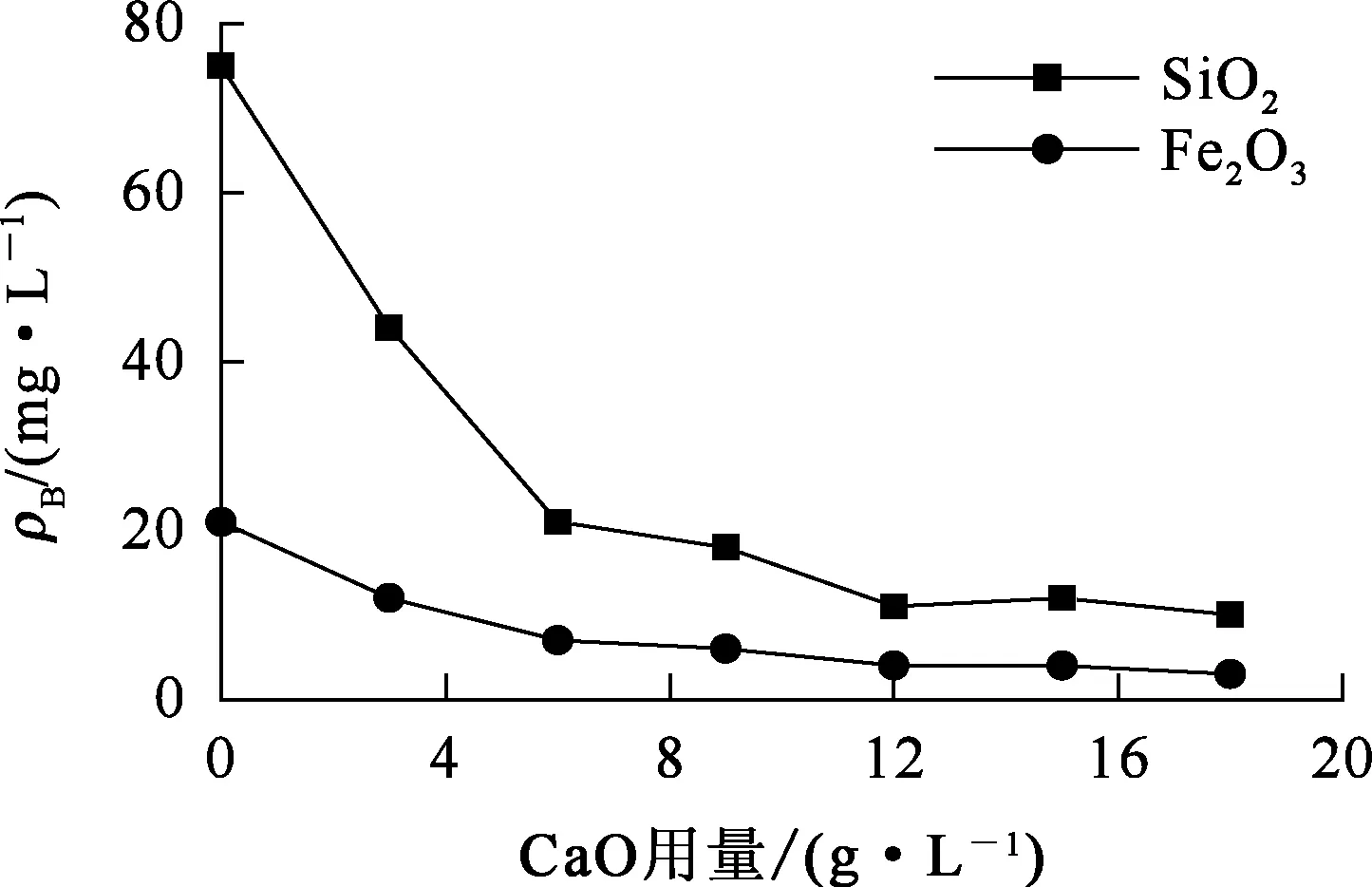
图1 CaO用量对脱杂的影响
由图1看出:随CaO用量增加,溶液中硅、铁质量浓度均降低;CaO质量浓度增至12 g/L时,溶液中SiO2质量浓度为0.011 g/L,Fe2O3质量浓度为0.004 g/L。继续增加CaO用量,杂质质量浓度变化较小,而过量的CaO会造成氧化铝的损失,因此,试验确定CaO用量以10~12 g/L为宜。
2.1.2 Ca-Al水滑石用量对脱杂的影响
铝酸钠溶液100 mL,Na2O、Al2O3质量浓度分别为170、190 g/L,反应温度90 ℃,搅拌加热时间2 h,以合成Ca-Al水滑石为脱杂剂进行除杂。Ca-Al水滑石用量对杂质脱除率的影响试验结果如图2所示。
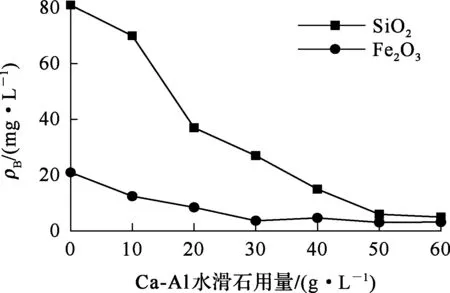
图2 Ca-Al水滑石用量对脱杂的影响
由图2看出:水滑石用量越大,除杂效果越好,水滑石用量为50 g/L时,溶液中SiO2质量浓度为3 mg/L,Fe2O3质量浓度为2 mg/L。与CaO相比,水滑石具有更好的脱杂效果;但水滑石用量较大,不适于工业生产。
2.1.3 混合脱杂剂对脱杂的影响
铝酸钠溶液100 mL,Na2O、Al2O3质量浓度170、190 g/L,反应温度90 ℃,搅拌加热时间2 h,采用混合脱杂剂进行除杂。首先加入10 g/L CaO,再加入不同量的水滑石实现深度除杂,试验结果如图3所示。
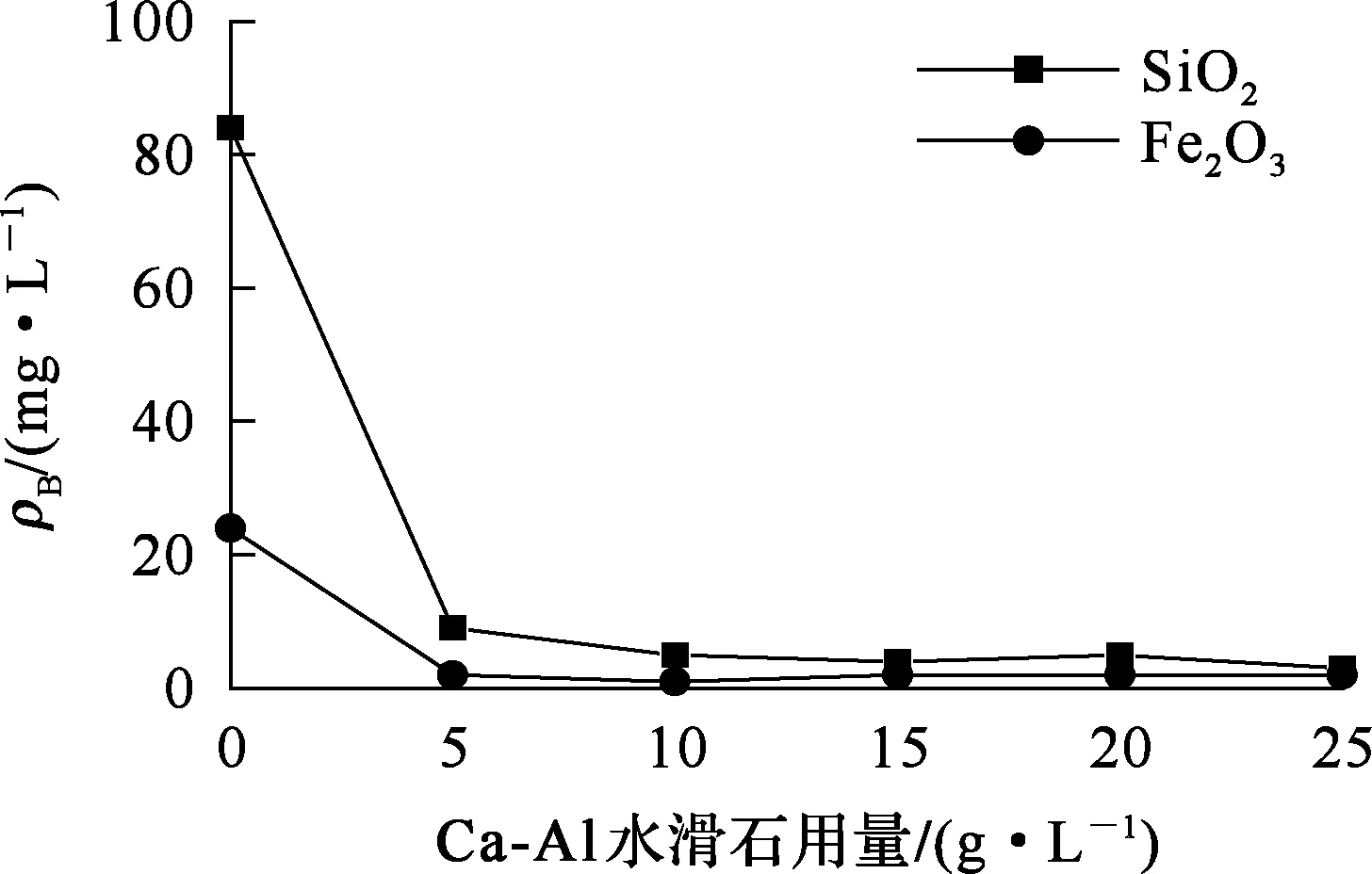
图3 混合脱杂剂对脱杂的影响
由图3看出,混合脱杂剂具有较好的除杂效果:在CaO加入量为10 g/L、水滑石加入量为10 g/L时,除杂效果最佳,此时,溶液中SiO2质量浓度为5 mg/L,Fe2O3质量浓度为2 mg/L。与单一除杂剂相比,混合脱杂剂用量较少且能够实现深度除杂,由此避免了CaO过量造成氧化铝的损失和Ca-Al水滑石用量较大的弊端。
2.1.4 Na2O质量浓度对脱杂的影响
铝酸钠溶液100 mL,Na2O、Al2O3质量浓度170、190 g/L,按比例稀释改变溶液浓度,CaO质量浓度12 g/L,反应温度90 ℃,反应时间2 h,Na2O质量浓度对杂质脱除率的影响试验结果如图4所示。

图4 Na2O质量浓度对脱杂的影响
由图4看出,Na2O质量浓度的降低有利于除杂。这主要是由于随苛性碱质量浓度降低,溶液黏度降低,有利于扩散反应进行;但苛性碱浓度过低会使种分效率降低。综合考虑,苛性碱质量浓度不宜过低,适当降低即可。
2.1.5 反应温度对脱杂的影响
铝酸钠溶液100 mL,Na2O质量浓度150 g/L,Al2O3质量浓度167.6 g/L,在CaO用量为10 g/L、水滑石用量10 g/L条件下反应2 h,反应温度对杂质脱除率的影响试验结果如图5所示。

图5 反应温度对脱杂的影响
由图5看出:反应温度在60~100 ℃范围内,温度越高,除杂效果越好,最佳温度为80~90 ℃。这是因为温度越高,体系黏度越低,扩散层厚度变小,反应速率常数增大,有利于反应进行。
2.2 种分产物深度脱钠及成分分析
2.2.1 不同洗涤条件对脱钠的影响
除杂后的铝酸钠溶液经过晶种分解得到氢氧化铝产品,产品白度可达98%以上。产品用高纯水和乙醇溶液洗涤5次,干燥后分析其成分。再称取氢氧化铝10 g多份放入不同反应釜中,分别加入50 mL高纯水、5%HCl溶液,在200 ℃下水热反应2 h,所得产物成分分析结果见表1。
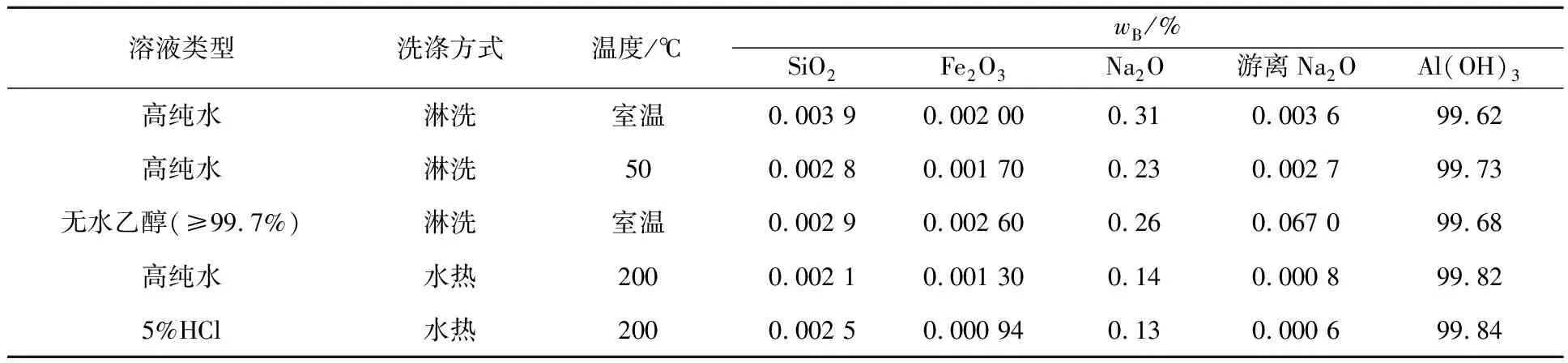
表1 不同洗涤条件下所得产物的成分
由表1看出:不同溶液淋洗结果相差不大,种分氢氧化铝中SiO2和Fe2O3质量分数都低于0.003%;但普通淋洗只能将表面游离的Na2O洗去,而包裹及晶间的Na2O则无法脱除,其质量分数在0.2%左右。不同溶液水热处理后,Na2O质量分数都明显降低,这是因为热处理可破坏氢氧化铝晶格,削弱或破坏片层间氢键,使三水铝石(Al(OH)3)脱水转变为一水铝石(AlO(OH)),晶粒间Na2O也被重新溶解,从而降低产物中Na2O质量分数而提高氢氧化铝纯度。
2.2.2 水热反应时间对Na2O质量分数的影响
氢氧化铝分别采用高纯水、5%HCl溶液进行水热处理,水热温度200 ℃,试验条件与2.2.1相同,不同水热反应时间条件下所得产物的成分见表2。

表2 不同水热反应时间条件下所得产物的成分
由表2看出,氢氧化铝经2种溶液水热处理后都可实现深度脱钠:延长水热反应时间,产物中Na2O质量分数均显著降低,但SiO2和Fe2O3质量分数变化不大;水热反应4 h,产物中Na2O质量分数分别降至0.028%、0.037%,继续延长水热反应时间,产物中Na2O质量分数变化不大,此时晶间Na2O基本释放。试验确定最佳水热反应时间为4 h。
种分氢氧化铝及不同溶液水热处理4 h后所得产物的XRD图谱如图6所示。可以看出:种分产物为高纯三水铝石;经高纯水、5%HCl溶液水热处理4 h后产物的XRD图谱变化明显,二者的产物相同,都由三水铝石转变为高纯一水铝石。水分子的极性较强,容易进入三水铝石晶格;酸性溶液中的水的极性更强,三水铝石层面间的氢键更容易断裂,水热过程中迅速脱水而转变为一水铝石。在三水铝石物相转变过程中,包裹及晶间Na2O重新溶解,使产品中Na2O质量分数快速降低。

a—种分Al(OH)3;b—5%HCl水热处理Al(OH)3后的产物;c—高纯水水热处理Al(OH)3后的产物。
2.2.3 不同条件下水热产物的微观形貌
种分氢氧化铝及不同溶液水热处理4 h后所得产物的SEM照片如图7所示。

a—种分Al(OH)3;b—高纯水水热处理Al(OH)3后的产物;c—5%HCl水热处理Al(OH)3后的产物。
由图7(a)看出:种分氢氧化铝呈假六方片型,片层状物质在不同空间位置堆叠,且片层间由于存在氢键而结合牢固,因此,深度脱钠需较高的水热温度。由图7(b)看出:在200 ℃下,采用高纯水水热处理氢氧化铝4 h后的产物结构均为四方体形,尺寸大小不一,不存在六方结构,表明水热过程反应完全,晶型转变彻底,晶体变化为Na2O含量变化的主要原因。由图7(c)看出:在200 ℃下,采用5%HCl水热处理4 h后的产物晶粒表面粗糙疏松,结构不规则,这可能是水热过程中弱酸与氢氧化铝发生反应,破坏了产物晶体结构,使其水热产物干燥后发生板结而成块状形式存在的缘故。
2.2.4 煅烧产物成分及微观形貌
种分氢氧化铝在200 ℃下与高纯水水热反应4 h,在650、1 150 ℃下分别煅烧2、4 h,升温速率为5 ℃/min,煅烧产物成分见表3,不同温度条件下煅烧4 h所得产物的XRD图谱如图8所示,SEM照片如图9所示。由表3看出:煅烧温度和煅烧时间仅对产品中灼碱质量分数产生影响;煅烧温度越高,时间越长,灼碱挥发越多,产物中灼碱含量越低;其他杂质含量变化不大。可见,最终氧化铝产品质量取决于脱杂及水热脱钠过程。
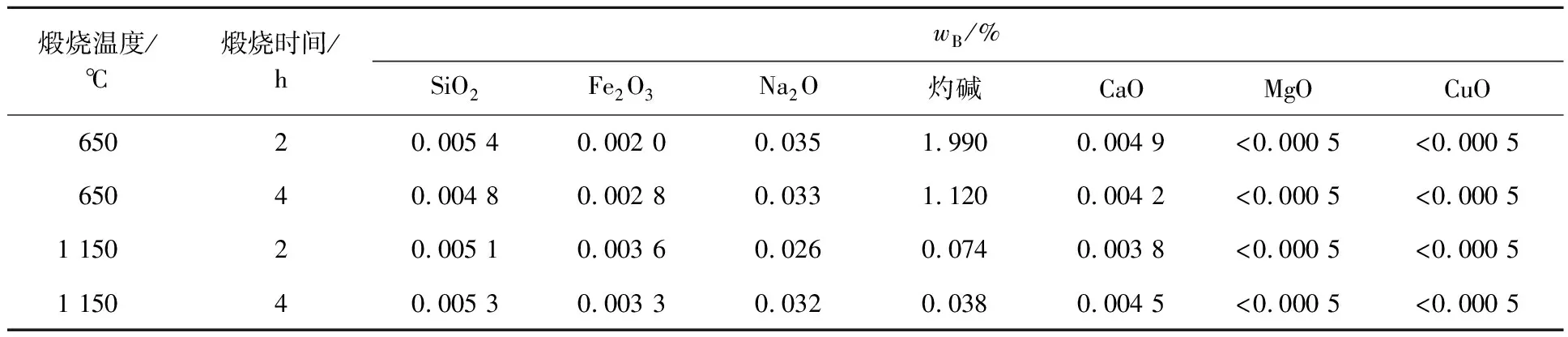
表3 煅烧产物的成分
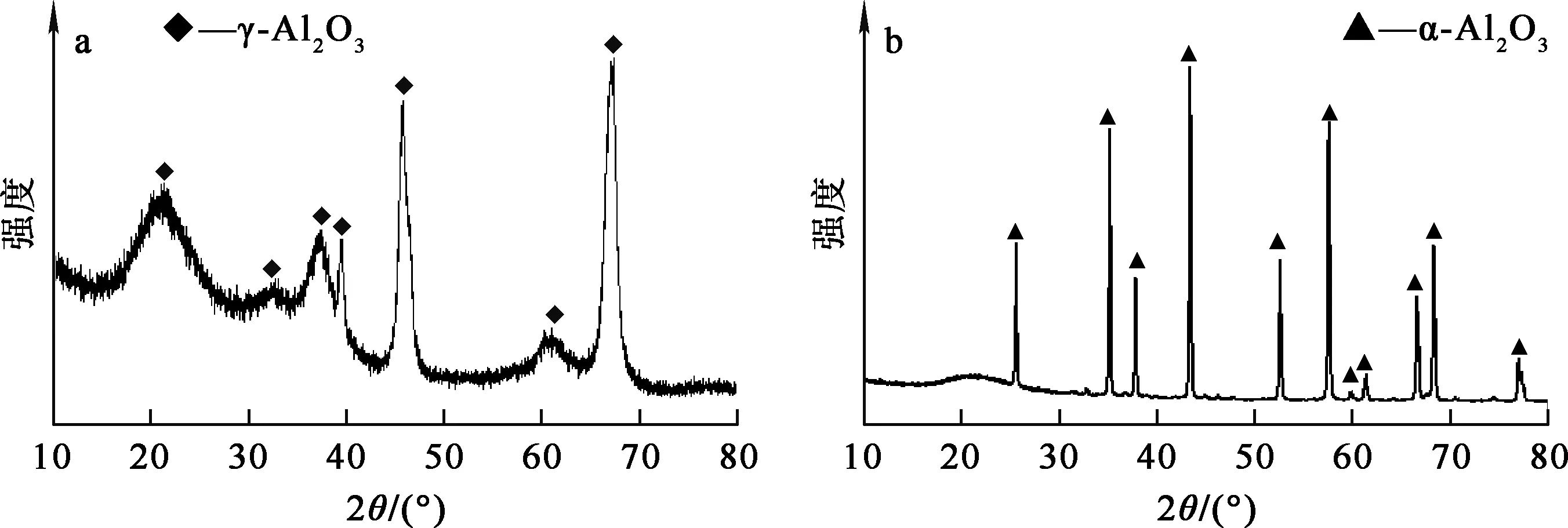
a—650 ℃;b—1 150 ℃。
由图8看出:在650 ℃下煅烧可脱除全部结构水,获得γ-Al2O3,此时氧化铝结构不稳定;而在1 150 ℃下高温煅烧,产物为α-Al2O3,结晶度更完整,结晶水含量更少。

a—650 ℃;b—1 150 ℃。
由图9看出:650 ℃下的煅烧产物与水热反应产物形貌(图7(b))均为四方体形,形貌基本相同;而温度升至1 150 ℃后,煅烧产物仍为四方体形,形貌变化不大,但晶粒边缘部分融化,棱角平滑,且因水分迅速挥发使颗粒表面产生大量孔洞。
3 结论
氢氧化铝重溶后,以CaO和Ca-Al水滑石为脱杂剂,均可实现铝酸钠溶液深度净化。温度为80~90 ℃,CaO和Ca-Al水滑石用量均为10 g/L时,SiO2、Fe2O3质量分数都降至2 mg/L以下,脱杂效果最佳;适当降低Na2O质量浓度有利于脱杂。
脱杂后种分得到的三水铝石中,SiO2、Fe2O3质量分数降至0.003%以下,可满足高纯氢氧化铝的要求。但通过淋洗无法深度脱钠,Na2O质量分数仍保持在0.2%~0.3%之间,经过水热处理,Na2O质量分数显著降低,200 ℃下可降至0.02%左右。
水热反应使三水铝石转变为一水铝石,形貌由六方晶系变为四方晶系,晶体更加细小杂乱。弱酸溶液可使三水铝石溶解,进而破坏产物晶体结构。水热产物通过高温煅烧得到氧化铝产品,650 ℃下煅烧得到形貌相同的γ-Al2O3,而1 150 ℃下煅烧得到多孔、棱角平滑的α-Al2O3;煅烧温度越高,煅烧时间越长,灼碱质量分数越低。
