不同微生物菌剂组合处理对芳樟生长和精油积累的影响
2020-04-20黄秋良杨先吉罗佳佳刘酉琳袁宗胜张国防
黄秋良, 杨先吉, 罗佳佳, 刘酉琳, 袁宗胜, 张国防,①
(1. 福建农林大学林学院, 福建 福州 350002; 2. 闽江学院海洋研究院, 福建 福州 350108)
芳樟醇(C10H18O)为无色液体,具有铃兰香气,被大量用于香化工业、医药、国防、化工和香料等行业[1-2]。天然芳樟醇具有独特的风味和旋光特征,是化学合成的芳樟醇无法匹及的,天然芳樟醇的市场需求量较大、价格较高,为目前国际市场上非常紧缺的商品[2-3]。芳樟(Cinnamomumcamphoravar.linalooliferaFujita)是樟树〔Cinnamomumcamphora(Linn.) Presl〕的一个生化变种,富含芳樟醇[4]。提高芳樟精油含量是发展高产量和高品质芳樟油料林的重要基础。
微生物菌剂又称微生物菌肥,简称菌肥,对植物生长发育有利,其中的大量微生物可分解土壤中的有机物或无机元素,或者分泌细胞激动素和生长类激素等代谢产物,从而促进植物生长[5];这些微生物还可通过分泌代谢物质直接或间接影响宿主植物的代谢途径,进而影响宿主的生理特性和生长发育[6-7]。另外,微生物菌剂还是新型农业的理想肥料,既能提高作物的产量和品质,又能节约化肥使用成本、减少环境污染、减轻病害[8-9]。目前,关于芳樟微生物菌剂的施肥试验主要集中在复合施肥方面[9-13],但复合微生物菌剂的成分较复杂,无法准确判断单一微生物菌剂对芳樟生长和精油含量的影响,并且,各微生物菌剂对芳樟生长和精油含量影响的互作效应也不清楚。有效解决上述问题就能明确利于芳樟生长和精油高产的最佳微生物菌剂施用量,对于芳樟精油产业发展具有重要意义。
鉴于此,作者采用四元二次回归正交旋转组合设计(1/2实施)对不同水平褐球固氮菌(AzotobacterchroococumBeijerinck)、巨大芽孢杆菌(Bacillusmagateriumde Bary)、胶冻样芽孢杆菌(B.mucilaginosusKrassilnikov)和枯草芽孢杆菌(B.subtilisCohn)组合处理下芳樟叶和枝的鲜质量及其比值、精油含量及精油产量进行了比较研究,以4种微生物菌剂的施用量为自变量(X)、精油产量为因变量(Y)进行了回归方程拟合分析和显著性检验,并对影响芳樟精油产量的微生物菌剂进行了单因子效应分析,以期确定适宜芳樟精油生产的最佳微生物菌剂组合方案,为合理开发和有效利用微生物菌剂提高芳樟精油产量提供参考资料。
1 试验地概况和研究方法
1.1 试验地概况
试验地设在福建农林大学妙峰山苗圃地育苗大棚(自然光照)内,具体地理坐标为东经118°08′~120°31′、北纬25°15′~26°29′,属亚热带海洋性气候,气候温和,雨量充沛。
1.2 材料
选取永安种苗中心苗圃内长势均匀的芳樟195号无性系1年生扦插苗(平均苗高25.22 cm,平均地径3.03 mm)作为研究对象。供试微生物菌剂包括褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌,均来自沧州旺发生物技术研究所。以苗圃地旁的黄心土为盆栽土,土壤的有机质、全氮、全磷和全钾含量分别为0.02、0.13、0.41和47.96 g·kg-1,水解氮、速效磷和速效钾含量分别为15.10、8.89和35.14 mg·kg-1;将质量体积分数0.6% KMnO4溶液均匀喷洒到盆栽土中,用塑料薄膜密封后曝晒8 d,待用。
1.3 研究方法
1.3.1 实验设计 采用四元二次回归正交旋转组合设计(1/2实施)[14]进行实验。使用上口径38.5 cm、下口径30.0 cm、高30.0 cm的栽培盆栽种芳樟植株,每盆的盆栽土为5.5 kg。供试4种微生物菌剂的每盆施用量均设置2×109、3×109、4×109、5×109和6×109CFU 5个水平,共23个处理组,依次编号T1至T23,以无菌水作为空白对照。每个处理组的微生物菌剂组合详见表1。每盆栽种1株芳樟植株,每组各10盆,并设置3个生物学重复。
表1 微生物菌剂的四元二次回归正交旋转组合设计(1/2实施)
Table 1 Quadratic regression orthogonal rotational combination design with four factors (1/2 implementation) of microbial agents

处理组Treatmentgroup在5.5 kg盆栽土中的施用量/CFU1)Application amount in 5.5 kg potting soil1)X1X2X3X4处理组Treatment group在5.5 kg盆栽土中的施用量/CFU1)Application amount in 5.5 kg potting soil1)X1X2X3X4CK0000T124×1096×1094×1094×109T15×1095×1095×1095×109T134×1094×1092×1094×109T25×1095×1093×1093×109T144×1094×1096×1094×109T35×1093×1095×1093×109T154×1094×1094×1092×109T45×1093×1093×1095×109T164×1094×1094×1096×109T53×1095×1095×1093×109T174×1094×1094×1094×109T63×1095×1093×1095×109T184×1094×1094×1094×109T73×1093×1095×1095×109T194×1094×1094×1094×109T83×1093×1093×1093×109T204×1094×1094×1094×109T92×1094×1094×1094×109T214×1094×1094×1094×109T106×1094×1094×1094×109T224×1094×1094×1094×109T114×1092×1094×1094×109T234×1094×1094×1094×109
1)X1: 褐球固氮菌AzotobacterchroococumBeijerinck;X2: 巨大芽孢杆菌Bacillusmagateriumde Bary;X3: 胶冻样芽孢杆菌B.mucilaginosusKrassilnikov;X4: 枯草芽孢杆菌B.subtilisCohn.
1.3.2 接种方法 将4种微生物菌剂分别用无菌水稀释成1×108CFU·mL-1菌悬液,于2015年10月5日,采用一次性灌根接种法按照上述实验设计方案施用。实验期间,每周浇水1~2次,采取日常管理确保植株正常生长。于2016年6月6日结束实验。
1.3.3 叶和枝鲜质量测定 实验结束后,分别收集各组全部地上部分,将叶和枝分开,擦净后,采用电子天平(精度0.01 g)称量叶和枝的鲜质量,将叶和枝分别装入自封袋中置于4 ℃冰箱中保存、备用,根据称量结果计算叶鲜质量与枝鲜质量的比值。
1.3.4 精油提取 采用密闭循环式水蒸气蒸馏冷凝法[15]分别提取叶和枝的精油,并分别计算叶和枝的精油含量[4],根据公式“精油产量=叶精油含量×叶鲜质量+枝精油含量×枝鲜质量”计算精油产量。
1.4 数据处理及统计分析
采用EXCEL 2017软件进行数据统计分析;以4种微生物菌剂的施用量为自变量(X)、精油产量为因变量(Y)进行回归方程拟合分析,并采用DPS 7.05软件对获得的回归方程进行显著性检验,对影响芳樟精油产量的微生物菌剂进行单因子效应分析。
2 结果和分析
2.1 不同微生物菌剂组合处理对芳樟生长的影响
不同微生物菌剂组合处理对芳樟叶和枝的鲜质量及其比值的影响见表2。由表2可以看出:与CK组(对照组,未施用微生物菌剂)相比,23个处理组的叶和枝鲜质量及其比值均不同程度升高。供试处理组的叶鲜质量为23.02~62.50 g,较CK组升高了38.34%~275.60%;枝鲜质量为8.93~26.71 g,较CK组升高了10.66%~230.98%;叶鲜质量与枝鲜质量的比值为1.96~3.04,较CK组升高了3.16%~60.00%。除T6组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为3×109、5×109、3×109和5×109CFU)和T9组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为2×109、4×109、4×109和4×109CFU)外,其余21个处理组的叶鲜质量均显著(P<0.05)高于CK组;除T4组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为5×109、3×109、3×109和5×109CFU)、T5组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为3×109、5×109、5×109和3×109CFU)、T6组、T13组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为4×109、4×109、2×109和4×109CFU)和T16组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为4×109、4×109、4×109和6×109CFU)外,其余18个处理组的枝鲜质量均显著高于CK组;T1组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为5×109、5×109、5×109和5×109CFU)、T2组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为5×109、5×109、3×109和3×109CFU)、T3组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为5×109、3×109、5×109和3×109CFU)、T4组、T5组、T6组、T7组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为3×109、3×109、5×109和5×109CFU)、T10组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为6×109、4×109、4×109和4×109CFU)、T13组、T14组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为4×109、4×109、6×109和4×109CFU)、T16组和T23组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为4×109、4×109、4×109和4×109CFU)的叶鲜质量与枝鲜质量的比值显著高于CK组。
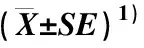
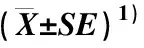

处理组Treatmentgroup在5.5 kg盆栽土中的施用量/CFU2)Application amount in 5.5 kg potting soil2)X1X2X3X4叶鲜质量/gLeaf fresh mass枝鲜质量/gBranch fresh mass叶鲜质量与枝鲜质量的比值Ratio of leaf fresh mass tobranch fresh massCK000016.64±1.66l8.07±1.03l1.90±0.03iT15×1095×1095×1095×10936.18±3.76cdefg13.65±0.47fghij2.65±0.19bcT25×1095×1093×1093×10941.97±3.58bc17.07±0.38defg2.46±0.11cdT35×1093×1095×1093×10962.50±3.29a26.71±2.05a2.34±0.02defT45×1093×1093×1095×10928.46±1.79fghijk9.35±1.09kl3.04±0.04aT53×1095×1095×1093×10925.25±2.69ijk11.27±0.59ijkl2.24±0.04defghT63×1095×1093×1095×10923.02±1.14kl8.93±1.03kl2.58±0.10bcT73×1093×1095×1095×10937.31±1.33cdef15.26±0.54defgh2.44±0.08cdeT83×1093×1093×1093×10948.92±2.14b22.77±1.31b2.15±0.03fghiT92×1094×1094×1094×10924.44±2.17jkl12.23±0.87hijk2.00±0.03hiT106×1094×1094×1094×10940.75±1.99cd18.22±1.89de2.24±0.09defghT114×1092×1094×1094×10934.01±1.61cdefghi17.31±0.87def1.96±0.07iT124×1096×1094×1094×10927.85±1.61ghijk13.24±0.99ghij2.10±0.07fghiT134×1094×1092×1094×10927.65±3.86hijk10.50±1.01jkl2.63±0.04bcT144×1094×1096×1094×10960.18±3.83a21.84±1.61bc2.76±0.04bT154×1094×1094×1092×10929.20±3.97fghijk13.84±0.97fghij2.11±0.09fghiT164×1094×1094×1096×10925.02±4.19ijk10.94±1.01ijkl2.29±0.10defgT174×1094×1094×1094×10938.65±3.58cde17.85±1.30de2.16±0.05fghiT184×1094×1094×1094×10932.32±1.43defghij15.16±1.32defgh2.13±0.11fghiT194×1094×1094×1094×10930.86±0.96efghijk14.65±1.64efghi2.10±0.03fghiT204×1094×1094×1094×10928.05±3.30ghijk12.70±0.76hijk2.21±0.05efghiT214×1094×1094×1094×10939.46±2.18cde18.63±0.82cd2.12±0.02fghiT224×1094×1094×1094×10929.69±2.31fghijk13.83±1.38fghij2.15±0.02fghiT234×1094×1094×1094×10936.85±1.62cdefg15.22±1.18defgh2.42±0.09cde
1)同列中不同小写字母表示差异显著(P<0.05)Different lowercases in the same column indicate the significant (P<0.05) difference.
2)X1: 褐球固氮菌AzotobacterchroococumBeijerinck;X2: 巨大芽孢杆菌Bacillusmagateriumde Bary;X3: 胶冻样芽孢杆菌B.mucilaginosusKrassilnikov;X4: 枯草芽孢杆菌B.subtilisCohn.
2.2 不同微生物菌剂组合处理对芳樟精油积累的影响
不同微生物菌剂组合处理对芳樟叶和枝的精油含量及精油产量的影响见表3。由表3可以看出:与CK组(对照组,未施用微生物菌剂)相比,23个处理组的叶精油含量和精油产量均不同程度升高;除T2组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为5×109、5×109、3×109和3×109CFU)、T4组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为5×109、3×109、3×109和5×109CFU)、T7组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为3×109、3×109、5×109和5×109CFU)和T9组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为2×109、4×109、4×109和4×109CFU)外,其余19个处理组的枝精油含量也均不同程度升高。供试处理组的叶精油含量为1.63%~2.37%,较CK组升高了1.24%~47.20%;精油产量为0.44~1.56 g,较CK组升高了51.72%~437.93%。除T10组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为6×109、4×109、4×109和4×109CFU)外,其余22个处理组的叶精油含量均显著高于CK组;除T2组、T4组、T7组、T9组、T10组和T13组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为4×109、4×109、2×109和4×109CFU)外,其余17个处理组的枝精油含量均显著高于CK组;除T6组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为3×109、5×109、3×109和5×109CFU)外,其余22个处理组的精油产量均显著高于CK组。
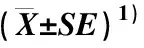
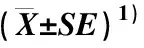
1)同列中不同小写字母表示差异显著(P<0.05)Different lowercases in the same column indicate the significant (P<0.05) difference.
2)X1: 褐球固氮菌AzotobacterchroococumBeijerinck;X2: 巨大芽孢杆菌Bacillusmagateriumde Bary;X3: 胶冻样芽孢杆菌B.mucilaginosusKrassilnikov;X4: 枯草芽孢杆菌B.subtilisCohn.
2.3 芳樟精油产量与微生物菌剂施用量的回归方程拟合分析及显著性检验
根据上述实验结果对芳樟精油产量(Y)与各微生物菌剂施用量(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌施用量分别为X1、X2、X3和X4)进行回归方程拟合分析,获得的回归方程为Y=0.686+0.064X1-0.116X2+0.200X3-0.122X4+0.002X12+0.036X22+0.106X32-0.032X42+0.024X1X2+0.116X1X3-0.086X1X4。
上述回归方程的显著性检验结果见表4。由表4可以看出:在α值为0.05水平上,F值为6.748 8,P值为0.001 8,说明供试4种微生物菌剂的施用量与芳樟精油产量存在显著的回归关系。
表4 芳樟精油产量与微生物菌剂施用量回归方程的显著性检验
Table 4 Significance test of regression equation of essential oil yield ofCinnamomumcamphoravar.linalooliferaFujita with application amount of microbial agents
1)X1: 褐球固氮菌AzotobacterchroococumBeijerinck;X2: 巨大芽孢杆菌Bacillusmagateriumde Bary;X3: 胶冻样芽孢杆菌B.mucilaginosusKrassilnikov;X4: 枯草芽孢杆菌B.subtilisCohn.
由表4还可以看出:巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌施用量对芳樟精油产量影响的一次效应的P值分别为0.021 3、0.000 7和0.016 4,说明巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌施用量对芳樟精油产量影响的一次效应分别达到显著、极显著和显著水平;而褐球固氮菌施用量对芳樟精油产量影响的一次效应的P值为0.167 5,说明褐球固氮菌施用量对芳樟精油产量影响的一次效应未达到显著水平。褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌施用量对芳樟精油产量影响的二次效应的P值分别为0.961 6、0.393 5、0.022 4和0.446 5,说明只有胶冻样芽孢杆菌施用量对芳樟精油产量影响的二次效应达到显著水平,其余3种微生物菌剂施用量对芳樟精油产量影响的二次效应均未达到显著水平。4种微生物菌剂施用量对芳樟精油产量影响的互作效应的P值均大于0.05,说明供试4种微生物菌剂对芳樟精油产量影响的互作效应均未达到显著水平。
根据上述回归方程,芳樟精油的最高产量可达1.72 g,与之对应的褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为2×109、2×109、6×109和2×109CFU。
对影响芳樟精油产量的微生物菌剂进行单因子效应分析,结果见图1。由图1可以看出:芳樟精油产量(Y)与褐球固氮菌施用量(X1)和胶冻样芽孢杆菌施用量(X3)呈正相关,获得的回归方程分别为Y=0.686+0.064X1+0.002X12和Y=0.686+0.200X3+0.106X32,其与巨大芽孢杆菌施用量(X2)和枯草芽孢杆菌施用量(X4)呈负相关,获得的回归方程分别为Y=0.686-0.116X2+0.036X22和Y=0.686-0.122X4-0.032X42,说明随着褐球固氮菌施用量和胶冻样芽孢杆菌施用量的增加,芳樟精油产量越来越高;而随着巨大芽孢杆菌施用量和枯草芽孢杆菌施用量的增加,芳樟精油产量越来越低。


图1 影响芳樟精油产量的微生物菌剂的单因子效应分析
Fig. 1 Single factor effect analysis on microbial agents affecting essential oil yield ofC.camphoravar.linalooliferaFujita
3 讨论和结论
芳樟精油的形成、积累和转化过程非常复杂,受到遗传和环境因子的综合影响[4,16-18]。通常情况下,芳樟无性系的精油含量稳定且变异较小[19],但不同栽培方式可影响芳樟的生长和精油合成[20],从而影响芳樟精油的含量。于静波等[21]发现,不同氮、磷、钾施肥处理能够影响1年生芳樟的叶精油含量及精油主要成分芳樟醇的含量;曾进等[22]发现,不同肥料(化肥)对芳樟各项生长和抗性生理指标的影响各异;袁宗胜等[13]发现,芳樟内生菌可促进其植株生长,提高其体内保护酶活性,从而改善植株对不良环境条件的反应。
研究发现,微生物对植物精油的影响主要有3个方面:1)微生物庞大的菌丝网络增加了植物根系的吸收面积[23],其代谢分泌物提高了土壤中难溶且不易被植物吸收的矿质元素的活性,有利于植物根系对矿质元素的吸收,进而促进植物生长[11,24];2)微生物直接或间接影响植物代谢关键组织的合成和蛋白质催化反应,致使植物次生代谢产物发生改变[25],利于精油成分积累[26-27];3)微生物能够产生与宿主相同的次生代谢产物,从而影响宿主的次生代谢产物含量[28]。褐球固氮菌可将空气中的气态氮转化成能够被植物直接利用的氨态氮[29];胶冻样芽孢杆菌具有解钾、解磷和固氮等多种作用,可提高植物的产量和品质[30];巨大芽孢杆菌是一种植物根系促生细菌,可降解土壤中不能被植物利用的磷和钾[31-32];枯草芽孢杆菌既能够抑制植物病原菌,又能够促进植物生长[33-34]。本研究结果表明:在上述4种微生物菌剂的组合处理下,芳樟的叶和枝鲜质量及其比值、精油含量及精油产量总体上均较对照组(未施用微生物菌剂)升高,说明供试4种微生物菌剂组合处理不但有利于芳樟生长,而且能够促进其精油积累。
统计结果表明:T3组(褐球固氮菌、巨大芽孢杆菌、胶冻样芽孢杆菌和枯草芽孢杆菌在5.5 kg盆栽土中的施用量分别为5×109、3×109、5×109和3×109CFU)的芳樟精油产量最高(1.56 g),其叶和枝的鲜质量也最高,总体上显著高于其余各组,并且,其精油产量最接近根据回归方程计算的精油最高产量(1.72 g),据此认为T3组为供试的最优处理组。
然而,关于微生物菌剂影响芳樟精油积累和合成的代谢途径尚不清楚,可在施用微生物菌剂时对其进行荧光标记或分子标记,从而检测微生物菌剂对芳樟的生活史及代谢过程的影响途径,并验证各微生物菌剂的功能。同时,还可通过共生培养芳樟及促进其精油积累的内生细菌和内生真菌获得更优良的高精油产量的芳樟品种[35]。
