碳青霉烯耐药肺炎克雷伯菌对替加环素的耐药机制研究进展
2020-04-20张娣周志慧
张娣,周志慧
(浙江大学附属邵逸夫医院感染科,浙江 杭州)
0 引言
肺炎克雷伯菌是常见的肠杆菌科细菌,据CHINET(中国细菌耐药性监测网)监测数据,历年来肺炎克雷伯菌临床检出率仅次于大肠埃希菌,位居革兰氏阴性菌第二名。感染部位可累及呼吸道、泌尿道、肠道、皮肤软组织等[1],由于碳青霉烯类抗生素不合理的使用,碳青霉烯耐药肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae,CRKP)在全球范围内不断增加,已成为最重要的医院内感染病原体之一[2],其感染控制难度大,病死率高,迫使我们去寻找新的抗感染方案。替加环素是甘氨酰环素类抗菌药物,为米诺环素的衍生物,2005 年被美国食品和药物管理局(FDA)批准使用[3]。它通过可逆结合细菌核糖体30S 亚基,干扰16S rRNA 的A 位点来抑制蛋白质的合成,达到抗菌目的[4]。替加环素对大多数革兰阳性菌、革兰阴性菌和厌氧菌均具有抗菌活性[5,6],并且是治疗CRKP 感染的少数可选择药物之一[7]。然而自替加环素上市后,替加环素耐药的CRKP 菌株(T-CRKP)相继被报道。因此,为减少细菌耐药,为临床诊治提供参考,本文就CRKP 对替加环素的耐药机制以及T-CRKP 感染的治疗选择进行综述。
1 CRKP 流行现状
随着碳青霉烯类药物大量使用,CRKP 菌株在世界范围内检出率逐年增加,美国疾控中心(CDC)报告显示,2001-2011 年美国耐碳青酶烯类肠杆菌科(CRE)的比例从1.2%增至4.2%,其中CRKP 占CRE 的比例从1.6%增至10.4%[8]。根据CHINET 数据,我国CRKP 菌株检出率也呈持续上升态势,肺炎克雷伯菌对亚胺培南和美罗培南的耐药率从2005 年的3.0%和2.9%分别提高到2018 年的25%和26.3%,耐药率提高了8 倍以上[9]。产碳青霉烯酶是肠杆菌科细菌对碳青霉烯类药物耐药的主要机制,首例产肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniae carbapenemase,KPC)的肺炎克雷伯菌于1996 年在美国被发现[10],随后不同类型的碳青霉烯酶如新德里金属β-内酰胺酶(NDM)、维罗纳整合素编码的金属β-内酰胺酶(VIM)、亚胺培南酶金属β-内酰胺酶(IMP)和苯唑西林酶-48(OXA-48)等也相继被报道,并在全球范围内迅速传播。不同地区碳青霉烯酶的分布也有所不同,我国CRKP 菌株以产KPC 酶为主,产NDM 的肺炎克雷伯菌在美国、加拿大、希腊等欧洲国家较多见,而产OXA-48 型的菌株在土耳其和北非广泛传播[11]。近年来,主要流行于国外的碳青霉烯酶类型在国内也开始检出,如OXA-48 型CRKP 菌株[12]。随着CRKP 菌株的传播,其感染率逐年增加,有研究显示,CRKP 感染是院内死亡的独立危险因素,死亡率高达40%-50%[13,14],特别是血流感染(BSI)、入住ICU、实体器官移植(SOT)患者[15,16]。鉴于其高病死率,这迫使我们去寻找有效的抗感染方案。
2 替加环素抗菌机制及应用
替加环素是甘氨酰环素类抗菌药物,为米诺环素的衍生物,它是在米诺环素四环结构的D 环第9 位碳原子上加入叔-丁基氨基乙酰胺基侧链。与四环素类作用机制类似,替加环素通过可逆结合核糖体30S 亚基,干扰16S rRNA 的A 位点来抑制细菌蛋白质的合成,达到抗菌目的[4]。由于替加环素存在长侧链,产生了位阻效应,同时其能与核糖体结合的更紧密,因而能克服细菌对四环素类耐药的外排泵tet(A-E)和核糖体保护tet(M)机制,对多重耐药菌有良好的抗菌活性[17]。替加环素不需要根据肾功能情况调整剂量,其疗效受患者的年龄、性别或疾病变化等影响较小[6],在2005 年,已被美国FDA 批准用于治疗复杂的腹腔感染,复杂的皮肤软组织感染以及社区获得性肺炎(CAP),并建议静脉用药首剂100 mg,维持剂量50 mg,q12h,在某些重症感染情况下,负荷剂量可达200mg,维持剂量100mg,q12h[18]。
3 CRKP 对替加环素耐药机制研究
自替加环素被批准使用以来,临床上出现越来越多T-CRKP菌株的报道,我国2018 年CHINET 显示9225 株CRKP 对替加环素耐药率达3.6%[9],较前有增长趋势,这给临床的治疗带来了严峻挑战。CRKP 对替加环素的耐药机制复杂多样,耐药结节细胞分裂(RND)型外排泵AcrAB-TolC 过表达是主要耐药机制,后有研究证实OqxAB、KpgABC 外排泵过表达、tet(A)突变、核糖体蛋白rpsj 基因突变均参与耐药过程。详细机制描述如下(图1)。
3.1 RND 型外排泵
RND 型外排泵过表达介导的替加环素耐药在革兰阴性细菌中很普遍,如铜绿假单胞菌中的 MexXY 外排泵、粘质沙雷菌中的SdeXY 外排泵、肠杆菌属中的AcrAB 和OqxAB 外排泵、大肠埃希菌中的 AcrAB 和AcrEF 外排泵等。在肺炎克雷伯菌中以AcrABTolC 和OqxAB 外排泵为主[19]。
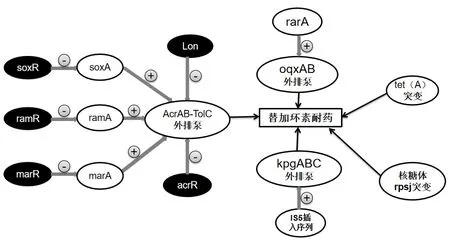
图1 CRKP 对替加环素耐药,各调节因子间相互作用
RND 型外排泵中最常见的AcrAB-TolC 外排泵由膜融合蛋白AcrA、膜转运蛋白AcrB、通道蛋白TolC 三种蛋白组合而成。先前的研究表明AcrAB 蛋白的表达受AraC 家族中的转录调节因子调节,分别是RamA、MarA、SoxS 和rarA。它们通过与启动子相互作用,激活外排泵,赋予替加环素的抗性。而局部抑制因子RamR、MarR、SoxR 分别通过抑制RamA、MarA、SoxS 基因的表达从而抑制外排泵AcrAB 的表达,来发挥负性作用[20-22],同时抑制因子acrR、Lon 蛋白等这些基因的突变也会导致过度的转录激活,引起肠杆菌科中AcrAB 外排泵的上调[21、23、26]。He 等人[23]在三株TCRKP 菌株中发现了ramA 的过表达,进一步的分析证实了这些菌株中存在ramR 突变,用野生型ramR 转化一个突变体能恢复对替加环素的敏感性,同时抑制ramA 和acrB 的过表达。该研究证实了ramR 突变从而引起ramA 激活AcrAB 外排泵过表达是CRKP 对替加环素耐药的主要机制。多篇研究报道了RamR 基因最常见的是开放阅读框内的插入、缺失、点突变等突变类型,而Ye等人[24]发现在2 株TCRKP 菌株中ramR 开放阅读框ORF 区域无突变,但在其上游核糖体结合区域(RBS)有12 个碱基的缺失,进一步研究发现该缺失不影响ramR 的转录,但影响蛋白质合成,间接引起外排泵AcrAB 表达升高,该研究补充了ramR 的突变类型。随着研究的深入,Rosenblum 等[25]发现部分ramR 基因突变并不影响ramA 的表达水平升高,随后研究证实ramA 与其周围基因romA 形成的romA-ramA 基因座受双启动子的调控,即两个ramR结合位点。作者还发现部分菌株无ramR 基因突变,但仍过表达ramA 基因,暗示可能存在次级调控因子控制ramA 表达。Yoo 等人[19]在此基础上进一步研究,他们获得的2 株CRKP 菌株均属于ST147 型,一株对替加环素敏感,另一株耐药,基因学分析提示耐药菌株中存在6,096 bp 的片段插入,插入端两侧为TATAT 重复序列,该序列破坏了ramA 上游的romA 基因,导致启动子替换,从而引起ramA 基因更强的激活。该研究证明ramA 自身的改变,也会引起AcrAB 外排泵上调,从而导致耐药出现。除了经典的ramA-AcrAB 途径外,marA、soxS 等均对AcrAB 的过表达起到各自作用,但不占主导地位[23,27]。
在大肠埃希菌中,Lon 蛋白参与marA 的降解,Lon 的缺失或突变会导致marA 浓度升高,从而增加AcrAB 外排泵的表达,引起对替加环素耐药。Li 等人[26]从替加环素治疗CRKP 感染患者的血液中分离出T-CRKP,在替加环素诱导下获得了6 株替加环素抗性突变体,全基因组测序发现5 株中有Lon 基因突变,包括三种不同类型的点突变,通过构建野生型Lon 质粒,基因敲除回补等试验证明,Lon 突变体比野生株表现出更高的替加环素的抗性,首次证明Lon 突变参与肺炎克雷伯菌对替加环素耐药,具体机制需要进一步研究阐明。
同属RND 家族由质粒编码的多药外排泵OqxAB 已被确认介导了肠杆菌科细菌多重耐药(MDR)。过表达的OqxAB 可降低多种药物如替加环素、喹诺酮类、呋喃妥因和氯霉素等敏感性[28]。在2012 年,Veleba 等人[29]发现一新型AraC 型转录调节因子,命名为rarA,在肺炎克雷伯菌和肠杆菌属中,染色体编码的rarA 调节基因位于外排OqxAB 的下游,通过实时定量PCR(RT-PCR)发现rarA 上调的菌株,OqxA 基因的表达也相应升高,同时通过克隆转化等实验证实rarA 是OqxAB 外排泵正向调节因子。基因敲除回补实验发现当敲除acrAB 基因后,即使存在rarA 高表达,该菌株对替加环素的MIC 仍不变,证实了rarA 发挥作用需要功能性AcrAB 外排泵的存在,但独立于其他AraC 调节基因。后Xue 等[27]发现他们获得的9 株TCRKP 菌株中,有4 株替加环素MIC 较高(16μg/mL),通过RT-PCR 证实这4 株菌株过表达rarA 及oqxB 基因,另外5 株无过表达,作者认为rarA 以及外排泵OqxAB 在选择高水平替加环素耐药菌株中发挥更重要的作用。台湾一项研究中发现,2 株TCRKP 菌株中无AcrAB 和OqxAB 外排泵的过表达[30],提示可能还存在其他调节因素参与耐药过程。
除 了AcrAB-TolC、OqxAB 外 排 泵 外, Nielsen 等 人[31]在2014 年首次发现RND 家族新成员,命名为kpgABC 外排泵。他们分离出的TCRKP 菌株无上述常见的外排泵基因表达量增加或者突变,全基因组测序揭示了在KpgABC 外排泵操纵子上游85 bp存在IS 5 插入序列。既往报道插入序列(IS)可以上调大肠埃希菌中AcrAB 外排泵和鲍曼不动杆菌AdeABC 外排泵的表达,从而引起替加环素非易感性,但在肺炎克雷伯菌中尚未报道。文章通过RT-PCR 发现有IS5 插入序列的菌株存在kpgA 和kpgB 过表达现象,随后通过对kpgABC 操纵子的克隆转化实验进一步证明kpgABC 过表达会导致临床相关的替加环素耐药性增加,且不需要功能性AcrAB 外排泵辅助。这一发现补充了我们在CRKP 对替加环素耐药机制上的认识。
3.2 MFS 型外排泵
Tet(A)蛋白为最常见的主要易化子超家族(MFS)外排泵,主要介导病原体对四环素类抗生素耐药。既往报道替加环素其能克服细菌对四环素类的抗性机制,而Akiyama T 等人发现沙门菌携带的tet(A)基因不仅赋予四环素的抗性,同时也降低了对替加环素的敏感性[32]。随后有研究证实在大肠埃希菌中Tet 蛋白均可以突变,从而获得对替加环素的高水平[Tet(A)和Tet(X)]或低水平[Tet(K)和Tet(M)]抗性[33]。2017 年,Sheng[34]等人鉴定出TCRKP 菌株中具有两个双移码突变的tet(A)变体,1 型和2 型,其中2 型是新颖的。用携带1 型和2 型tet(A)的质粒转化的亲本菌株分别使替加环素MIC 增加8 倍和4 倍,并通过基因敲除实验证实在ramR 缺失情况下同时合并tet(A)突变对介导肺炎克雷伯菌替加环素耐药具有协同作用。Tet(A)突变的报道受到广泛关注,Du 等人[35]也发现Tet(A)基因中的一个氨基酸取代(S251A)突变是引起替加环素抗性发展的原因,并通过接合实验证实Tet(A)的可转移能力。而另有研究观察到在对替加环素敏感CRKP 菌株中存在与耐药菌株相同的tet(A)突变体,表明该基因在正常条件下不表达,但在长期使用替加环素处理后可诱导耐药。此外,tet(A)基因在含有blaKPC-2 基因的接合质粒中被发现[36],这应引起临床上高度关注,用替加环素治疗该类型CRKP 菌株感染很容易诱导耐药的进化和传播。Tet (X)已被证明可以编码一种依赖于黄素的单加氧酶,这种酶可以修饰替加环素。最近,He 等人[37]报道了动物和人类肠杆菌科和不动杆菌属中2 种独特的质粒介导可转移的替加环素耐药基因tet(X3)和tet(X4),它们可以使四环素类全部失活包括替加环素以及被FDA 最新批准的eravacycline 和omadacycline。虽然该基因尚未在肺炎克雷伯菌中发现,也未在人类范围广泛传播,但临床上应警惕肠杆菌科tet(X)变异的发生,这对于评估因tet(X)变异感染而产生高水平替加环素耐药性的患者的危险因素和临床结局至关重要。
3.3 核糖体蛋白
替加环素通过与细菌核糖体30S 亚基的结合抑制蛋白质合成来发挥抗性作用。由rpsj 基因编码的S10 蛋白为30S 核糖体亚基的组成部分,已有报道称该突变与淋病奈瑟菌中的四环素抗性有关[38]。Villa 等人[22]发现rpsj 基因位于肺炎克雷伯菌基因组的单一拷贝中,并在所有肠杆菌科中都是保守的,该基因突变可能会改变替加环素结合位点附近的核糖体结构或干扰Mg2+的配位,导致替加环素与16S rRNA 的结合较弱,从而引起耐药。随后He 等人[39]鉴定出rpsj 基因中的V57L 氨基酸取代突变,与Villa 等人发现相同,通过转化互补实验表明rpsJ 突变是替加环素耐药发生的主要原因,这项研究第一次提供直接的体内证据,证明rpsJ 基因的进化可以导致在替加环素治疗CRKP 感染的患者期间产生耐药。由于该基因位于CRKP 菌株的染色体上,这为临床上提供警示:在替加环素的选择性压力下,可能发生rpsJ 突变,导致耐药发生,从而使治疗失败。
4 T-CRKP 感染的治疗选择
CRKP 对替加环素耐药主要为外排泵的过表达所致,多数研究表明用外排泵抑制剂如羰基氢化氯苯腙(CCCP)、苯丙氨酸-精氨酸-β-萘胺(PAβN)、1-(1-萘甲基)哌嗪(NMP)等能不同程度的恢复病原体对替加环素敏感性[23,27,40],因此目前正在研发的外排泵抑制剂对于T-CRKP 感染患者来说可能是种有效的选择。多黏菌素能直接结合并中和细菌脂多糖的“脂质A”部分,从而促进细胞裂解发挥抗菌作用[41],近些年已成为治疗CRKP 感染的“最后手段”,然而多黏菌素耐药的肺炎克雷伯菌相关的报道越来越多,同时基于其肾毒性等不良事件,该药的选择受到一定限制。与单一疗法相比,抗菌药物联合使用能表现良好的优越性。有报道显示,磷霉素、庆大霉素等较老的抗生素与多黏菌素合用,常能达到较好的疗效[42]。
当然,为了应对MDR 微生物的传播,近年来也开发了一些新型抗生素。头孢他啶/阿维巴坦是近期被批准使用的三代头孢与新型β-内酰胺酶抑制剂的组合,已获许治疗腹部感染,尿路感染和医院获得性肺炎(HAP),其能够抑制Ambler A 类,C 类和部分D 类β-内酰胺酶,但对B 类金属酶无效。因而有研究发现头孢他啶/阿维巴坦与针对B 类金属β 内酰胺酶的氨曲南结合,在治疗XDR(泛耐药)肺炎克雷伯菌感染中能发挥良好疗效[43]。美罗培南-vaborbactam为碳青霉烯/A 类和C 类β-内酰胺酶抑制剂的组合,2017 年已被FDA 批准用于治疗复杂的尿路感染,目前正在进行III 期临床试验,评估与哌拉西林/他唑巴坦相比在治疗医院获得性肺炎(HAP)、呼吸机相关肺炎(VAP)的疗效和安全性[44]。Eravacycline是一种新型的全合成四环素,化学结构类似替加环素[45],对革兰阳性和阴性耐药菌均具有广谱活性,包括表达不同类型的β-内酰胺酶,如产超广谱β 内酰胺酶(ESBL),KPC 和OXA 的肠杆菌科细菌,显示出比替加环素更高的抗菌效应[46],未来可能是治疗HAP、VAP 有潜力的抗生素。除了抗生素类,粪便微生物群移植(FMT)近些年来也是研究的热点,原理就是利用正常微生物菌群取代含有MDR 细菌的功能障碍的微生物菌群[47],但该理论目前还在实验阶段,其有效性有待进一步商榷。
5 小结与展望
目前,泛耐药(XDR)肺炎克雷伯菌株的检出率逐年升高,对全球的公共卫生事业提出新的挑战。替加环素作为治疗CRKP 感染的为数不多的药物之一,近年来耐药的报道也呈上升趋势,其主要机制为RND 型外排泵系统的过表达。近期发现的tet(X)变异体可介导大肠埃希菌对替加环素耐药,未来可能成为CRKP 对替加环素耐药的新机制。上述耐药机制的深入研究,可以为临床科室防止TCRKP 的爆发流行提供一定参考依据。同时我们强调应合理使用替加环素,延长其使用寿命。针对T-CRKP 感染的治疗,当前可用的药物包括磷霉素、庆大霉素和多黏菌素等旧抗生素以及头孢他啶/阿维巴坦等新型抗生素。尚未上市的最新型抗生素将来有望成为应对T-CRKP 感染的有效选择。
