羟基磷灰石/石墨烯复合物对水中亚甲基蓝的吸附
2020-04-18钟旭源
傅 瑜,钟旭源
(江苏理工学院化学与环境工程学院,江苏 常州 213001)
印染废水中的染料由于主要以芳烃和杂环化合物为母体,带有显色基团,色度高,有毒且难以生物降解[1],已经成为造成环境污染的主要污染源之一。亚甲基蓝是典型的水溶性偶氮染料[2],由于废水的排放量大、浓度高、色度深,对环境和人体造成较大的危害。目前,工业上常用的印染废水处理的方法有生物氧化法、化学沉淀法、絮凝沉淀法、吸附法、光催化降解法等[3],其中吸附法因其成本较低、效率高、易操作等特点,被广泛用于处理染料废水。研究开发吸附容量更大、更易分离的环保型吸附剂成为处理染料废水的研究热点。羟基磷灰石(Hydroxyapatite,HA)是一种微溶于水的弱碱性磷酸钙盐[4],羟基磷灰石的比表面积大,颗粒分散性好,由于其具有较好的离子吸附和交换性能,能够用来去除污水中的重金属阳离子,是一种优良的吸附剂[5]。石墨烯具有二维蜂窝状晶体结构,巨大的比表面积,赋予其优良的性能与稳定的化学性质,作为吸附材料及载体前景广阔[6]。将羟基磷灰石负载于石墨烯之上,并用于吸附污水中的染料分子,两种吸附剂将会达到协同吸附的效果。
本工作采用共沉淀法制备出羟基磷灰石,并通过一步水热法合成羟基磷灰石/石墨烯复合物,以亚甲基蓝溶液作为有机染料污染物模型探究HA/RGO复合物的吸附性能。实验考查了溶液的初始pH值、初始浓度以及反应时间对HA/RGO复合物吸附亚甲基蓝的影响,研究了吸附动力学和等温吸附模型,为开发新的水处理材料提供了理论参考。
1 实 验
1.1 仪器与试剂
S-3400N扫描电镜,日立公司;UV1800PC紫外可见分光光度计,上海菁华科技仪器有限公司。石墨粉购自天津市登科化学试剂有限公司;试剂包括CaNO3·4H2O,(NH4)2HPO4,亚甲基蓝(MB)等化学试剂皆为分析纯,上海国药集团化学试剂有限公司。
1.2 氧化石墨烯制备
氧化石墨烯(GO)采用改进的Hummers方法制备。
1.3 羟基磷灰石浆料的制备
羟基磷灰石(HA)浆料制备采用化学共沉淀法制备。将300 mL浓度为0.1 mol/L的Ca(NO3)2溶液用氨水调节pH值至11。然后以 Ca/P摩尔比为1.67,量取 180 mL浓度为0.1 mol/L的(NH4)2HPO4缓缓滴加到Ca(NO3)2溶液中,得到白色沉淀,滴加过程中用NH3·H2O调节溶液pH值稳定在1l左右,反复洗涤,离心后,便得到白色的HA固体浆料,于60℃下烘干粉碎以备用。制备过程反应方程如下所示:

1.4 羟基磷灰石/石墨烯复合物的水热合成
HA/RGO复合物的水热合成。称取不同质量比的HA以及GO,蒸馏水混匀后放入超声仪器中处理2 h,得到均匀分散的悬浮溶液,将悬浮液放入反应釜中,于180℃下反应2 h,60℃干燥后得到HA/RGO复合物。此实验中,将HA与GO的质量比0∶1、1∶1、1∶3、1∶0的所得产物分别记作,RGO、 HA/RGO-1、 HA/RGO-3、 HA。
1.5 吸附性能实验
量取30 mL的亚甲基蓝(MB)溶液于150 mL的锥形瓶中,并用浓度0.1 mol/L的HCl和0.1 mol/L的NaOH溶液调节其pH值。加入一定量的吸附材料后,摇匀后放入气浴恒温振荡器中,震荡速度设置为90 r/min,在一定温度下震荡预定时间,反应结束后采用离心分离的方法使得固液分离,采用分光光度法于波长664 nm处测定测定残液的MB质量浓度。计算MB的去除率及复合物的吸附容量根据公式2、3所示:
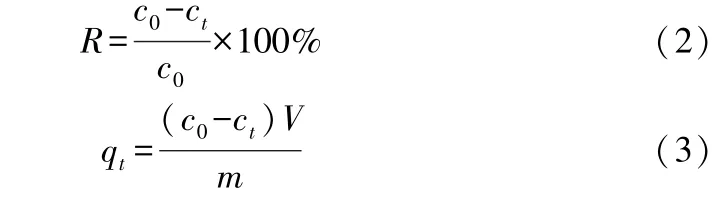
式中,R代表去除率;qt代表吸附容量(mg/g);c0代表溶液初始浓度(mg/L);ct代表t时刻溶液浓度(mg/L);V代表溶液体积(L);m代表吸附材料质量(g)。
2 结果与讨论
2.1 样品的形貌分析
利用扫描电子显微镜对GO、RGO、HA/RGO-1进行微观形貌观察。从图1可看出GO表面较粗糙,有褶皱(图1a);RGO厚度较薄,表面褶皱,呈半透明状(图1b);HA/RGO-1呈现出网状多孔结构,且可以看到其孔大小不一致,HA颗粒分散在网络结构中,同时可看到颗粒状的HA被RGO片层包裹(图1c),这可能说明了RGO中剩下的含氧官能团可以与HA发生作用。

图1 样品的SEM图Fig.1 SEM images of samples
2.2 不同吸附材料对MB吸附的影响
量取30 mL质量浓度为50 mg/L的MB溶液4份,调节溶液pH为11,分别加入10 mg的吸附材料,在25℃下振荡12 h后,对比四种吸附材料对亚甲基蓝的吸附效果。由表1可知,四种吸附材料对于MB的去除率都超过了80%,HA/RGO-1对MB的去除率高达98.76%。其中,RGO、HA/RGO-1和HA/RGO-3吸附效果均比HA好,可能因为RGO的比表面积远大于HA,同时,也可以看到HA/RGO-1的对MB的去除率高于RGO,这说明了HA与RGO复合,其能够产生协同作用,达到更好的吸附效果。但是 HA/RGO-3的去除率反而比RGO、HA/RGO-1的低,可能由于HA/RGO-3中HA分布不均匀,暴露出来的吸附位点不如RGO和HA/RGO-1多。因此,接下来,主要选取HA/RGO-1作为模型,进一步探讨其吸附性能。

表1 不同吸附材料对MB的去除率Table 1 Removal rate of MB by different adsorption materials
2.3 初始pH值对MB吸附的影响
量取30 mL质量浓度为100 mg/L的MB溶液15份,调节溶液pH初始值为3、5、7、9、11,分别加入10 mg的吸附材料,于25℃下振荡12 h后,研究初始pH值对于吸附材料吸附MB的影响。吸附过程中,溶液pH不仅对吸附剂表面电荷、官能团、活性位点等产生影响,而且会影响吸附物质的电离程度和结构,从而使吸附剂与吸附质之间的作用发生变化[7]。图2为溶液初始pH对MB吸附的影响,从图2可知随着溶液pH的增加,三种吸附材料对MB的吸附量也呈现递增的趋势,并且HA/RGO-1对MB的吸附量远高于其他两种吸附材料。在pH值在3~9之间时,吸附量是呈现缓慢上升的状态,而当pH在9~11之间时,吸附量增加非常明显。这可能是由于三种吸附材料吸附MB分子的机理还是以静电吸引为主,亚甲基蓝为阳离子型染料,吸附材料表面电荷会直接影响MB的吸附量。当溶液pH较低时,溶液中的H+离子浓度较高,H+离子与带正电的MB分子竞争活性位点,并且HA、RGO以及HA/RGO-1这三种吸附材料表面带正电荷的基团会与MB分子产生静电排斥作用,从而使得MB分子接触吸附材料的机会降低。随着溶液pH的增大,OH-浓度增大,三种吸附材料表面带负电,增强了静电吸引作用,从而使得MB的吸附量迅速上升。

图2 初始pH值对MB吸附的影响Fig.2 Effect of initial pH on the adsorption of MB
2.4 初始浓度对MB吸附的影响
量取30 mL不同初始浓度的MB溶液,分别加入10 mg的吸附材料,调节溶液pH为11,于25℃下振荡12 h后,研究MB的初始浓度对于吸附材料吸附MB的影响。由图5可知,随着MB初始浓度的增加,三种吸附材料对MB的吸附量也随之增加,特别是HA/RGO-1更是呈现线性递增的趋势。当吸附剂的含量一定时,随着MB初始浓度的增加,吸附剂和MB分子的有效碰撞几率增加,吸附量增加明显。而当吸附达到饱和后,吸附材料表面吸附位点被大量占据,从而导致吸附趋于平衡。可能由于HA/RGO-1的比表面积较大,相对GO和HA具有更多的吸附位点,其吸附量远大于GO和HA。

图3 初始浓度对MB吸附的影响Fig.3 Effect of initial concentration on the adsorption of MB
2.5 吸附等温线的研究
采用Langmuir和Freundlich等温吸附模型来研究RGO、HA和HA/RGO-1三种吸附材料吸附MB的吸附行为。Langmuir等温线模型在单分子层吸附中应用较为广泛,其模型线性表达式如下所示:

式中,qmax为最大吸附容量;ce为吸附达到平衡时目标污染物溶液的浓度;qe为吸附剂的吸附平衡量;KL为Langmuir常数。
Freundlich等温模型是基于异相表面的多层吸附,其模型线性表达式如下所示:

式中,qe为吸附平衡量,mg/g;ce为平衡浓度,mg/L;KF和n是对应于吸附容量和吸附强度的Freundlich常数。

表2 MB吸附的Langmuir方程和Freundlich方程线性拟合参数Table 2 Langmuir and Freundlich isotherm parameters for the adsorption of MB
在25℃温度下,各吸附材料吸附MB的等温模型线性拟合结果列于表2。结果表明,采用Langmuir等温方程拟合的线性相关系数(R2)都高于0.99,而采用Freundlich等温方程拟合的线性相关系数(R2)较低,说明三种吸附材料吸附MB的过程与Langmuir等温方程描述的单分子吸附相符。HA/RGO-1对MB的饱和吸附量可达666.7 mg/g,显然高于RGO和HA的饱和吸附量,而RGO对MB的吸附量几乎是HA的两倍,说明在HA/RGO-1复合物中,RGO对MB的吸附发挥了很大作用。
2.6 吸附时间对HA/RGO-1复合物吸附MB的影响
量取30 mL初始浓度100 mg/L和150 mg/L的MB溶液各10份,分别加入10 mg的吸附材料,调节溶液pH为11,吸附温度25℃,研究吸附时间对HA/RGO-1复合物吸附MB的影响。由图4可知,当MB的初始浓度为100 mg/L和150 mg/L时,HA/RGO-1对MB的吸附量在前80 min迅速增加,吸附量占整个吸附过程的93%,吸附480 min后,吸附已趋于平衡。可能由于在吸附初始阶段,HA/RGO-1表面有较多的吸附位点存在大量吸附MB分子,而随着时间推移,一方面由于吸附剂表面占据大量的MB分子,产生了静电排斥作用,另一方面也由于吸附剂表面活性位点减少而导致吸附逐步达到平衡。

图4 吸附时间对HA/RGO-1复合物吸附MB的影响Fig.4 Effect of contact time of MB adsorption on HA/RGO-1 composites
2.7 吸附动力学研究
为了进一步探究HA/RGO-1复合物吸附MB的吸附过程,采用准一级动力学模型和准二级动力学模型来对动力学数据进行拟合,准一级和准二级动力学模型的线性表达式分别为公式(5)和(6)。

式中,qe为平衡吸附量,mg·g-1;qt为t时刻的吸附量,mg·g-1;t为吸附时间,min;k1为准一级反应速率常数,min-1;k2为准二级反应速率常数,g·(mg·min)-1。
表3为分别采用准一级和准二级动力学模型对HA/RGO-1复合物吸附MB的拟合结果,准二级动力学模型的线性相关系数R2明显大于准一级动力学模型,R2≥0.999说明拟合效果非常理想,并且准二级动力学模型拟合计算出的理论平衡吸附量qe,exp与实验所测的平衡吸附量qe,calc更为接近,即说明HA/RGO-1复合物对MB的吸附动力学符合准二级动力学模型。

表3 HA/RGO-1复合物吸附MB的动力学参数Table 3 Kinetics parameters of MB adsorption on HA/RGO-1 composites
3 结 论
(1)通过改进的Hummers法制备了氧化石墨烯,采用一步水热法合成了HA/RGO复合物,其中HA/RGO-1复合物吸附废水中的MB效果最好,去除率高达98.71%。
(2)HA/RGO-1复合物对MB的吸附量随着溶液初始pH的上升而增大,吸附的机理主要依靠静电吸引;随着MB溶液的初始浓度增加,复合物的吸附量也随之快速递增,而后趋于饱和。
(3)Langmuir等温吸附方程能较好地描述HA/RGO-1复合物对MB的吸附过程,从Langmuir方程拟合计算出的最大吸附量为666.7 mg/g,Langmuir吸附说明MB分子与HA/RGO-1复合物之间主要发生单分子层吸附。
(4)HA/RGO-1复合物对MB溶液吸附在前80 min吸附量占整个吸附过程的93%,准二级动力学模型能更好地描述HA/RGO-1复合物对MB的吸附动力学行为。
