超声联合CT融合图像对小肝癌诊出率及肝癌消融效果的影响
2020-04-17河南省漯河市第二人民医院超声科河南漯河462000
河南省漯河市第二人民医院超声科(河南 漯河 462000)
梁志超
根据米兰(Milan)标准,单发肿瘤直径≤5cm或多发病灶数量≤3个,且其中最大径≤3cm的HCC为小肝癌(small hepatocellular carcinoma,sHCC),而我国结合患者情况将肿瘤最大径<5cm作为定义标准[2]。随着微创治疗和加速康复外科发展,射频消融(radiofrequency ablation,RFA)等微创治疗手段逐渐受到重视,多学科综合干预成为发展趋势并对优化治疗方案和提升疗效具有积极作用[1-2]。融合图像(image fusion)是将不同影像学方法所得图像在空间上配对合并形成多模式图像,经过信息互补来提升诊断和治疗准确性的后期处理技术,其中超声与CT融合图像现已证实较单一模态图像存在巨大优势[3-4]。本文主要研究超声与CT融合图像对sHCC诊出率及肝癌消融效果的影响,为促进sHCC诊治水平不断发展提供参考依据。
1 资料与方法
1.1 一般资料选取2015年4月至2018年4月我院sHCC患者104例,其中男性59例、女性47例,年龄32~86岁,平均(60.34±12.73)岁,肝功能Child-Pugh分级A级68例、B级36例,单个肿瘤直径9~48mm,平均(39.14±8.05)mm。纳入标准:①符合HCC相关诊断标准且经病理结果证实[5],单个肿瘤直径≤5cm;②肝功能Child-Pugh分级为A级或B级;③患者及家属知晓本研究并签署同意书;④均完成CT、超声及融合成像等影像学检查。排除标准:①患者临床资料保存不完整;②影响学检查图像质量不理想;③RFA术后未完成随访者;④已发生血管侵犯或远处转移。
1.2 研究方法患者入院后先采用GE lightspeed 64排螺旋CT扫查仪常规检查,患者取仰卧位并保持双臂上举抱头,平扫层厚5~10mm,间距5~10mm,经肘静脉注射非离子型含碘对比剂(广州先灵药业有限公司生产,300mgI/ml)2ml/kg,速度1.5~3ml/s,然后分别于造影剂注射后0~30s、30s~2min及2~5min连续进行动脉期、门静脉期和延迟期扫描,电压120kV,电流200mA,层间距1mm,层厚1mm,观察病灶位置、大小及数量。将病灶和肝内血管显示清楚CT图像导入Acuson Sequia-512型超声诊断仪,采用频率2.5~4.0MHz配套探头扫描肝脏各切面,观察病灶及其血流状况,然后将造影剂SonoVue(意大利Bracco公司生产,有效成分为SF6)2.4mL+0.9%氯化钠溶液5mL配置为混悬液后抽取2~2.5ml经肘静脉于2~3s迅速团注并采用0.9%生理盐水冲管,选择感兴趣区域观察血流灌注情况,分动脉期(8~30s)、门静脉期(31~120s)和延迟期(121~360s)记录病灶强化特点,同时微调探头方向观察病灶附近区域,最迅速扫描全肝检查有无新病灶,选择门静脉矢状部或门静脉右分支叉等清晰解剖标志将CT于超声图像进行调整并融合,以图像重叠后同一解剖结构间距<5mm为融合成功,对位3次未达以上标准视为融合失败。明确诊断后对sHCC患者采用冷循环射频消融系统(美国Valleylab公司)制定消融计划并在超声造影实时引导下布针、穿刺进行RFA治疗,最大输出功率200W,完成后采用融合成像技术实时判断消融范围是否达到5mm安全边界,覆盖满意或靠近胆囊、胆管及肠道等重要结构时可结束治疗,否则根据融合图像及时补针并再次评估以达到消融要求,融合失败者采用超声造影评估消融效果。RFA术后1个月进行初次复查有无残留病灶,然后每3个月复查1次,观察肿瘤复发或进展情况,随访时间为18.3(14~25)个月,以CT、MRI、超声及病理检查等综合判断为金标准,评价超声与CT融合图像评估消融效果的准确性。
1.3 统计学方法数据分析采用SPSS19.0软件,计数资料以率(%)表示,采用χ2检验或McNemar检验,采用一致性Kappa检验分析超声与CT融合图像对sHCC诊断和RFA疗效评估的价值,以P<0.05为差异有统计学意义。
2 结 果
2.1 超声与CT融合图像对sHCC诊断价值分析 以肿瘤最大径<5cm为诊断标准,超声与CT融合图像诊断灵敏度为95.74%,特异度为98.25%,阳性预测值为97.83%,阴性预测值为96.55%,准确率为97.12%,一致性Kappa值为0.942。见表1。
2.2 超声与CT融合图像对位分析47例小肝癌患者共检出病灶71个,其中超声与CT成功对位68个,融合图像成功率为95.77%,融合失败的3个病灶均为单发肿瘤并采用超声造影评估RFA治疗效果,其中2个因术中体位变化导致肝脏解剖位置变化所致,1个与肠气遮挡有关。
2.3 超声与CT融合图像对RFA治疗的指导价值超声与CT成功对位的68个病灶中,RFA术后经融合成像评估显示肿瘤病灶均被完全覆盖,但有14个病灶消融边界<5mm(20.59%),其中5个病灶因靠近胆管或大血管等重要结构而无法达到安全边界,消融边界1~4mm,其余9个病灶经补针后再次评估均达到安全边界;采用超声造影评估的3个病灶均未获得消融安全边缘,且未给予补针,术后3个月采用增强CT或MRI复查显示其中2个病灶边缘不规则强化,手术病理结果证实为sHCC肿瘤病灶残留。
2.4 超声与CT融合图像对RFA疗效的评估价值以肿瘤病灶完全消融为阳性,术后3个月时随访结果显示68个病灶中完全消融67个(98.53%),超声与CT融合图像评估RFA疗效灵敏度为97.01%,特异度为100.00%,准确率为97.06%,一致性Kappa值为0.489。见表2。

表1 超声与CT融合图像对sHCC诊断价值分析
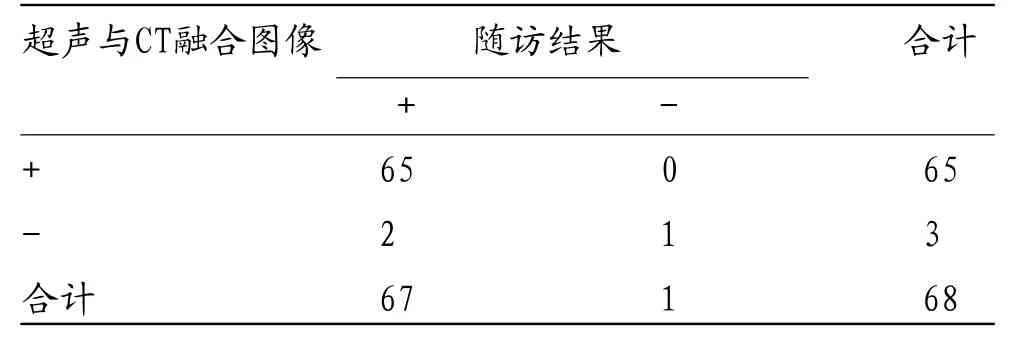
表2 超声与CT融合图像对RFA疗效的评估价值
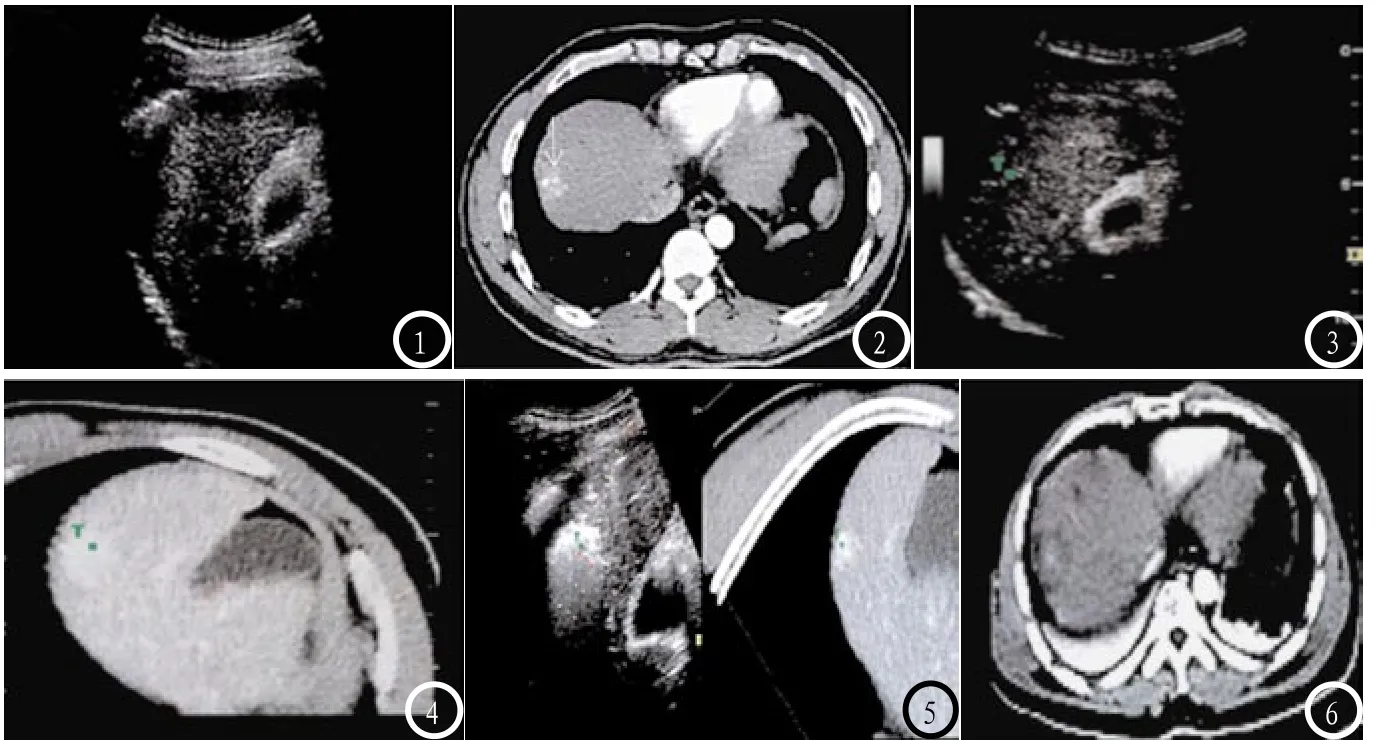
图1-6 超声与CT融合图像引导RFA治疗。图1 为常规超声检查未见明显异常;图2 为增强CT扫描显示肿瘤病灶明显强化(白色箭头);图3-4 为超声与CT融合图像标记病灶位置,系统在超声图像相应位置形成绿色标记,可见仍无病灶显示;图5 为超声与CT融合图像引导RFA治疗;图6 为术后1个月增强CT复查,可见肿瘤病灶完全消融。
2.5 超声与CT融合图像对RFA疗效的影响分析随访结果显示,消融达安全边界的63个病灶中术后复发2个(3.17%),未达边界及超声评估的8个病灶中术后复发3个(37.50%),两组复发率比较差异有统计学意义(χ2=12.776,P<0.05),两组均未见肿瘤转移发生。见图1-6。
3 讨 论
影像学检查是HCC筛查和诊断重要参考依据,B超、MRI及CT均是常用检查方法,其各有优劣[6]。医学融合图像技术起源于20世纪90年代,通过综合多种影像学资料,可全面准确显示组织器官解剖结构、代谢活动及功能变化,从而用于疾病诊断和治疗,其中超声与CT/MRI融合图像已在HCC诊断和消融治疗中广泛应用并取得良好效果[7]。本研究结果显示超声与CT融合图像诊断小肝癌的准确性、敏感度和特异度相对较高,一致性Kappa值为0.942,较刘存兵等[8]报道的MRI和CT增强扫描均具有明显优势,其原因为超声与CT融合图像将两种图像在空间上进行配对合并,利用多模式图像获得互补信息,故而可提升诊断准确率。
RFA是sHCC三种根治性手段之一,安全有效且简便易行,但也可能因三维漏空的缺点导致病灶未彻底清除,因此术后采用有效的影像学方法进行监测和评估对提升治疗效果极为重要[9]。目前RFA多采用二维超声引导消融,需要术者在脑中重建病灶以及邻近解剖结构三维影像并制定消融布针计划和进针路线,对操作者经验依赖性较高,难以达到客观准确消融的效果[10]。本研究采用超声与CT融合图像指导RFA治疗并评估治疗效果,结果显示在超声与CT成功对位的68个病灶中,消融术后经融合成像评估显示肿瘤病灶均被完全覆盖,对于无法达到边界者,经补针后再次评估均达到安全边界,经治疗后复发率相对较低,表明超声与CT融合图像指导sHCC RFA治疗有利于提升消融效果,减少术后肿瘤复发,对延长患者生存期和改善生活质量具有重要意义。同时本研究结果显示,以肿瘤病灶完全消融为阳性,术后3个月时随访结果显示68个病灶中完全消融67个(98.53%),超声与CT融合图像评估RFA疗效,准确率为97.06%,一致性Kappa值为0.489,表明超声与CT融合图像用于RFA疗效评估具有较高准确性。超声与CT融合图像用于RFA治疗可在肉眼可见图像基础上设计合理消融计划,以最少布针次数获得最佳消融效果,同时根据超声实时监测和导航,不仅可避免周围重要结构和大血管损伤,还能实时评估疗效,及时发现残留病灶并给予补充消融,提升RFA治疗效果并减少治疗次数[11]。
综上所述,超声与CT融合图像可提升sHCC诊断准确率,用于RFA治疗可实时评估消融范围是否达安全边界并及时补针治疗,提升消融效果,同时还可有效监测RFA术后肿瘤进展情况。