不同类型低温体外循环对比的实验研究
2020-04-17徐孟辉姜文剑许士俊王晓龙刘愚勇李海洋关欣亮张宏家
李 磊 徐孟辉 姜文剑 贡 鸣 许士俊 王晓龙 刘愚勇 李海洋 关欣亮 张宏家
体外循环(cardiac bypass,CPB)联合低温停循环 (hypothemic circulatory arrest,HCA)广泛用于主动脉和复杂的先天性心脏病外科手术过程中[1-3]。然而HCA的最佳温度选择仍然存在争议,既往研究鲜有涉及不同类型HCA对于脑损伤的大型动物类研究,有关HCA过程中病理生理学改变的研究更是少之又少。HCA的应用可以有效降低大脑代谢率,从而起到在术中保护大脑的作用[4-5]。据统计在应用HCA手术中,术后30 d死亡率及死亡校正后的永久性神经功能障碍发生率仍在19.4%和11.5%左右[6]。研究发现HCA通过诱导内皮细胞功能障碍、凋亡和坏死从而对中枢神经系统产生有害影响[7-8]。
获得应用HCA患者的大脑标本是非常困难的,因此相关的动物实验是必要的。通过对实验动物应用HCA后大脑标本的系统性分析,可以为深入研究HCA相关脑损伤提供可靠证据。本研究目的是利用猪CPB模型中不同HCA类型大脑标本及血清学检测比对结果,通过对相关结果的系统性分析从而发现何种类型HCA更适用于临床需要。
资料与方法
所有实验流程均按照北京安贞医院伦理委员会批准的规程进行。实验动物购于阜外医院北京动物实验中心,并按照国家科学院编制、国家卫生研究院出版的《实验室动物护理与使用指南》进行护理。
1.实验设计 13只猪(阜外医院动物实验中心,北京)被随机分为对照组3只(36 ℃)、深低温停循环组(DHCA鼻咽温15 ℃)5只和中低温停循环组(MHCA鼻咽温25 ℃)。实验组在实施麻醉、气管插管及建立体外循环,对照组实施麻醉、气管插管,并不建立体外循环,实验结束后三组动物均进行解剖取标本。三组动物年龄及体质量无明显差异[4~5个月/(100.2±5.1)kg]。停循环时间持续30 min,分别于10个时间点取血液样本(图1)。获取血液标本储存于肝素管中并摇匀。血液标本于4 ℃下3 000 r/min离心5 min,所得血清储存于-80 ℃下,检验前血清于4 ℃下解冻并再次以3 000 r/min速度离心1 min。具体采血时间点如下:TI=麻醉开始; T2=降温至32℃; T3=降温至目标温度; T4=停循环后30 min; T5=复温至32℃; T6=复温至36℃; T7=复温至36℃后2 h; T8=复温至36℃后4 h; T9=复温至36℃后6 h; T10=复温至36℃后24 h。实验结束后通过矢状面正中切口取出猪大脑标本。

图1 温度变化趋势图
2.实验监测 于仰卧位,经股动脉置入动脉压力导管进行血压监测,经右股静脉置入静脉导管实施输液和采血。采用内嵌式温度探头对鼻咽温度进行监测。本实验分析监测的血流动力学指标包括血压、心率、氧分压及ECG。
3.体外循环步骤 体外循环管路中预充明胶及乳酸钠林格液,麻醉诱导后完全暴露心脏及升主动脉。肝素化后将体外循环管路分别置入升主动脉及右心房。手术过程经体外循环检测系统(MDD, 93/42/EEC, UK)监护。低温停循环的温度由变温水箱(MAQUET, HCU30, Germany)精确调节。体外循环建立后查红细胞压积为20~24%,期间血流维持在90~100 mL·kg-1·min-1,平均动脉压维持在60~90 mmHg(1 mmHg=0.133 kPa)。鼻咽温度降至32 ℃时,阻断升主动脉,于升主动脉根部冠脉开口处灌注心脏停搏液。当鼻咽温降至目标温度时停止体外循环。于深低温停循环组,降温过程持续60 min左右,当鼻咽温度达到15 ℃时,变温水箱继续运行,维持鼻咽温度在15 ℃左右同时停止体外循环。低温停循环30 min后,恢复体外循环运行,鼻咽部温度复温至37 ℃。待实验对象血压及心电波形稳定后,缓慢脱离体外循环并保持存活24 h。中低温停循环组的操作步骤与深低温停循环组相同,但其低温停循环温度更高(25 ℃)。

图2 脑组织切片病理染色
4.标本检测 获取的大脑标本经石蜡包埋,并切成6 mm厚的切片。对这些标本行Bax、Bcl-2和Caspase3染色,以准确检测脑损伤程度。切片使用末端脱氧核苷酸转移酶介导的检测法(TUNEL assay kit, Sigma, No. 11684795910, USA)检测凋亡细胞,操作流程严格按照操作说明书进行。经验丰富的病理学家在高倍光学显微镜下对TUNEL阳性细胞进行计数,标本分组对病理学家不可见。凋亡指数计算方式为:随机选取4个高倍视野(200倍放大)的区域并对其中凋亡细胞进行统计。可溶性蛋白- 100B (S-100B)是一种特异性表达于中枢神经系统的蛋白,有研究表明S-100B指标与大脑神经元损伤呈正相关。因此,本次实验通过检测血液病理情况下中能透过血脑屏障的S-100B水平来评估深低温停循环所引起的脑损伤程度。本实验还对所得血液样本中的炎性因子(TNF-α、IL- 2及IL-6),关键凝血因子(FXI、FVII)进行了Elisa检测。
5.统计学方法 所有分析均采用SPSS 18.0 (SPSS, Inc., Chicago, IL)系统分析,采用Kolmogorov-Smirnov方法检测数据分布的正态性。计量资料以均数±标准差表示,采用单因素方差分析或Wilcoxon秩和检验对连续变量进行比较。分类数据以频数及百分比的形式,并使用卡方检验或Fisher’s检验进行比较。采用Bonferroni校正分析的T检验比较多次测量的10个时间点。以P<0.05为差异有统计学意义。
结 果
1.组织样本分析 实验组免疫组化染色(Bax、Bcl-2、Caspase 3)阳性率明显高于对照组(P<0.05)。实验组内DHCA组与MHCA组(Bax、Bcl-2、Caspase 3)水平差异无统计意义(P>0.05,图2)。同样,TUNEL染色的阳性荧光直方图显示,对照组与实验组间差异有统计意义(P<0.05),但两组差异无统计意义(P>0.05,图3)。
脑组织切片分别行BAX、BCL-2、Caspase-3染色。统计蓝色方框中的阳性因子,并绘制相应的直方图。正常组与实验组间差异有统计学意义(P<0.05),实验组间差异无统计学意义(P>0.05)

图3 脑组织免疫荧光染色
采用DAPI GDNF和TUNEL评价脑神经元损伤程度。通过统计图中绿色方框中TUNEL染色的荧光率并绘制直方图,正常组与实验组之间差异有统计学意义(P<0.05),而两个实验组之间差异无统计学意义(P>0.05)
2.血液样本分析 S-100B检测结果如表1所示,T1~T4时间点两组间结果比较,差异无统计意义(P>0.05)。虽然在MHCA组T5~T6时间点S-100 B出现短暂上升 (T5;P=0.02, T6;P=0.02), 但在随后的T7~T10时间点S-100 B迅速恢复至与DHCA组相似水平(P>0.05)。炎症因子变化如图4所示,炎性因子(TNF-α、IL- 2及IL-6)在DHCA组与MHCA组内变化趋势相似,差异无统计学意义(P>0.05)。凝血因子的变化如图5所示,DHCA组与MHCA组关键凝血因子之间(FXI、FVII)比较发现差异有统计学意义(P<0.05)。
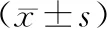
表1 两组可溶性蛋白- 100B分析结果
讨 论
近40年来,HCA广泛应用于影响脑供血的外科手术中,其目的是在心血管外科手术中预防脑缺血相关损伤[9]。在大血管相关手术过程中,于HCA期间行主动脉弓的修复是目前外科专家的共识[10-12]。自从20世纪50年代DeBakey和Cooley实施主动脉弓部置换术以来[10-12],不同类型的HCA分别被应用于该手术之中。当前常规HCA分为四种类型: 28.1~34 ℃为轻度低温停循环,20.1~28 ℃为中度低温停循环,14.1~20 ℃为深度低温停循环和≤14 ℃的极度低温停循环[14]。
在过去,DHCA因其显著降低脑代谢率、兴奋性递质释放、离子流入和血管通透性而受到外科医生的青睐[15]。然而临床研究证据表明,DHCA的降温及复温阶段消耗大量时间,手术及体外循环时间延长引起的并发症将会是一个严重的问题[16-18]。当前临床医生开始在主动脉弓部手术中选择MHCA技术来减轻脑损伤,但是何种类型HCA可以最大程度的减轻大脑损伤尚未确定。在临床实践中,很难在手术后直接获得脑部样本,并且只能通过临床症状间接的评估脑损伤的程度。在本研究中,我们使用了具有与人类类似遗传特征的猪来构建HAC模型,手术后收集标本,并对标本进行病理分析。在比较实验组大脑生物学参数的同时,本研究还系统、整体地研究了对照组脑损伤的程度,从而为选择何种类型低温停循环策略提供了理论依据。
目前,对于HCA后神经系统的变化已成为人们关注的话题,但是很少有研究在不进行脑灌注的情况下对神经元的损伤进行研究,在HCA期间应用选择性脑灌注已成为减少神经损伤的一种策略[19]。大多数学者认为,伴有选择性脑灌注的MHCA对神经系统具有与DHCA相似的保护功能[20]。Keeling等回顾了3 265例行顺行脑灌注全主动脉弓置换术的患者,发现MHCA和DHCA组患者的神经系统并发症或院内死亡率无差异[21]。Gong也得出了类似的结论[22]。此外,Arnaoutakis等发现,顺行性脑灌注的MHCA患者似乎比逆行性脑灌注的DHCA患者预后结局更差[23]。为了获得可靠的不同类型HCA对神经系统影响相关数据,在这项研究中我们并未应用选择性脑灌注。

图4 两组不同时点炎性因子变化趋势图

图5 两组不同时点凝血因子变化趋势图 两组间比较,*P<0.05
在本研究中,我们对位于TUNEL染色脑标本中的凋亡细胞进行了检测并且计算其凋亡指数。Bax是一种与Bcl-2同源的水溶性蛋白质。Bax基因可促进细胞凋亡,属于Bcl-2基因家族。Bcl-2可以抑制许多细胞毒性因子引起的细胞死亡,而Bax的过表达可以拮抗Bcl-2的保护作用并引起细胞死亡[24]。另外,已经有研究发现Bax与Bcl-2的比例是抑制细胞凋亡的关键因素。因此,我们使用免疫组织化学技术测量了脑细胞凋亡的水平,以确定其中凋亡相关蛋白(例如Bax,Bcl-2和Caspase-3)呈阳性的细胞数量。传统理论认为,DHCA患者相对无脑灌注的MHCA患者,会得到更佳的脑保护[25]。但是,我们的结果显示在脑组织凋亡测试中(Bax,Bcl-2和Caspase-3),这两组并没有显着差异。重要的是,在MHCA组中S-100B的水平恢复的很快,这表明,即是在没有选择性脑灌注的两个实验组之间脑损伤程度也是相似的。
TNF-α通过释放一系列炎症介质参与炎症反应,它可以通过增加血管通透性并引起炎性细胞浸润来导致组织损伤。因此,TNF-α被认为在缺血再灌注损伤中起着重要作用[26]。此外,IL-2是人类细胞免疫最重要的调节剂,IL-2的主要免疫调节作用包括:诱导NK细胞的增殖,刺激增强其自然杀伤作用,以及激活巨噬细胞和淋巴细胞[27-28]。血浆中的IL-6浓度与严重的脑损伤有关,血浆IL-6水平可预测脑损伤患者的短期预后[29]。我们随后的研究表明,在两个实验组之间,炎症因子的水平(包括TNF-α,IL-2和IL-6)无明显差异,因此,可认为两个实验组之间的炎症程度相似。由此,我们发现DHCA并未有效减轻炎症,这与我们在二者脑组织样本病理检测并无差别的结果相符。
凝血因子Ⅺ被激活为丝氨酸蛋白酶,通过激活内源性凝血途径促进凝血。人凝血因子VII是外源性凝血途径的初始酶,它已被广泛用于治疗有出血倾向或血友病的患者[30]。我们的研究表明,与炎症系统不同,凝血系统在温度变化时会发生剧烈变化,在HCA期间和之后,凝血因子XI和凝血因子VII水平的变化尤为明显,这与较低温度可能抑制凝血系统功能的观点一致。在这两种凝血系统中,外源性凝血系统受低温影响最严重。
实际上,我们的研究表明,DHCA并不能减轻更多的脑损伤,而且DHCA会伴有诸多并发症,例如严重出血和对血液制品的需求增加[31]。我们的实验还表明,即使在没有脑灌注的情况下,适当升高温度也不会增加炎症反应。总之,与DHCA相比,MHCA需要的冷却和复温的时间更短,从而可能减少长时间的CPB所致的脑损伤。同时与DHCA相比,MHCA对凝血系统的影响要更小。另外,MHCA也没有加重炎症反应。 将来,应在更多的外科手术中使用MHCA,以避免DHCA的不利影响。
这项研究受到一些因素限制。在本实验中,我们使用肝素抗凝管收集血液样本,这可能对实验结果有影响。由于大型动物实验的高经费问题,我们只建立了15℃和25℃低温停循环猪模型,没有对其他温度下或其他器官进行进一步的研究,对于其他温度下猪脑保护的比较还有待深入研究。本研究虽最大限度模拟临床,但所得结论仍需临床深入验证,并不能贸然应用于临床实际。
总体来讲,MHCA是一种具有与DHCA相似的优势的方法,如损伤生物标志物水平和脑凋亡程度相似。两者均与较低的脑血管神经事件发生风险相关。但是,MHCA对凝血系统的影响较小,并且与DHCA相比,需要的冷却和复温时间较短。该研究为MHCA在紧急主动脉弓修复中的临床安全性和有效性提供了证据,表明MHCA比DHCA更合适于临床实践。
致谢我们感谢李嘉晨, 吴子宁, 裴昱强(首都医科大学附属北京安贞医院-北京心肺血管疾病研究所)在稿件撰写过程中对其进行了审阅与修改。
