无机纳米催化剂在化学动力学疗法的研究进展
2020-04-17张旻昳郑喃喃王金霞管少琪王星妍刘锡建
白 鑫,张旻昳,郑喃喃,王金霞,赵 行,管少琪,王星妍,陆 杰,刘锡建
(上海工程技术大学 化学化工学院,上海 201620)
恶性肿瘤(癌症)是最致命的疾病之一,全球每年超过2 000 万人确诊为恶性肿瘤患者,手术治疗无法确保肿瘤组织完全被切除,放疗和化疗在消灭肿瘤细胞的同时也对正常细胞造成不可逆的伤害.近几年,纳米催化药物的发展为肿瘤治疗提供了新的解决方案.由于肿瘤组织具有独特的微环境,如低pH 值、过量H2O2、乏氧、低活性的过氧化氢酶、高浓度活性氧等[1−4],利用肿瘤微环境特异的性质,在病理区域引入无毒或毒性较小的纳米催化剂,可特异性地促进肿瘤内产生有毒的活性氧(Reactive Oxygen Species,ROS),而正常组织不受影响.
2016 年,Zhang 等[5]提出新型治疗方法−化学动力学疗法(Chemodynamic Therapy,CDT).当特制纳米催化剂进入肿瘤的弱酸环境,引发肿瘤细胞进行芬顿或类芬顿反应,在H+的作用下,肿瘤内的H2O2被催化生成•OH,诱导癌细胞损伤和凋亡.这种独特的活性氧产生模式使CDT 能够规避光动力治疗(PDT)中对氧气依赖、对邻近健康组织造成损害和光穿透深度不足等问题[6−10],是一种可以广泛应用的ROS 介导的治疗策略.
1 化学动力学治疗材料
许多纳米材料都可引发瘤内芬顿或类芬顿反应,其中含铁纳米材料尤其受关注[11-12].2012 年,Chen 等[13]发现氧化铁纳米材料是pH 值依赖型,在酸性环境下,可催化H2O2生成•OH,但在中性条件下,催化H2O2分解为O2和H2O.基于此,设计以氧化铁纳米材料为基础的肿瘤治疗平台,在弱酸性的肿瘤中触发•OH 生成,但对处于中性环境下的正常细胞组织没有影响.研究受到科研工作者的广泛关注.图1为含铁纳米材料最典型的芬顿反应,利用Fe2+和H2O2反应产生•OH,通过CDT 治疗肿瘤的方案.
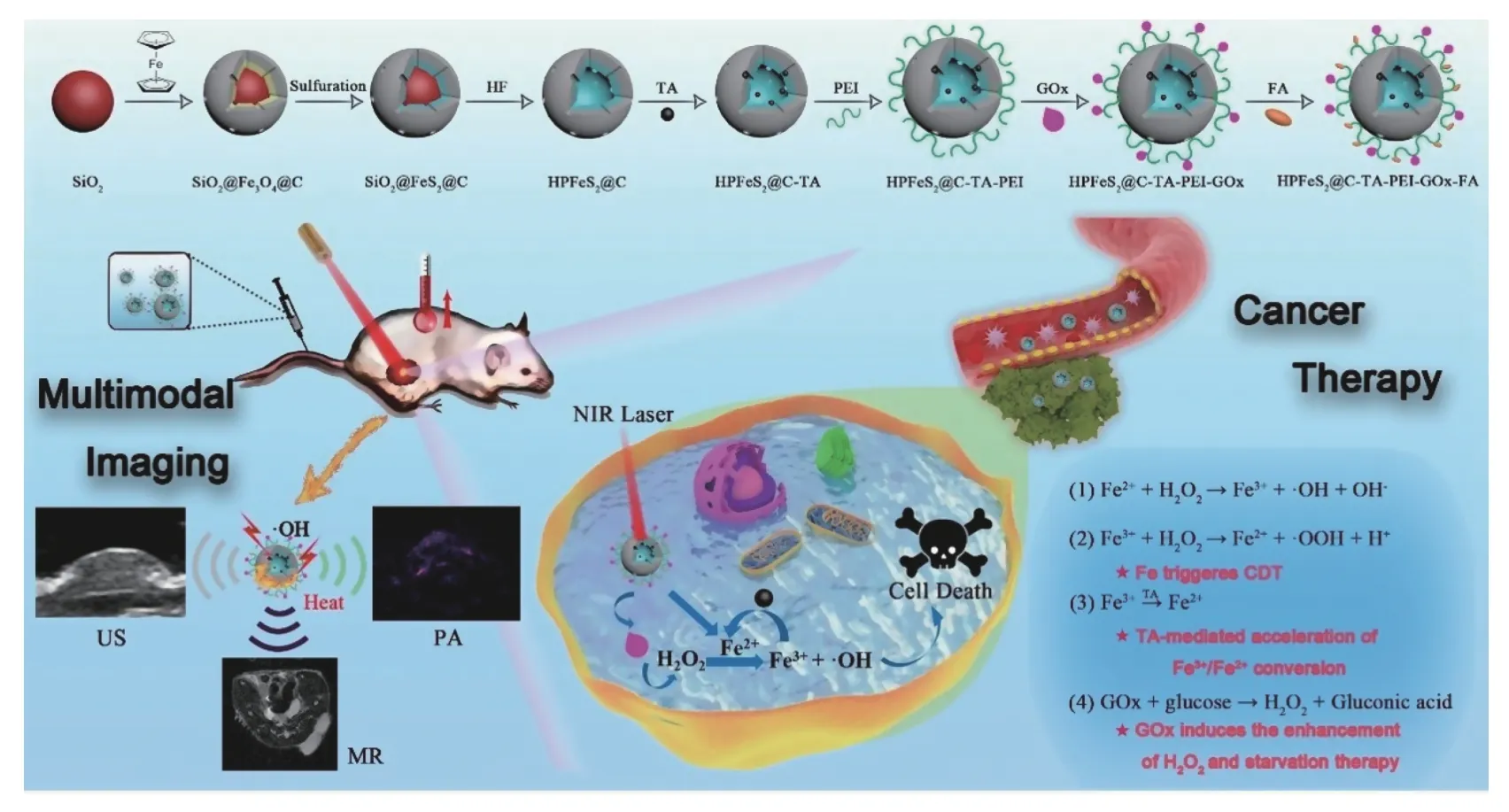
图1 HPFeS2@C-TA-PEI-GOx-FA 的制备工艺及治疗机理[11]Fig.1 Preparation process and therapeutic mechanism of HPFeS2@C-TA-PEI-GOx-FA
可以引发芬顿反应的含铁纳米材料有多种形式,如[FeO(OH)n][14]、Fe3O4−HSA@Lapa NPs[15]、FeS2−PEG[16]等.Huo 等[17]合成树突状单分散二氧化硅纳米微球(DMSNs)以及超小的Fe3O4纳米材料,在三氯甲烷溶剂中,两者通过吸附合成Fe3O4@DMSNs纳米催化剂,进一步通过聚乙二醇修饰后,在醋酸钠溶液中加入葡萄糖氧化酶(GOD),搅拌得到最后产物GOD−Fe3O4@DMSNs.所得纳米材料进入肿瘤细胞后,GOD作为起始酶催化肿瘤区域的葡萄糖,产生大量H2O2,然后Fe3O4催化H2O2生成•OH,提高了CDT 的疗效.
除氧化铁纳米材料外,还有许多其他具有响应生成ROS 能力的纳米催化剂,如Mn2+、Co2+、Cu+等[18−20].Lin 等[21]在室温下,以聚乙烯吡咯烷酮(PVP)作为稳定剂,借助氢氧根离子(OH−),H2O2与Cu2+结合制备过氧化铜(CP)纳米点.在肿瘤酸性环境下,纳米点可逆分解为H2O2与Cu2+,进行芬顿反应,生成•OH,对癌细胞产生杀伤力.具有类似性能的材料还有CoS2NCs[22]、SiO2@MnO2[23]、PLTM−HMnO2@Bu NPs[24]等.
Liu 等[25]制备的铜铁纳米球(CFNs)具有两个氧化还原对(Fe2+/Fe3+和Cu+/Cu2+),可以在650 nm激光照射下,进行芬顿和类芬顿反应,产生•OH,实现光增强CDT.CFNs 中(eCB−/hVB+),可作为有效的光敏剂,产生具有细胞毒性的•OH 和•O2−.CFN 又可通过芬顿反应催化H2O2产生O2,Fe3+和Cu2+消耗谷胱甘肽(GSH)调节肿瘤微环境(TME).由此可见纳米催化剂在肿瘤内同时为CDT 产生O2和•OH,缓解缺氧环境,提高化疗治疗效果.
金属—有机纳米框架(nMOFs)材料具有易于设计、生物安全性高、比表面积大等优点,也广泛用于CDT治疗.Wang 等[26]设计PCN−224(Cu)−GOD@MnO2,MnO2层包覆可以防止材料中的GOD 损害正常细胞,其在TME 中响应分解,同时生成了O2,提高了GOD 的酶活性,GOD 使葡萄糖氧化生成了H2O2,提高TME 中H2O2的浓度.PCN−224(Cu)中的Cu2+,被谷胱甘肽(GSH)还原成Cu+,催化H2O2生成•OH,进行化学动力学治疗.Cu+、H2O 和O2结合,通过Russell 机理生成1O2,可进一步提高治疗效果.
2 CDT 与其他治疗方式协同
CDT 和同光热治疗、化疗、光动力治疗和放疗协同治疗,可显著提高CDT 的治疗效果,解决单一治疗方式疗效不足以及毒副作用较大的问题,丰富了传统肿瘤治疗技术.
2.1 CDT 协同光热治疗
光热治疗(PTT)作为一种微创性局部治疗方式,利用光热材料将近红外激光能量转换为热量消融肿瘤,深受研究者的关注[27].CDT 结合PTT协同治疗,在PTT 产生热疗杀死癌细胞的同时,加速CDT 中•OH 的产生.Shi 等[28]构建具有NIR-Ⅱ生物窗口的Fe 掺杂的多金属氧酸盐(Fe−POM),当材料到达肿瘤微环境时,Fe−POM 中的Fe2+和Mo5+将肿瘤内的H2O2转化为有毒的•OH,促进芬顿反应的发生.Fe3+和Mo6+与肿瘤中的GSH 反应重新变为Fe2+和Mo5+,可再次进行芬顿反应.Fe−POM在酸性介质下可以自组装成较大的纳米结构,在NIR−Ⅱ生物窗口下表现出较强的吸光性.通过电子转移,Mo5+变成Mo6+,转移的电子又可以被H2O2获取,生成•OH,如图2(a)所示.Fe−POM 的光热转化效率高,又能增强CDT.Yang 等[29]将葡萄糖氧化酶(GOX)与SrCuSi4O10结合研发光热治疗增强CDT 的多功能纳米复合材料(SC@G NSs).GOX将瘤内葡萄糖转化为葡萄糖酸,原位生成大量H2O2.葡萄糖酸的生成使pH 值下降,加速SrCuSi4O10的降解,释放Sr2+和Cu2+,与H2O2反应生成•OH,如图2(b)所示.Wang 等[30]设计了空心Cu9S8纳米试剂,活性位点的数量较大,可以实现光声成像引导下的PTT 增强CDT.
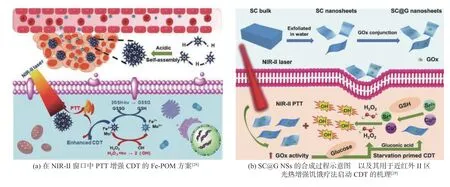
图2 CDT 和PTT 协同治疗Fig.2 Synergistic treatment of CDT and PTT
2.2 CDT 协同化疗
化疗对细胞的选择能力差,治疗结果不理想,化学动力学治疗与化疗的结合,可以解决上述的不足,提高治疗效果.Wang 等[31]制备了LaCIONPs(见图3(a)),可以实现肿瘤特异性药物释放和ROS 生成,LaCIONPs 通过内吞作用进入癌细胞.在酸性环境下,材料中的聚甲基丙烯酸二异丙胺乙酯(PDPA)由憎水性转化为亲水性,La 和铁离子快速释放.在NAD(P)H∶NQO1的催化下,La 生成H2O2,与铁离子通过芬顿反应产生有毒的•OH,提高抗肿瘤活性.H2O2还能引起过草酸酯链断裂,触发材料中药物CPT 的释放.NQO1在正常细胞中的表达量较低,因此LaCIONPs 在正常组织中不会引起显著的H2O2水平的扩增和严重的副作用.Hang等[32]制备DOX−Au@PB NCs,普鲁士蓝(PB)作为临床药物,可由[Fe(CN)6]3−和Fe(Ⅲ)制备,可以将H2O2分解为•OH,负载的阿霉素(Dox)可以进行化疗,还可以在细胞内增加H2O2浓度[33],进一步提高化学动力学治疗效果(见图3(b)).Ren 等[34]合成的PTCG NPs 在肿瘤酸性环境下亚胺连接物裂解,Pt−OH 活化为顺铂,HepG2 细胞将其内化,活性药物从NPs 中有效地释放出来,顺铂通过细胞内部的级联反应提高H2O2的水平,Fe3+催化产生有毒的•OH,提高CDT 治疗效果.
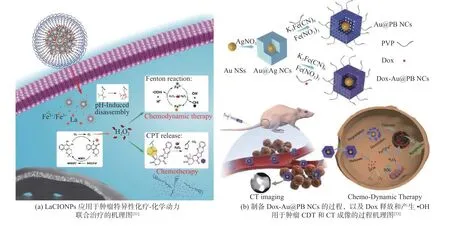
图3 CDT 和化疗协同治疗Fig.3 Synergistic treatment of CDT and chemotherapy
2.3 CDT 协同光动力治疗
光动力治疗(PDT)是通过激光照射光敏剂时,产生外源性ROS,进而杀死癌细胞.但PDT 进一步临床应用受限于外部光的低渗透率和缺氧的肿瘤微环境,通过与CDT 结合可以比较有效的解决此问题.Liu 等[35]制备可生物降解的介孔铜/硅酸锰(mCMSNs)纳米材料,mCMSNs 中存在的硅酸铜,可作为PDT 有效光敏剂,mCMSNs 与GSH 发生氧化还原反应,生成的Cu+和Mn2+催化内源H2O2产生有毒的•OH,进行化学动力学治疗,释放的O2可以缓解肿瘤乏氧的情况,增强CDT/PDT 的抗癌作 用(见 图4(a)).Wang 等[36]制 备H−MnCO3/Ce6−PEG(HMCP NCs),激光照射,光敏剂Ce6 可以进行光动力治疗.MnCO3可以在酸性肿瘤微环境(TME)中特异性降解为Mn2+,触发类芬顿反应生成•OH(见图4(b)).Dong 等[37]设计由上转换纳米颗粒(UCNPs)、二氧化硅壳层和介孔ZnFe2O4壳层组成的纳米平台Y−UCSZ,ZnFe2O4壳层中有氧化还原对(Fe2+/Fe3+),可以通过芬顿反应产生•OH,ZnFe2O4中的光生电子/空穴也可以产生•OH,UCNPs 能有效地将穿透的近红外光子转移到紫外光中,激活ZnFe2O4把氧气转变为有毒的1O2.
2.4 CDT 协同放疗
X 射线和γ射线等电离辐射能深入组织,但造成辐射分解效率较低并对DNA 造成损伤.Ni 等[38]通过电离辐射与光敏化的纳米金属—有机框架(nMOFs)结合,开发了放射—放射动力学治疗(RT−RDT)新的治疗方 式.在RT−RDT治疗过程中,次级构筑单元(SBUs)作为一个能量吸收器,增强X 射线和γ 射线的水辐射分解,导致RT 效应,还将能量传递给光敏剂,实现产生1O2的RDT 效应(见图5(a)).基于以上治疗方式,Ni 等[39]合成一种铪—邻苯二甲酸二丁酯—铁(Hf−DBP−Fe)仿生纳米金属—有机框架,具有过氧化氢酶活性,分解肿瘤环境下的高浓度H2O2,生成O2和•OH(见图5(b)).产生的氧气缓解缺氧环境,通过X 线照射进行RT−RDT,•OH 对肿瘤细胞造成直接损伤,提供化学动力学治疗.这种联合治疗可以根治原发肿瘤,而且通过全身抗肿瘤免疫排斥远端肿瘤.利用肿瘤微环境进行的放射治疗、放射动力学治疗和化学动力学疗法联合高效肿瘤治疗,极大提高了肿瘤治疗效率.

图4 CDT 和PDT 协同治疗Fig.4 Synergistic treatment of CDT and PDT
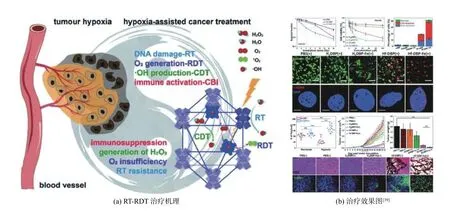
图5 CDT 和放疗协同治疗Fig.5 Synergistic treatment of CDT and radiotherapy
3 总结与展望
本文从化学动力学疗法的原理、纳米催化材料的选择、CDT 协同光热治疗、化疗、光动力学治疗、放疗等几个方面论述CDT 在肿瘤治疗中的应用.CDT 诱导的芬顿/类芬顿反应提供高效精准的治疗;毒副作用低,可以进行特异性治疗,对正常组织的损伤小.但单一的CDT 疗效还比较有限,CDT 协同光热治疗、化疗、光动力学治疗、放疗将是未来的发展趋势,因此针对性地设计一些复合纳米材料用于协同治疗是将来的研究热点.尽管目前CDT 作为一种新技术还存在不成熟的地方,但其为肿瘤的治疗提供了新的方案,是极具潜力的临床转化肿瘤治疗方案.
