呕吐毒素对小鼠T淋巴细胞体外活化及相应活化标志分子的影响
2020-04-16刘双双孙凯蔡国栋宋瑞龙邹辉顾建红袁燕刘学忠刘宗平卞建春
刘双双 孙凯 蔡国栋 宋瑞龙 邹辉 顾建红 袁燕 刘学忠 刘宗平 卞建春
摘要:为探究脱氧雪腐镰刀菌烯醇(deoxynivalenol,简称DON)对离体T淋巴细胞活化的抑制作用,研究DON对刀豆蛋白A(concanavalin A,简称Con A)介导的小鼠离体T淋巴细胞活化及活化标志分子CD69、CD25、CD71的影响,以BALB/c小鼠T淋巴细胞为材料,分设细胞空白组、刀豆蛋白A对照组、不同浓度DON染毒组(Con A+0.5/1/2 μmol/L DON),用CCK-8法检测24h内细胞的相对活性,用流式细胞术分别检测6、30、72 h时CD69、CD25、CD71的表达量。结果显示,DON在终浓度为0.5、1、2 μmol/L时均极显著地降低了Con A介导的T细胞的相对活性(P<0.01),在终浓度为2 μmol/L时显著地降低了T细胞CD69的表达率(P<0.05),在终浓度为0.5、1、2 μmol/L时均极显著地降低了CD25、CD71的表达率(P<0.01),且呈剂量效应关系。由结果可知,脱氧雪腐镰刀菌烯醇对动物机体免疫抑制作用的产生与其直接抑制小鼠T淋巴细胞的活化有关。
关键词:呕吐毒素;脱氧雪腐镰刀菌烯醇;刀豆蛋白;T淋巴细胞;CD69;CD25;CD71
中图分类号: S852.4文献标志码: A
文章编号:1002-1302(2020)04-0150-06
收稿日期:2019-01-15
基金项目:国家重点研发计划支持项目(编号:2016YFD0501208);江苏高校优势学科建设工程资助项目(PAPD)。
作者简介:刘双双(1996—),女,河南漯河人,硕士,主要从事动物营养代谢病与中毒病研究。E-mail:1326247070@qq.com。
通信作者:卞建春,博士,教授,主要从事动物营养代谢病与中毒病研究。Tel:(0514)87979042;E-mail:jcbian@yzu.edu.cn。
脱氧雪腐镰刀菌烯醇(deoxynivalenol,简称DON)又名呕吐毒素(vomitoxin,简称VT)[1-2],是一种由粉红镰刀菌和禾谷镰刀菌产生的单端孢霉烯族毒素,是广泛引起粮食、饲料污染的主要霉菌毒素之一。1970年日本诸罔信一等首次从香川县感染赤霉病的大麦中分离到DON。DON的细胞毒性很强,但无特殊的靶器官,对机体各种器官均有影响。不同动物对DON的敏感程度表现不一,猪最敏感[3]。近年來,在我国动物配合饲料中DON的检出率高达98.02%,在猪饲料中最高含量达到4 773 μg/kg,远远超出我国限量标准(1 000 μg/kg),引起了养殖业的广泛重视[4-5]。目前,国内外对DON毒性的研究主要集中在动物生产性能、器官组织病理损伤、免疫功能等方面[6]。大量研究证明,DON可对动物机体的免疫系统产生明显的急、慢性毒性作用。据报道,一次急性染毒DON可以导致小鼠肝、肾、脾、胸腺的细胞损伤,诱导和促进免疫细胞的凋亡并抑制其增殖[7-8]。T淋巴细胞在细胞免疫中发挥主要作用,而其发挥作用的重要前提和基础是T细胞必须经过活化及增殖[9-10]。目前的研究表明,DON在体内外均可抑制T淋巴细胞的活化与增殖[7,11],但其作用机制尚未阐明。为了揭示DON抑制T淋巴细胞的活性与活化作用的机制,本研究分析了DON对离体T淋巴细胞活化过程的影响,并研究了DON对T细胞早期活化抗原CD69、中期活化抗原CD25和CD71表达的影响,本研究结果可以为DON中毒的防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 清洁级BALB/c小鼠,雄性,4~5周龄,体质量(20±2) g,购自扬州大学实验动物中心。
1.1.2 主要试剂与仪器 脱氧雪腐镰刀菌烯醇、刀豆蛋白(concanavalin A,简称Con A),购自美国Sigma公司;CD3-APC、CD69-FITC、CD4-FITC、CD25-PE、CD71-PE流式抗体,购自美国BD公司;RPMI-1640完全培养液,含10%胎牛血清(Gibco)、L-谷氨酰胺(2 mmol/L,Sigma)、二巯基乙醇(50 μmol/L,Sigma)、1%青链霉素(青霉素、链霉素比例为1 ∶1)、RPMI-1640培养基粉末(Gibco);Cell Counting Kit-8,东仁化学科技有限公司;红细胞裂解液,购自索莱宝生物科技有限公司。
CyAn ADP7流式细胞仪,美国Beckman Couiter公司生产;CO2培养箱,美国Thermo生产;Tecan Sunrise光吸收酶标仪,澳大利亚Tecan公司生产;SW-CJ-1F型单人双面净化工作台,苏州净化设备有限公司生产;5810R台式高速冷冻离心机,德国Eppendorf公司生产。
1.2 试验方法
1.2.1 脾脏淋巴细胞悬液的制备 将BALB/c小鼠断颈处死,无菌摘取脾脏,用组织研磨棒在200目滤网上研磨过滤,制备单细胞悬液。加入红细胞裂解液处理3 min后,用无菌磷酸缓冲盐溶液(PBS)洗涤细胞2次,1 000 r/min离心8 min。
将细胞按一定比例稀释后重悬于1 mL 10%胎牛血清RPMI-1640完全培养液中,用台盼蓝染色计数活细胞数(活细胞数占总细胞数的95%以上),最终调整为细胞密度为3×106 mL的淋巴细胞悬液。
1.2.2 CCK-8法检测DON对小鼠T淋巴细胞体外存活的影响 本试验分别设细胞空白组(Control组)、Con A对照组(终质量浓度为5 mg/L,参照笔者所在实验室前期的研究成果[12],下同)、Con A+0.5 μmol/L DON(终质量浓度,下同)组、Con A+1 μmol/L DON组、Con A+2 μmol/L DON组,将制得的淋巴细胞悬液接种于12孔板中,每孔1 mL,于药物处理组中加入相应浓度的DON工作液各2 μL(终质量浓度与各处理组对应),除细胞空白组外,每组加入5 μL Con A(终浓度为5 mg/L)。混匀每孔中的培养液,分组加入96孔板中,每组设6个重复,100 μL/孔,同时设立空白对照孔(不加细胞),之后在37 ℃、5% CO2培养箱中继续培养24 h。加入CCK-8试剂,10 μL/孔,于37 ℃、CO2培养箱中培养3 h后,立刻用酶标仪在450 nm处测定吸光度。根据公式[细胞相对存活率=(处理组吸光度-空白对照组吸光度)/(Con A组吸光度-空白对照组吸光度)]计算细胞相对存活率。具体公式如下:
细胞存活率=[(D450 nm(s)-D450 nm(b))/(D450 nm(c)-D450 nm(b))]×100%;
抑制率=[(D450 nm(c)-D450 nm(s))/(D450 nm(c)-D450 nm(b))]×100%。
式中:s表示試验孔;c表示对照孔;b表示空白孔。
1.2.3 T细胞CD69、CD25、CD71表达的检测 采用直接免疫荧光标记法染色,细胞培养6 h后,取样离心,用冷PBS清洗2次后,将细胞悬液浓缩至100 μL,分别加入1 μg CD3-APC、CD69-FITC单克隆抗体;细胞培养30 h后,分别加入1 μg CD25-PE、CD4-FITC单克隆抗体;细胞培养72 h后,分别加入1 μg CD71-PE、CD3-APC单克隆抗体,4 ℃避光孵育30 min,用冷PBS离心洗涤1次,重悬于500 μL PBS中,立即上流式细胞仪(FACSCalibur)检测。
1.2.4 统计学分析 所有数据以均值±标准差表示,用SPSS 22.0软件进行单因素方差分析,组间比较采用配对t检验,以P<0.05、P<0.01作为差异显著性判断标准。
2 结果与分析
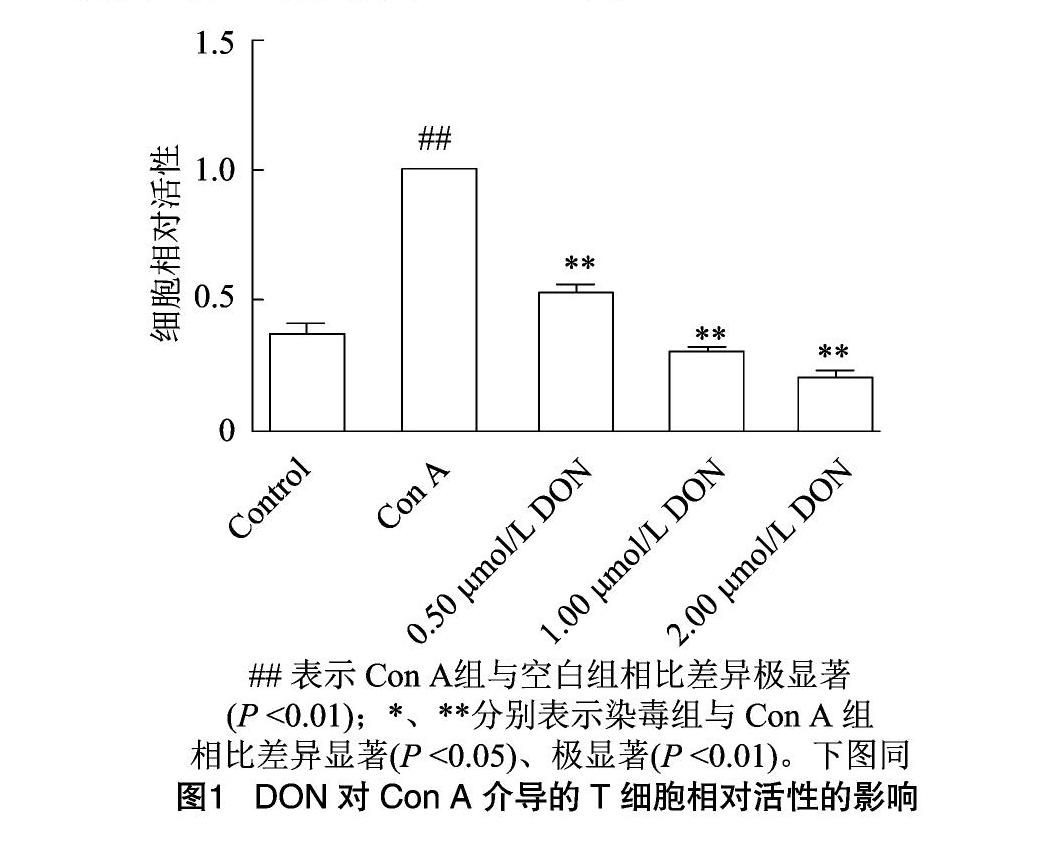
2.1 DON对小鼠T淋巴细胞相对活性的影响
小鼠T淋巴细胞培养24 h后,用酶标仪在450 nm 处测定吸光度,以此来计算细胞的相对活性。由图1可见,加入Con A后,与细胞空白组对比,细胞的相对活性极显著提高(P<0.01);加入DON后,各染毒组细胞活性均降低,与Con A比较均存在极显著差异(P<0.01)。
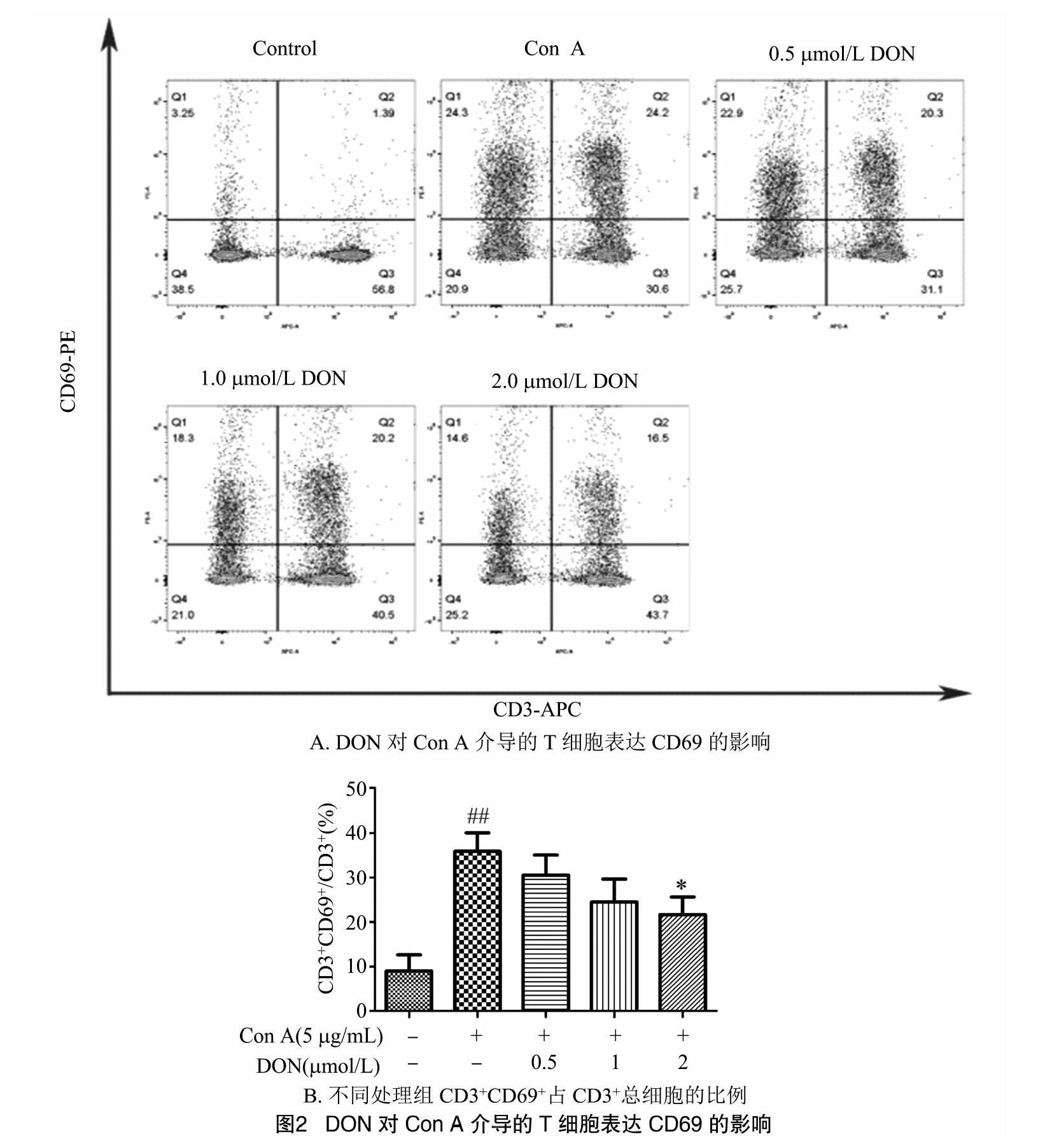
2.2 DON对小鼠T淋巴细胞CD69表达的影响
小鼠T淋巴细胞培养6 h后,用流式细胞术检测T淋巴细胞早期活化抗原CD69的表达情况。如图2所示,细胞空白组小鼠CD3+T细胞中CD69+T细胞的比例为(9.04±6.24)%,即CD69的表达率为(9.04±6.24)%。在用Con A刺激6 h后,其CD69表达量达到(35.88±7.20)%,与空白组相比极显著升高(P<0.01)。加入DON后,随着DON终浓度的升高,Con A介导的T细胞CD69表达呈现下降趋势,并具有剂量-效应关系,2 μmol/L DON组与Con A组相比差异显著(P<0.05)。
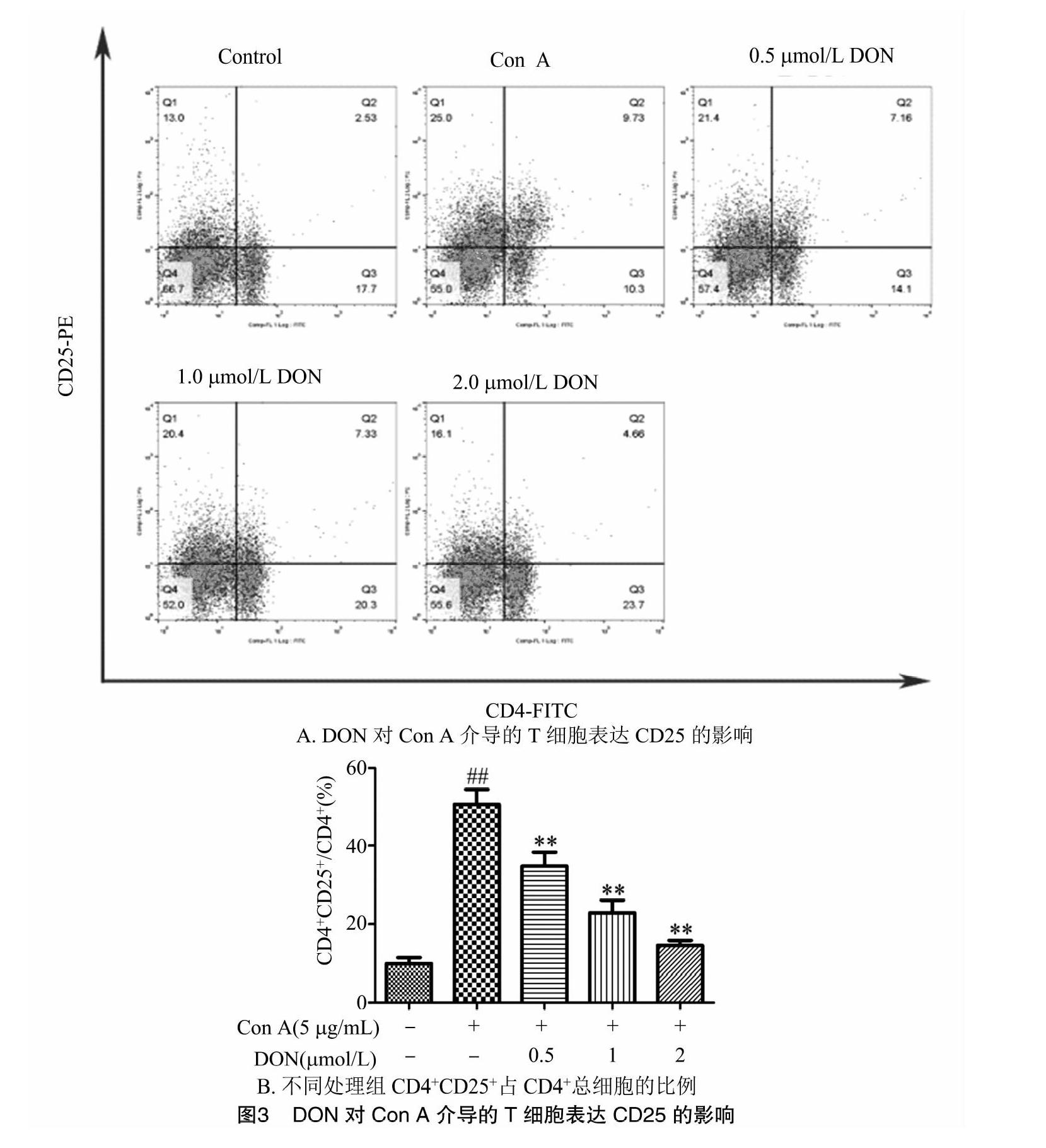
2.3 DON对小鼠T淋巴细胞CD25表达的影响
小鼠T淋巴细胞培养30 h后,用流式细胞术检测调节T淋巴细胞中期活化抗原CD25的表达。由图3可以看出,细胞空白组小鼠CD4+T细胞中CD25+T细胞的比例为(9.88±2.57)%,即CD25的表达率为(9.88±2.57)%。在用Con A刺激30 h 后,其CD25表达量达到(50.64±6.54)%,与空白组相比极显著升高(P<0.01)。加入DON后,随着DON终浓度的升高,Con A介导的T细胞CD25表达呈现下降趋势,并具有剂量-效应关系,各染毒组与Con A组相比均有极显著差异(P<0.01)。
2.4 DON对小鼠T淋巴细胞CD71表达的影响
小鼠T淋巴细胞培养72 h后,用双抗体染色法结合流式细胞术检测调节T淋巴细胞中期活化抗原CD71的表达。由图4可以看出,细胞空白组小鼠CD3+T细胞中CD71+T细胞的比例为(2.88±2.57)%,即CD71表达率为(2.88±2.57)%。在用Con A刺激72 h后,其CD71表达量达到(35.81±6.54)%,与空白组相比极显著升高(P<0.01)。加入DON后,随着DON终浓度的升高 Con A介导的
T细胞CD71的表达量呈现下降趋势,并具有剂量-效应关系,各染毒组与Con A组相比均有极显著差异(P<0.01)。
3 讨论
DON对谷物的污染状况相当普遍,其对动物机体免疫功能的影响已经引起医学界的广泛重视。DON在高浓度时可诱导免疫细胞凋亡,从而引发免疫抑制;在低浓度时可抑制免疫细胞增殖和细胞因子的分泌,扰乱免疫系统的正常功能[13]。DON也可通过对淋巴结和脾脏中免疫细胞数量和功能的调节,引起小鼠淋巴细胞免疫球蛋白A(IgA)分泌量升高[14]。Kim等报道,DON可导致雄性小鼠体内IgM、IgG的含量明显降低[15]。Ouyang等研究发现,DON能延迟或抑制体外培养CD4+T淋巴细胞的增殖[11]。总之,DON可以通过诱导免疫细胞凋亡、抑制其增殖而影响免疫细胞因子的分泌及抗体的表达,进而对细胞免疫和体液免疫产生影响。淋巴细胞是动物机体进行免疫调节的核心成分,其中T淋巴细胞是淋巴细胞中数量最多、功能最复杂的一类。它具有多种生物学功能,如直接杀伤靶细胞、辅助或抑制B细胞产生抗体、对特异性抗原或促有丝分裂原的应答反应以及产生细胞因子等,此外,T淋巴细胞对机体抵御疾病也发挥着非常重要的作用[16]。目前,在关于DON免疫毒性机制的相关研究中,虽已有报道表明,DON可以抑制T淋巴细胞的增殖,但其作用机制尚不明确。T淋巴细胞的活化是其发挥免疫功能的重要前提和基础[9]。本试
验在证明了DON对小鼠活化过程中的T淋巴细胞相对有明显的抑制作用的基础上,进一步探究了DON对T细胞活化抗原表达的影响。
Con A是T细胞多克隆刺激剂,可以作用于T细胞表面的T细胞抗原受体(TCR)-CD3复合体,从而刺激T细胞活化及增殖反应[17]。T细胞活化后可诱发静止细胞分泌淋巴因子IL-4、γ-IFN等,同时表达一系列新的表面分子(如高亲和力CD69和CD25)等[18-20],这些分子被称为表面活化标志。CD69是一种Ⅱ型跨膜糖蛋白,是活化的T细胞表面最早表达的分子。静止状态下的T细胞一般不表达CD69,在活化后1~2 h即可以检测到CD69的表达[21],它可以作为细胞共刺激信号进一步增强细胞的活化或增殖分化,可介导细胞激活后细胞因子的合成[22],因此CD69可作为T细胞早期活化的标志。本研究发现,DON可抑制Con A介导的T淋巴细胞CD69的表达,说明DON可通过抑制CD69的表达来降低细胞前期活化的效应。CD25是IL-2(白介素2)受体的α链,分子量为55 ku,主要在CD4+T细胞上表达[23]。IL-2受体能否表达主要取决于T细胞对IL-2的应答,极少部分静止的T细胞会表达IL-2受体,而活化的T细胞表达量明显上升,因为T细胞通过抗原提呈细胞(APC)递呈的抗原产生活性后,能使T细胞膜表面表达CD25即IL-2R,并分泌产生大量IL-2。因此可见,CD25可反映活化T细胞的增殖,被认为是激活T淋巴细胞的标志[24]。本研究发现,DON可抑制Con A介导的T淋巴细胞CD25的表达,并可能因此抑制T细胞对IL-2的应答,从而影响免疫功能。CD71是转铁蛋白受体(TfR),表达于活化的白细胞,分子量约为95 ku,是细胞生长和吸收铁所必需的蛋白。TfR是一种Ⅱ型跨膜糖蛋白,是由2个同源二聚体(180 ku)的亚基通过2条二硫键交联而成的。TfR的表达量主要是根据细胞内的铁水平进行转录调节的[25],所有正常细胞都能低水平表达CD71,但处于高增殖状态的细胞表达水平会明显升高。CD71不仅仅参与铁的吸收,在细胞的生长、增殖中发挥作用,同时具有免疫调节功能,可以提供激活T细胞所必需的第二刺激信号,这也表明CD71是正常T细胞成熟所必需的。本研究发现,DON可以抑制Con A介导的T淋巴细胞CD71的表达,影响了细胞的生长、增殖和免疫调节功能的发挥。本研究还发现,DON可通过抑制T淋巴细胞的活化及表面活化标志分子的表达,影响动物机体细胞免疫的调节功能,从而引起免疫抑制的发生。
4 结论
DON可直接抑制Con A介导的小鼠T淋巴细胞体外活化,并且能够抑制早期活化标志CD69及中期活化标志CD25、CD71的表达。这一结果表明DON对动物免疫系统的抑制作用与其可直接抑制T淋巴细胞的活性与活化作用有关。
参考文献:
[1]Plattner R D,Maragos C M. Determination of deoxynivalenol and nivalenol in cornand wheat by liquid chromatography with electrospray mass spectrometry[J]. Journal of AOAC International,2003,86(1):61-65.
[2]金秀娟,朱旭东. 脱氧雪腐镰刀菌烯醇的检测[J]. 粮食加工,2010,35(3):87-89.
[3]Pestka J J. Deoxynivalenol:mechanisms of action,human exposure,and toxicological relevance[J]. Archives of Toxicology,2010,84(9):663-679.
[4]杜 妮. 2012年我国部分地区饲料及原料霉菌毒素污染调查报告[J]. 养猪,2013(4):9-11.
[5]王金勇,刘颖莉,关 舒. 2013年中国饲料和原料霉菌毒素检测报告[J]. 国外畜牧学(猪与禽),2014,49(3):49-51.
[6]黄 凯,朱风华,宋明明,等. 呕吐毒素体外对鸡脾脏淋巴细胞的毒性作用[J]. 中国畜牧杂志,2015,51(13):34-37.
[7]支 媛,方业鑫,刘海波,等. 脱氧雪腐镰刀菌烯醇一次经口染毒对雄性小鼠的影响[J]. 毒理学杂志,2018,32(1):11-17.
[8]林少青,董 斌. 脱氧雪腐镰刀菌烯醇的免疫毒性研究进展[J]. 广东饲料,2009,18(7):43-45.
[9]Craston R,Koh M B C,McDermott A B,et al. Temporal dynamics of CD69 expression on lymphoid cells[J]. Journal of Immunological Methods,1997,209(1):37-45.
[10]李月红,张祥宏,邢凌霄,等. 脱氧雪腐镰刀菌烯醇对人外周血单个核细胞HLA-Ⅰ分子表达的影响[J]. 细胞生物学杂志,2004,26(3):297-300.
[11]Ouyang Y L,Azcona-Olivera J,Murtha J,et al. Vomitoxin-mediated IL-2,IL-4,and IL-5 superinduction in murine CD4+T cells stimulated with phorbol ester and calcium ionophore:relation to kinetics of proliferation[J]. Toxicology and Applied Pharmacology,1996,138(2):324-334.
[12]蔡国栋,孙 凯,项自来,等. 玉米赤霉烯酮对小鼠T淋巴细胞体外活化、增殖的影响[J]. 畜牧兽医学报,2017,48(7):1357-1364.
[13]Jia Q S,Zhou H R,Bennink M R,et al. Docosahexaenoic acid attenuates mycotoxin-induced immunoglobulin a nephropathy,interleukin-6 transcription,and mitogen-activated protein kinase phosphorylation in mice[J]. Journal of Nutrition,2004,134(12):3343-3349.
[14]张天宇,赵 勇,李 兰,等. 脱氧雪腐镰刀菌烯醇的毒理学特征及对猪业生产危害的研究进展[J]. 家畜生态学报,2017,38(11):84-88.
[15]Kim E J,Jeong S H,Cho J H,et al. Plasma haptoglobin and immunoglobulin as diagnostic indicators of deoxynivalenol intoxication[J]. Journal of Veterinary Science,2008,9(3):257-266.
[16]徐占云,秦睿玲,褚耀诚,等. 枸杞多糖对雏鸡淋巴细胞体外增殖及分泌IL-2的影响[J]. 畜牧兽医学报,2013,44(2):322-328.
[17]曾叢梅,蔡树涛,周凤兰,等. ConA激活小鼠胸腺T淋巴细胞增殖过程中c-myc与核骨架蛋白的结合[J]. 中国科学(C辑),1996,26(4):326-330.
[18]徐卫东,范永升,谷焕鹏,等. 雄黄对MRL/lpr狼疮小鼠抗ds-DNA 抗体和T细胞表面分子CD69、CD25表达的影响[J]. 中国医学创新,2012,9(31):1-3.
[19]Wang K P,Gu J,Ni X H,et al. CD25 signaling regulates the function and stabilityof peripheral Foxp3+ regulatory T cells derived from the spleen and lymph nodes of mice[J]. Molecular Immunology,2016,76:35-40.
[20]Chien M W,Lin M H,Huang S H,et al. Glucosamine modulates T cell differentiation throughdown-regulatingN-linked glycosylation of CD25[J]. Journal of Biological Chemistry,2015,290(49):29329-29344.
[21]吴丹丹,汪慧英. CD69在细胞活化、凋亡中的双向免疫调节作用[J]. 中国病理生理杂志,2010,26(9):1859-1862.
[22]Krechetova L V,Vtorushina V V,Nikolaeva M A,et al. Expression of early activation marker CD69 on peripheral blood lymphocytes from pregnant women after first trimester alloimmunization[J]. Bulletin of Experimental Biology & Medicine,2016,161(4):1-4.
[23]傅云峰,吕卫国. 白介素2受体及其与肿瘤免疫逃逸[J]. 上海免疫学杂志,2002,22(2):132-134.
[24]郑兴斌,杨伟明,赵洪远,等. 大肠癌组织中CD25、CD28的表达变化及意义[J]. 山东医药,2011,51(2):70-71.
[25]张洪明. 转铁蛋白受体的结构、表达及功能[J]. 实用临床医药杂志,2008,12(3):114-117.
