百里醌对HUVECs细胞凋亡的影响及其机制
2020-04-16周瑜李家富冯健
周瑜 李家富 冯健
(西南医科大学附属医院心内科,四川 泸州 646000)
动脉粥样硬化(AS) 是缺血性心血管疾病的主要病理基础,是导致死亡的主要疾病之一〔1〕。血管内皮细胞凋亡的发生和AS及血栓形成存在密切联系〔2〕,研究发现自噬在心血管凋亡中发挥重要功能,自噬功能受损时垃圾蛋白和缺陷性细胞器持续性积累导致细胞凋亡发生〔3,4〕。百里醌能通过抗凋亡和抗氧化应激保护吗啡对肾脏的毒害作用〔5〕,前期研究表明百里醌能够激活鳞状细胞癌自噬〔6〕,本研究旨在证实百里醌通过调节自噬参与对心血管疾病的保护作用。
1 材料与方法
1.1材料与试剂 人脐静脉内皮细胞(HUVECs)购于中国科学院昆明细胞库。DMEM培养基购自美国Gibco公司,胎牛血清购自美国Gibco公司。百里醌、过氧化氢和选择性磷脂酰肌醇-3-激酶(PI3K)抑制剂(3-MA)购自美国Sigma-Aldrich公司,自噬双标腺病毒(GFP-LC3)购自上海吉凯基因化学技术有限公司,膜联蛋白(Annexin)V-FITC/碘化丙啶双标记细胞凋亡检测试剂盒购自广州达博生物有限公司,蛋白激酶B(Akt)、磷酸化(p)-Akt、哺乳动物雷帕霉素靶蛋白(mTOR)、p-mTOR、人抑癌基因(Beclin1)、B淋巴细胞瘤-2基因(Bcl-2)和含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3/活化的(Cleaved)Caspase-3购自美国CST公司,自噬相关基因(LC3)-Ⅰ/LC3-Ⅱ购自美国abcam公司,β-actin抗体购自沈阳万类生物科技有限公司。
1.2细胞培养 HUVECs培养于含10%胎牛血清的DMED培养基,加入100 μg/ml青霉素和链霉素(Sigma,USA),置于37℃、5%CO2的培养箱内。每2~3 d换液,每4~5 d胰蛋白酶消化离心后传代。使用百里醌处理HUVECs细胞24 h,然后加入800 μmol/L过氧化氢处理1 h。根据百里醌浓度的不同将细胞分为四组,即阴性组(不加百里醌及过氧化氢)、对照组(800 μmol/L 过氧化氢)、低浓度组(10 μmol/L百里醌+800 μmol/L 过氧化氢)及高浓度组(20 μmol/L百里醌+800 μmol/L过氧化氢);研究自噬作用时使用3-MA(1 mmol/L)和百里醌(20 μmol/L)与HUVECs细胞共培养24 h,加入800 μmol/L过氧化氢处理1 h,收集细胞备后续检测,根据处理方式的不同将细胞分为:对照组(800 μmol/L过氧化氢);阴性组(不加百里醌及过氧化氢);百里醌组(20 μmol/L百里醌+800 μmol/L 过氧化氢);3-MA组(1 mmol/L 3-MA+800 μmol/L 过氧化氢);联合组(20 μmol/L百里醌+1 mmol/L 3-MA+800 μmol/L 过氧化氢)。
1.3四甲基偶氮唑蓝(MTT)方法检测细胞增殖能力 将生长到对数期的HUVECs细胞用0.25%胰蛋白酶消化收集于离心管,用4 ml含10%胎牛血清培养基制成细胞悬液并细胞计数,按每孔8 000个细胞接种于96孔板,每孔200 μl置于37℃、5%CO2培养箱24 h,去掉上清液,阴性组、对照组、低浓度组、高浓度组均设置5个副孔,去上清液,每孔加入含10% MTT液的DMEM培养基200 μl,再次置入37℃、5%CO2培养箱培养4 h。去上清液,每孔加150 μl二甲基亚砜(DMSO),摇床上低速振荡10 min,在酶联免疫检测仪(OD=490 nm)处测定各孔的OD值,做出细胞生长曲线。
1.4GFP-LC3荧光检测细胞自噬水平 GFP-LC3预实验感染确定HUVECs细胞感染复数(MOI)值为50,调整细胞密度将HUVECs细胞接种于6孔板中,转染前用DMEM培养液清洗细胞,使用完全培养基稀释聚凝胺至终浓度50 μg/ml,细胞加入5 μg/ml的聚凝胺和相应体积病毒转染HUVECs细胞,荧光显微镜下检测荧光蛋白表达。胰酶消化离心,调整细胞密度为20×104/ml,24孔板中加入细胞爬片,每孔加入2×104细胞,放置于培养箱中培养至细胞贴壁,按1.2方法处理细胞,取出爬片用磷酸盐缓冲液(PBS)清洗,加入4%多聚甲醛固定,PBS清洗后加入DAPI染色,应用封片剂封片,在激光共聚焦显微镜下观察细胞爬片。
1.5流式细胞仪分析细胞凋亡 6孔板接种细胞,每孔接种1×105细胞培养过夜,按1.2方法处理细胞,胰酶消化离心收集细胞,800 r/min离心5 min并用PBS清洗细胞2次,加入250 μl结合缓冲液重悬细胞,调节细胞浓度为1×106/ml,取100 μl细胞悬液放置于5 ml流式管中,管内加入5 μl Annexin V-FITC(150 mg/L)和10 μl碘化丙锭(120 mg/L)并混匀,室温条件下避光孵育15 min,加入400 μl PBS,应用流式细胞仪分析细胞凋亡率。
1.6Western印迹检测相关蛋白表达 细胞胰蛋白酶消化离心后传代,种于6孔板内,待细胞贴壁后按1.2方法处理细胞。取出并弃去上清,用PBS冲洗3次加入细胞裂解液,冰上静置1 min后刮下裂解物并转移至1.5 ml离心管,震荡混匀30 s,冰上静置10 min,4℃、15 000 r/min离心15 min,提取上清总蛋白。留取5 μl定量,其余加入6×上样缓冲液(1∶5体积比)后在沸水中煮沸5 min变性。取30 μg蛋白上样,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,用110 V电压2 h将凝胶上的蛋白转至硝酸纤维素(NC)膜上。50 g/L脱脂奶粉将膜封闭1 h后,将膜置于特定一抗,4℃摇床上孵育过夜。次日使用TBST洗膜液10 min/次洗3次并置于相应的二抗,常温摇床慢速孵育1 h,10 min/次洗3次后使用电化学发光(ECL)显影液进行显影,目的蛋白表达量通过与内参蛋白β-actin标准化后得到相对比值。
1.7统计学分析 采用SPSS18.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1百里醌降低过氧化氢引起的HUVECs细胞凋亡 对照组细胞存活率显著低于阴性组(P<0.05),百里醌预处理可以提高细胞存活率,并随药物浓度加大而增强,呈现出浓度依赖性关系(P<0.05);百里醌预处理后Cleaved Caspase-3蛋白水平较对照组显著下调(P<0.05);百里醌预处理可以降低由过氧化氢引起的HUVECs细胞凋亡(P<0.05)。见图1、表1、图2。
2.2百里醌激活HUVECs细胞自噬 低、高浓度组LC3蛋白水平显著低于对照组(P<0.05);低、高浓度组GFP-LC3蛋白水平显著高于对照组(P<0.05);见表1、图3、图4。

1~4:阴性组、对照组、低浓度组、高浓度组;图3、6、7同
表1 各组细胞存活率、细胞凋亡率和Caspase-3、Cleaved Caspase-3、LC3蛋白表达及GFP-LC3比较
与阴性组比较:1)P<0.05;与对照组比较:2)P<0.05;与低浓度组比较:3)P<0.05

图2 流式细胞仪检测各组细胞凋亡
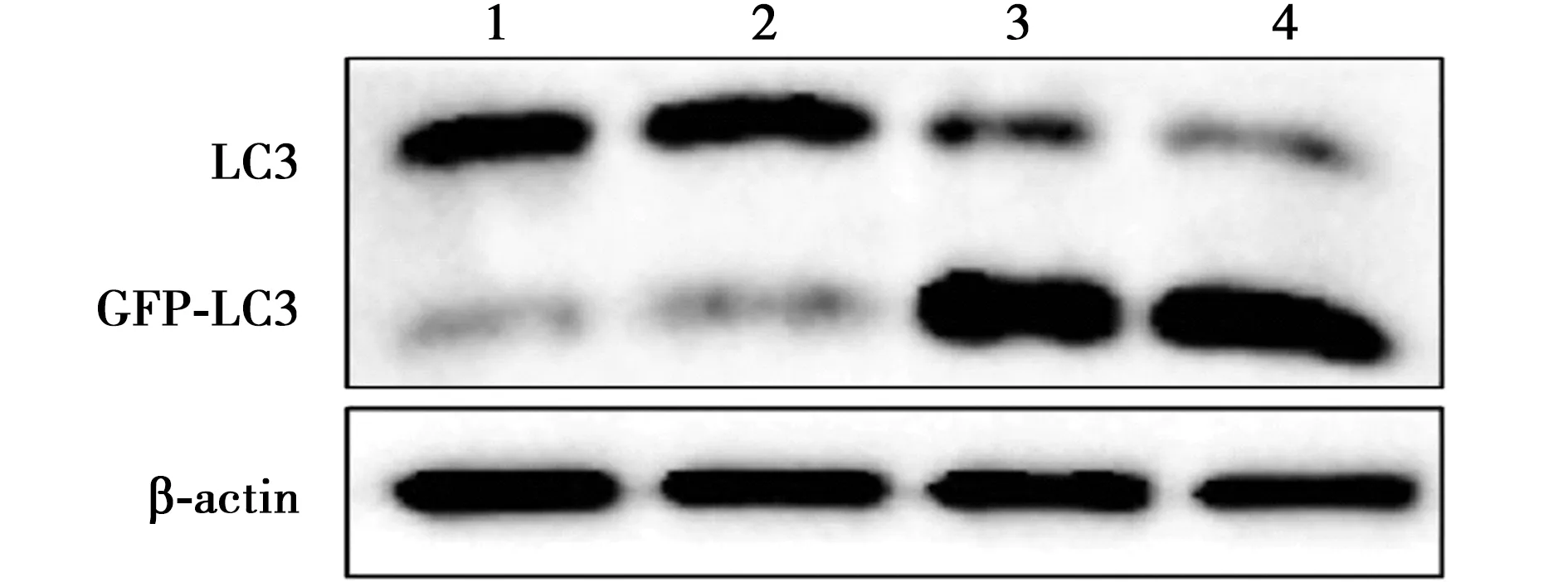
图3 Western印迹法检测LC3蛋白表达
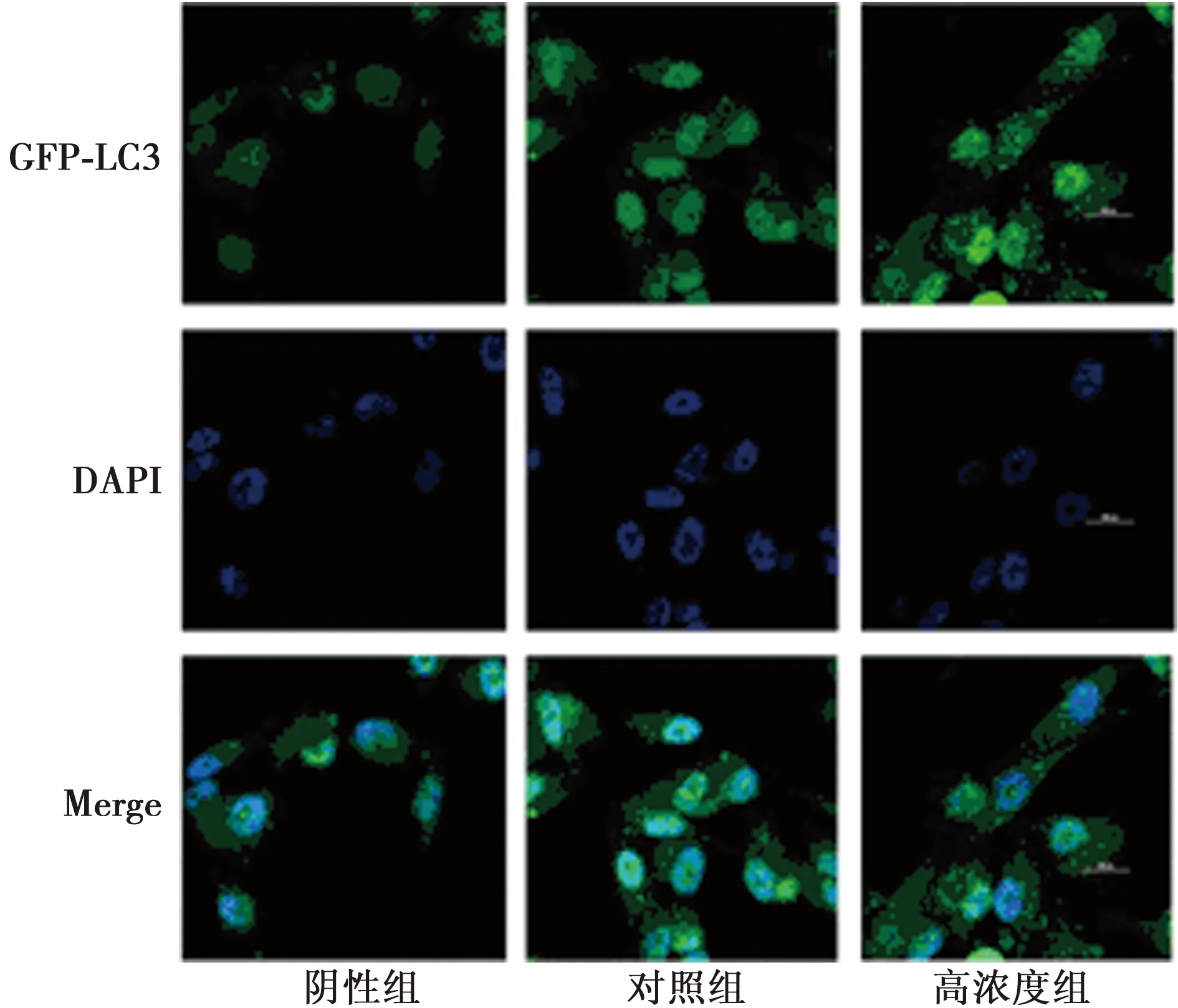
图4 百里醌激活HUVECs细胞自噬(DAPI,×200)
2.3阻断自噬途径百里醌对HUVECs细胞保护作用减弱 10 μmol/L和20 μmol/L百里醌预处理细胞后加入过氧化氢,应用MTT方法检测细胞存活率分别为(47.673±0.976)%和(68.783±7.569)%。加入3-MA阻断自噬途径,再使用百里醌和过氧化氢处理细胞,细胞存活率分别为(23.099±2.801)%和(34.563±3.018)%,差异具有统计学意义(F=43.198,P=0.000),发现阻断自噬后百里醌保护作用减弱(P<0.05)。使用Western印迹检测Caspase-3、Cleaved Caspase-3蛋白水平变化,结果显示阻断自噬后Cleaved Caspase-3蛋白水平上调且加入百里醌预处理并不能导致Cleaved Caspase-3蛋白水平下调。见图5、表2。

1~5:对照组、阴性组、百里醌组、3-MA组、联合组

表2 不同组别间Caspase-3、Cleaved Caspase-3蛋白相对表达
2.4百里醌抑制Akt/mTOR通路和上调Beclin1蛋白激活自噬,促进Bcl-2蛋白表达抑制凋亡 与对照组相比发现百里醌下调p-Akt和p-mTOR蛋白表达,上调Beclin1和Bcl-2蛋白表达。见图6、图7、表3。

图7 Western印迹检测Akt、p-Akt、mTOR、p-mTOR蛋白表达

表3 各组Akt、p-Akt、mTOR、p-mTOR、Beclin1、Bcl-2蛋白表达
3 讨 论
冠状动脉性疾病是当今社会导致死亡的主要疾病之一,凋亡在动脉粥样硬化性疾病发展过程中起到重要作用,研究发现动脉粥样硬化组织和细胞中凋亡分子指标明显升高〔7,8〕。自噬作为保护机制,通过降解垃圾蛋白和缺陷性细胞器对抗细胞凋亡,然而在心血管疾病中自噬和凋亡之间的相关性仍不清楚。本研究发现百里醌降低过氧化氢引起的HUVECs细胞凋亡。MTT结果显示百里醌预处理后加入过氧化氢能够提高细胞生存率。Western印迹检测凋亡蛋白Caspase-3、Cleaved Caspase-3表达和Annexin V-PI双染是观察细胞凋亡的常用方法,本研究发现800 μmol/L过氧化氢导致HUVECs细胞凋亡,而百里醌预处理后再加入过氧化氢处理细胞凋亡减少。此外,Annexin V-PI双染可以将凋亡细胞分为早期凋亡和晚期凋亡,早期细胞凋亡的发生主要由于线粒体膜电位的变化和丢失,而晚期凋亡通常与DNA损伤有关,本研究发现百里醌主要减少晚期凋亡细胞百分比,而对早期凋亡细胞影响较小,具体机制尚未可知。
为了研究自噬在百里醌保护作用中发挥的功能,本研究检测自噬标记物LC3-Ⅰ/LC3-Ⅱ蛋白表达。自噬发生过程中,LC3耦联到自噬体上并LC3-Ⅰ转换成LC3-Ⅱ,LC3-Ⅱ蛋白和LC3-Ⅰ蛋白比值变化已被用来作为自噬评价和测定的公认指标〔9〕。本研究发现百里醌处理后LC3-Ⅱ蛋白水平升高,表明百里醌激活HUVECs细胞自噬的发生。同时本研究应用GFP-LC3病毒检测百里醌对自噬的影响,无自噬时,GFP-LC3融合蛋白弥散在胞质中,自噬形成时,GFP-LC3融合蛋白转位至自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,通过计数来评价自噬活性的高低。本研究中使用百里醌处理GFP-LC3腺病毒感染的HUVECs细胞发现绿色荧光斑点数增加,提示细胞自噬水平升高。同时为了验证自噬是否参与百里醌降低过氧化氢引起的HUVECs细胞凋亡过程,采用3-MA阻断自噬发生后观察细胞增殖和凋亡情况改变,MTT结果显示阻断自噬后百里醌保护作用减弱,同时Western印迹结果显示阻断自噬后Cleaved Caspase-3蛋白水平升高,表明自噬在此保护作用中发挥了重要功能。
此外,百里醌激活自噬的分子机制也是本研究的重点,既往研究发现百里醌通过抑制p-mTOR激活自噬,mTOR是自噬通路的经典负性调节蛋白。在动脉粥样硬化发生过程中,常常伴随着mTOR信号通路激活导致的自噬下调〔10〕。因此假设百里醌在HUVECs细胞系中通过Akt/mTOR信号通路调节自噬。使用Western印迹实验检测百里醌处理后p-Akt和p-mTOR蛋白改变,结果显示百里醌可以抑制p-Akt和p-mTOR蛋白水平。关键性自噬调节蛋白Beclin1同凋亡途径存在着明显联系〔11〕,同时Beclin1-Bcl-2复合体是自噬和凋亡相互作用的关键调节因子,本研究中发现百里醌上调Beclin1和Bcl-2蛋白表达,表明百里醌可能通过上调Beclin1激活自噬并通过上调Bcl-2发挥抗凋亡功能。
百里醌作为植物提取物,在抗肿瘤方面发挥重要功能,本研究中首次提出百里醌通过激活自噬保护血管内皮细胞发挥抗凋亡功能,对于心血管疾病的治疗提供了新的思路,在未来心血管疾病治疗过程中可能发挥重要作用。
