miR-34a/Bcl-2在听神经皮层的表达及调控
2020-04-16叶咏怡黄秋红郑亿庆
叶咏怡 黄秋红 郑亿庆
(中山大学 1孙逸仙纪念医院耳鼻喉-头颈外科,广东 广州 510120;2听力及言语研究所)
年龄相关性听力损伤,又称老年性聋,在老年神经退行性疾病中占主导位置,约40%的65岁以上老年人群受到影响〔1〕。微小核糖核酸(miR)-34a作为一个重要的转录因子,近年来被发现在细胞增殖、分化、凋亡中扮演重要角色〔2〕。目前B淋巴细胞瘤(Bcl)-2是凋亡基因家族研究的主要靶分子,被视为一个重要的抗凋亡蛋白〔3〕。本研究旨在探讨miR-34a、Bcl-2在原代培养听皮层神经元中的凋亡机制。
1 材料与方法
1.1实验动物 细胞原代培养使用出生24 h内C57BL/6J乳鼠,成年动物组织使用4周龄与12月龄C57BL/6J小鼠,均由中山大学实验动物中心提供。
1.2培养板及培养皿的处理 15 mm×15 mm无菌爬片放入24孔板中,100 μg/ml多聚-D-赖氨酸加入培养皿及6孔、24孔培养板中,覆盖爬片及板的表面,放进5%CO2培养箱37℃包被过夜;实验前回收包被液,用Hank平衡盐溶液(HBSS)洗1次,待风干后种板用。
1.3听皮层神经元细胞的原代培养 细胞提取方法参照文献〔4〕,并对其改良优化。取出生24 h内的乳鼠,用75%酒精消毒后,无菌环境下断头法处死后,剪开头部皮肤,延大脑中部剪开脑膜,用无菌精密尖弯头镊子把脑膜外两边剥开,将整个大脑取出放进含血清培养基的培养皿中;用灭菌后精密尖头镊子在预冷含血清培养基中清除血管膜和微细血管;定位参照文献〔5〕,根据定位,用灭菌后精密尖头镊子取出听皮层位置的组织,放进含血清培养基的培养皿中,直至收集全部听皮层组织。吸出含血清培养基,用HBSS缓冲液洗1次,加入2 mg/ml的木瓜蛋白酶(含100 μl DNA Ⅰ酶),放入5%CO2培养箱中37℃消化20~30 min,每5 min取出摇晃一次;从培养箱取出后,把木瓜蛋白酶吸出,加入2~3 ml含100 μl DNAⅠ酶的血清培养基停止消化,把培养皿中的组织及培养基吸进15 ml离心管里,静置3~5 min;吸出上层培养基,加入2 ml无血清神经元培养基,静置2 min;吸出上层培养基,加入无血清神经元培养基至离心管的5~6 ml刻度处,缓慢轻轻吹打10次,让组织分散不粘连,静置2 min后,小心轻轻吸出上层1~2 ml细胞至另一个无菌离心管中,重复2~3次,提取出细胞悬液。用细胞计数板得出细胞数量,并进行种板。种板后4~12 h内全量换无血清神经元培养基,每3 d半量换液。
1.4不同培养时间点神经元形态学的观察 种板12 h内全量换无血清培养基后,在普通倒置显微镜观察刚贴壁的神经元细胞形态,之后每天观察神经元细胞的生长变化情况,连续观察10 d。
1.5神经元特异性核蛋白(NeuN)免疫荧光进行神经元鉴定 24孔板爬片种板后,待3~4 d,听皮层神经元细胞长出突触,固定30 min后,磷酸盐缓冲液(PBS)洗3次,加0.5% Triton-X100破膜15 min,PBS洗1次,10%山羊血清封闭30 min,耳蜗细胞株细胞条件空白对照组、内参组及过表达组神经元细胞加NeuN一抗(1∶100),阴性对照只加抗体稀释液,4℃静置孵育36 h后取出,PBS洗涤,避光分别加二抗羊抗兔免疫球蛋白(Ig)G(1:200)及二抗羊抗鼠(1:200)室温1 h,PBS洗涤,4′,6-二脒基-2-苯基吲哚(DAPI)避光复染5 min,PBS洗涤,在载玻片上滴适量抗荧光淬灭剂,把细胞贴在爬片的那一面盖在载玻片上,至正置荧光显微镜观察。
1.6NeuN在C57BL/6J小鼠大脑冰冻切片的免疫荧光 10%水合氯醛麻醉后,脱臼法处死,取不同年龄的大脑组织,立刻室温固定6~8 h,20%、30%梯度蔗糖溶液4℃脱水3~4 d后,聚乙二醇和聚乙烯醇的水溶性混合物(OTC)包埋,切片厚度8~10 μm,-80℃保存。切片加1% Triton-X100破膜15 min,PBS洗涤,10%山羊血清封闭30 min,大脑切片分别加NeuN一抗(1∶100),阴性对照只加抗体稀释液,4℃孵育过夜;从4℃取出,PBS洗涤,避光各加二抗羊抗兔IgG(1∶200)室温1 h,PBS洗涤,DAPI复染5 min,PBS洗涤,在载玻片上滴适量抗荧光淬灭剂,盖上载玻片,至正置荧光显微镜观察;在低倍镜先找到海马,顺着海马找到定位听神经位置;设视野中的细胞为总量n,NeuN标记数为x,神经标记细胞百分率=(n/x)×100%,比较两者神经细胞形态及数量的差异。
1.7Western印迹法检测蛋白表达 取4 w龄和12月龄的C57BL/6J小鼠的大脑组织,定位听皮层位置用高温高压消毒后的直眼科剪取出组织,放进蛋白质抑制酶(100:1)裂解提取蛋白。听皮层神经元细胞贴壁6孔板生长5~6 d后,每孔(5~10)×105细胞密度,加入20 μmol/L、40 μmol/L的miR-34a过表达试剂,进行瞬时转染72 h。转染完成后,加入蛋白质抑制酶(100:1)裂解提取细胞蛋白,4℃,14 000 r/min,离心30 min,提取上清液;用BCA法定量。取20 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转至聚偏氟乙烯(PVDF)膜。先用GAPDH(1∶10 000)和Bcl-2(1∶1 000)一抗,4℃过夜;后用辣根过氧化物酶标记山羊抗兔二抗进行免疫杂交;滴加超敏发射极耦合电化学发光液(ECL),用智能成像系统 (G:BOX XT4)曝光,得到蛋白条带使用Image J进行灰度计算并统计分析。
1.8统计学分析 采用SPSS25.0软件对服从正态分布且方差齐性的数据进行t检验,对不符合参数检验条件的数据进行秩和检验。
2 结 果
2.1神经元形态学观察 神经元细胞提取12 h基本全部贴壁,可观察幼稚的神经元细胞呈圆形,胞体周围光晕明显,突触开始生长;培养3~4 d后,胞体变大且更饱满,胞核明显,突起数量增多且增长,突起之间开始相互连接;培养6~8 d,神经元细胞基本趋于成熟,各神经元间有聚集倾向;培养10 d后,胞体周围光晕开始变暗,树突数量更多分布更广,逐渐形成复杂的网络结构。见图1。
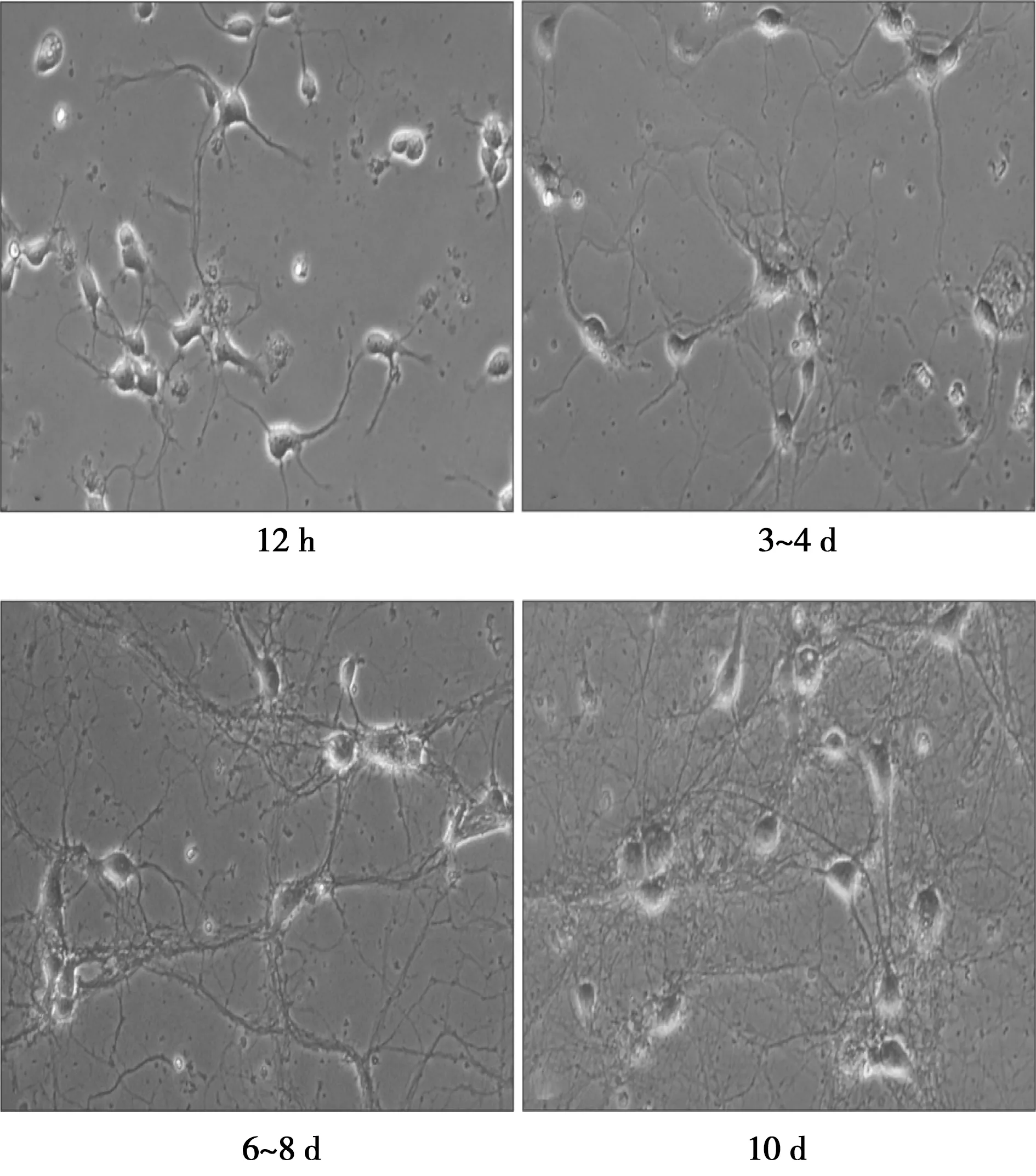
图1 倒置显微镜下观察不同培养时间的神经元细胞(×200)
2.2NeuN在不同年龄C57BL/6小鼠大脑切片的形态及数量 4周龄与12月龄鼠大脑切片听皮层神经位置DAPI细胞核复染在荧光显微镜下显蓝色荧光(见图2A与D);4周龄与12月龄鼠大脑NeuN神经元特异性核蛋白染色显红色荧光(见图2B与E);4周龄与12月龄鼠大脑细胞核、神经元核蛋白染色合并(见图2C与F)。4周龄小鼠听神经细胞百分率显著高于12月龄〔(72.2±2.2)% vs (44.5±1.9)%,P<0.001,n=3〕。
2.3不同年龄C57BL/6小鼠大脑听皮层组织Bcl-2蛋白 4周龄鼠Bcl-2蛋白表达(0.92±0.10)显著大于12月龄(0.62±0.04,P<0.05,n=3)。见图3。
2.4神经元细胞转染后Bcl-2表达结果 空白对照组及内参组Bcl-2表达量分别为:0.370 9±0.003 2、0.417 1±0.006 4。促表达试剂浓度在20 μmol/L时,与阴性对照(20 μmol/L)组比较,Bcl-2蛋白表达量显著减少(0.403 1±0.007 4 vs 0.511 2±0.001 4,P<0.05);进一步增加促表达试剂浓度至40 μmol/L时,Bcl-2蛋白表达量与阴性对照(40 μmol/L)组显著减少(0.328 1±0.001 9 vs 0.494 0±0.008 7,P<0.001);提示符合miR通过与靶基因mRNA互补结合从而抑制靶基因表达的作用方式。 见图4。
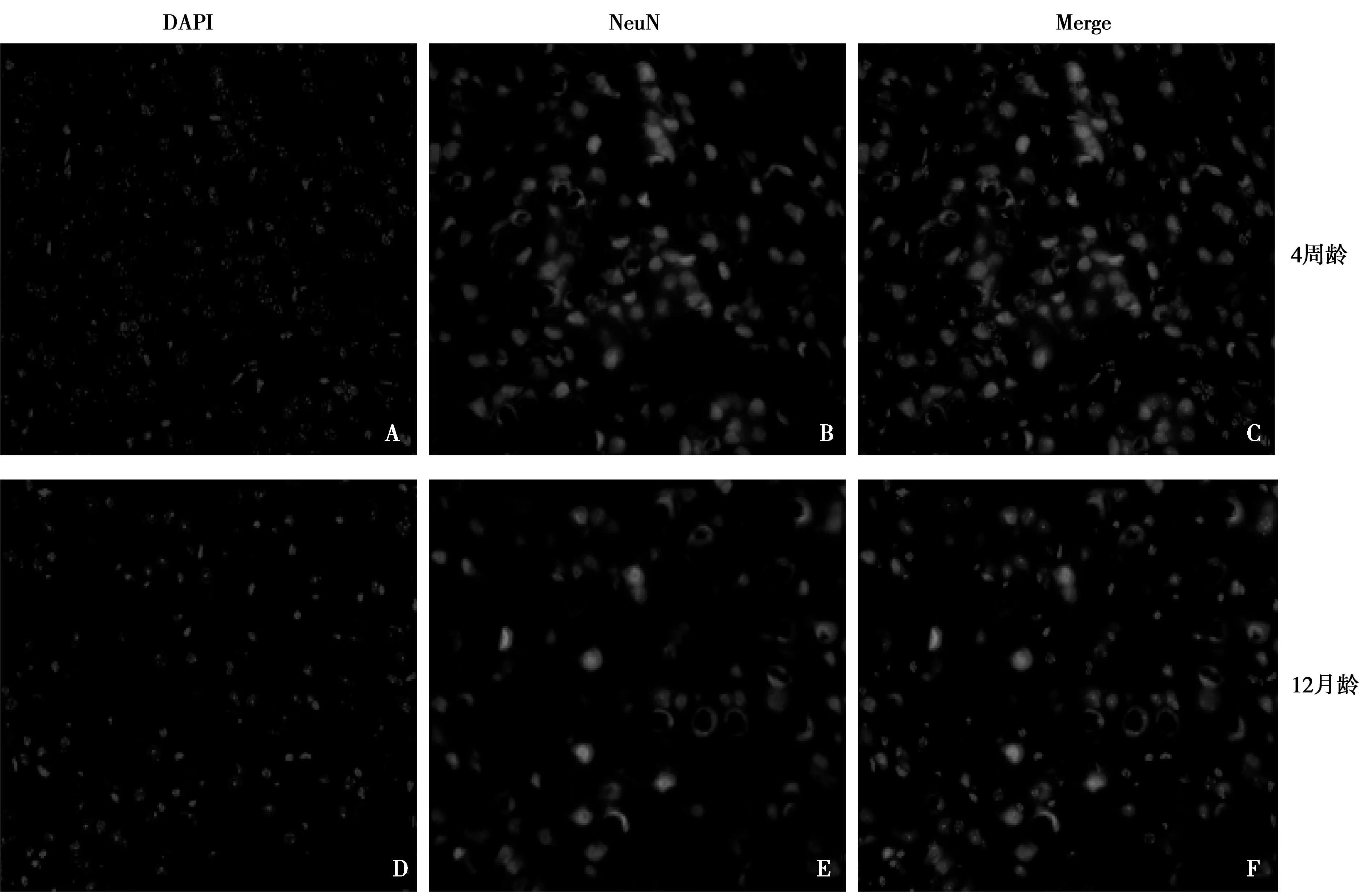
图2 NeuN神经元标记物的鉴定(×40)

图3 不同年龄小鼠听皮层中Bcl-2蛋白的相对表达

1~6:空白对照组、内参组、阴性对照(20 μmol/L)、过表达(20 μmol/L)、阴性对照(40 μmol/L)、过表达(40 μmol/L)
3 讨 论
听皮层是听觉系统的高级中枢,能对传入的听觉信号进行加工、编码、分析,把电信号转换成言语的处理器,对中枢性耳聋及言语识别率低下的相关疾病的研究具有重要意义,而听皮层神经元的获得,是深入进行分子生物学研究的重要前提。通过对听皮层的准确定位及听皮层神经元的原代培养,能弥补动物在体内实验无法实施的一些实验条件。
miR-34a是一种内源性非编码miR,被视为重要的转录因子〔6〕。随着研究者对miR的深入研究,发现在疾病发展的过程中,根据靶基因在其发挥的作用,miR的变化可作为抑制和促进因子,从而调控疾病的发生与发展〔7〕。研究发现miR-34a基因表达在衰老过程及其相关疾病中起到了一定作用〔8〕。研究表明,Bcl-2在哺乳动物的健康和疾病中担当重要角色〔9〕,是一种细胞内的膜相关蛋白,可抑制细胞凋亡〔3〕。因此,本文推测miR-34a、Bcl-2信号通路在不同年龄C57BL/6J小鼠的听皮层神经元上细胞凋亡和听力损失机制有着紧密的联系。
miR可通过与靶mRNA的3′UTR互补结合在转录后水平使其降解,或者与其不完全互补结合在翻译水平抑制蛋白质的合成〔10〕,研究表明miRNA的调节异常可导致Bcl-2家族蛋白的不平衡和线粒体功能障碍〔11〕,因此在基因表达中发挥着重要的作用。本研究显示,4周龄组比12月龄组的神经元细胞个数多,Bcl-2蛋白在4周龄组C57BL/6J小鼠听皮层神经元组织中的表达较12月龄组多。在听皮层神经元细胞中,转染miR-34a促表达试剂后,能增加下游Bcl-2蛋白翻译水平的表达。
综上,Bcl-2在不同年龄C57BL/6J小鼠听皮层神经元中存在差异表达,通过靶向调控神经元细胞miR-34a从而影响Bcl-2表达可能成为年龄相关性聋中枢发病的机制之一。
