高尿酸对血管内皮细胞eNOS基因表达的调节作用及其对血管新生的影响
2020-04-16罗雪兰滕红丽覃裕旺张文宇唐华民吕冬宁杨鹏杨国勋欧和生
罗雪兰 滕红丽 覃裕旺 张文宇 唐华民 吕冬宁 杨鹏 杨国勋 欧和生
(1广西国际壮医医院科技部,广西 南宁 530201;2中铁十二局集团有限公司中心医院药械科)
高尿酸血症是代谢综合征的一种表现。高浓度尿酸可导致高尿酸血症,并引起痛风性急性关节炎、痛风结石及关节畸形等,常累及肾脏,此外,还被认为是内皮损伤的重要原因。研究发现,高尿酸血症不仅会导致痛风的发生和肾结石的沉积,更是独立于高血压、糖尿病、肥胖等危险因素以外的诱发心血管疾病的重要独立危险因素〔1~3〕。
血管新生主要有两个重要反应,一是新生血管形成,二是血管生成,二者均为内皮细胞最重要的特征,为器官的正常生理功能提供了基础。血管生成受损是心血管疾病的一个重要原因。目前,临床上将男性血尿酸>420 μmol/L,女性>360 μmol/L确定为高尿酸血症。有研究显示〔4,5〕,女性的血尿酸水平每增加1 μmol/L,其高血压的患病风险将增加0.40%;同时,血尿酸水平四分位数最高的女性,其高血压的患病风险是血尿酸水平四分位数最低者的2.015 倍;而罹患高尿酸血症的女性,其高血压的患病风险是未患病者的1.563倍。另有研究表明,罹患高尿酸血症患者心血管疾病的死亡风险会增加〔6〕。然而目前高尿酸血症对心血管系统损伤的机制研究仍处于初步阶段,高浓度尿酸是否影响血管生成及这种影响的潜在机制尚不清楚。本研究旨在探讨高尿酸对血管内皮细胞内皮型一氧化氮合酶(eNOS)基因的表达调节及其血管新生的影响。
1 材料与方法
1.1材料 人脐静脉血管内皮细胞(HUVECs)购自武汉Procell公司;定量PCR试剂盒由大连TaKaRa公司提供;四甲基偶氮唑盐(MTT)试剂购自北京Solarbio科技有限公司;Ⅰ抗eNOS兔源多克隆抗体购自美国Santa Cruz公司;GAPDH兔抗购自PeproTech公司;尿酸钠盐(CAS:1198-77-2)购自Sigma公司;Trizol试剂(15596-026)购自美国Invitrogen公司;澳洲胎牛血清(FBS,10099-141)、胰蛋白酶消化液、1640 细胞培养基和人工基底膜(基质胶)均购自美国Gibco公司;一氧化氮(NO)测试盒(货号A012)由南京建成生物工程研究所供给。
1.2细胞培养与高尿酸溶液的配置 HUVECs用含10% FBS、青霉素(1×105U/L)/链霉素(100 mg/L)的Gibco RPMI1640细胞培养基进行培养,并置于37℃、5% CO2恒温培养箱中。将尿酸粉末溶于1 mol/L NaOH溶液中,并配置成40 mmol/L尿酸钠溶液,然后加入无菌磷酸盐缓冲液(PBS)稀释至600 μmol/L,调节pH为7.2~7.4。将上述尿酸钠溶液加入HUVECs细胞培养基培养,进行后续实验。根据实验所需,细胞分为对照组和高尿酸组。
1.3RT-PCR检测各组细胞eNOS mRNA 的表达 HUVECs在600 μmol/L浓度分别培养24、48 h,按Invitrogen的TRIzol 提取试剂盒步骤提取各组细胞总RNA。应用Primer5.0 软件,根据eNOS基因序列,合成人eNOS引物序列,其中上游引物序列为5′-AGGAACCTGTGTGACCCTCA-3′,下游引物序列为5′-CGAGGTGGTCCGGGTATCC-3′,GAPDH上游引物序列为5′-AACTTTGGCATTGTGG-AAGG-3′,下游引物序列为5′-ACACATTGGGGGTAGGAACA-3′,GAPDH作为内参。分别取各实验组细胞RNA 1 μg根据逆转录试剂盒步骤逐步加入各反应物,最终逆转录为cDNA。PCR 扩增反应条件为:94℃预处理5 min,30个循环: 94℃ 30 s、56℃退火 1 min、72 ℃延长1 min。最后取5 μl PCR产物在1.5%琼脂糖凝胶上进行电泳,用凝胶成像系统扫描分析。
1.4Western印迹检测各组细胞eNOS蛋白表达 HUVECs在600 μmol/L高尿酸条件下分别培养24、48 h,待细胞完全融合后,用细胞裂解液裂解,于低温高速离心机4℃,经12 000 r/min离心15 min,随后收集上清液,二喹啉甲酸(BCA)测定蛋白含量,取平均值。分别取各组细胞蛋白60 μg在8%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳分离,然后转至聚偏氟乙烯(PVDF)膜上。5%脱脂牛奶室温封闭1 h 后加入 Ⅰ 抗eNOS抗体并在4℃孵育过夜。TBST缓冲液洗膜10 min/次,共3次。加入羊抗兔Ⅱ抗(辣根过氧化物酶标记),37℃ 孵育1 h,TBST 缓冲液冲洗,仍为10 min/次,共3 次。使用美国 LI-COR 公司的 Odyssey 红外荧光扫描成像系统分析。
1.5硝酸还原法检测各组HUVECs的NO含量 分别收集高尿酸条件培养24、48 h的各组细胞及其培养上清液,应用细胞震碎仪破裂细胞,于4℃条件下,经12 000 r/min离心15 min,随后收集上清液。根据硝酸还原检测法说明书的步骤逐步稀释标准品,取标准品与各组样品各100 μl,接着按说明书要求逐步加入各种试剂。最后将上述液体以150 μl/孔注入 96孔板,应用酶联免疫吸附试验测定仪测定550 nm处各组液体的OD值。根据说明书公式计算NO含量。实验重复3遍。
1.6高尿酸对HUVECs成管能力的影响 取出经4℃冰箱过夜解冻的基质胶,在冰上将20 μl/孔平铺于96孔板中,接着将96孔板置于恒温培养箱中,37℃培养1 h。各组细胞消化后用无血清培养基重悬,同时高尿酸组用600 μmol/L尿酸钠溶液处理,并以每孔1×104个分别接种于铺好的基质胶上,放回培养箱继续培养,分别在24、48 h后镜下观察小管的形成情况(随机取5个视野)。
1.7高尿酸对鸡胚绒毛尿囊膜(CAM)血管新生的影响 选取已孵育7 d的鸡胚,用小钻在鸡胚胚头上方钻开一1.0~2.0 mm的小孔并穿透气室壳膜,用75%酒精棉球擦拭消毒小孔周围。用注射针头在卵壳膜上轻轻划出一小孔,小心暴露CAM,无菌胶带封闭窗口后,置于孵化箱孵化。隔日取出鸡胚,剪取0.5 cm × 0.5 cm的无菌明胶海绵载体置于CAM上血管较少的区域,使用移液枪分别滴加50 μl对照组和高尿酸组细胞培养液,无菌胶带封闭鸡胚窗口后,放回鸡胚孵化箱中继续孵化。72 h后取出鸡胚,用甲醇丙酮1∶1混合液室温固定CAM 15 min。待CAM上的血管内血液凝固,剪下CAM,翻转贴于滤纸上并拍照。使用Image J软件处理图像,计算所选区域血管面积/CAM面积的百分比率。
1.8MTT法检测HUVECs增殖 分别取各组对数生长期的细胞接种到96 孔板中,每孔1×104个细胞,其中高尿酸组加入600 μmol/L尿酸钠溶液,置于37℃、5% CO2饱和湿度恒温箱中。待细胞融合率达50%,更换为无血清RPMI1640培养基和含600 μmol/L尿酸钠溶液的无血清1640培养基继续培养。分别在24、48、72 h加入MTT 继续培养4 h,测定570 nm波长下每孔OD值,实验重复3遍。
1.9细胞划痕试验检测HUVECs的迁移能力 分别取各组对数生长期的细胞,以每孔 1×104个接种到 96 孔板,高尿酸组加入600 μmol/L尿酸钠溶液,置于37℃、5% CO2培养箱中培养。待各孔细胞培养至基本融合,用10 μl枪头在每个孔的底部划“一”,并用无菌PBS冲洗,尽量洗去划落的细胞及碎片,然后分别加入无血清RPMI1640培养基和含600 μmol/L尿酸钠溶液的无血清RPMI1640培养基。继续培养0、12、24 h,并在倒置显微镜下观察细胞的迁移愈合情况。实验重复3 次。
1.10统计学方法 运用SPSS20.0软件行t检验。
2 结 果
2.1高尿酸对细胞eNOS mRNA和蛋白表达的影响 RT-PCR检测结果显示,与对照组(1.01±0.02)相比,高尿酸培养24、48 h后,eNOS mRNA 转录水平(0.77±0.05、0.52±0.03)分别降低23.76%、48.51%,差异有统计学意义(P<0.05,P<0.01)。Western印迹结果发现,与对照组(1.00±0.02)比较,培养24 h、48 h后,高尿酸组eNOS蛋白表达量(0.81±0.05、0.45±0.02)分别减少19.00%、55.00%,差异有统计学意义(P<0.05,P<0.01),见图1。
2.2高尿酸对HUVECs代谢产物NO含量的影响 高尿酸培养细胞24、48 h后,NO浓度〔(30.77±3.99)、(39.56±4.07)μmol/L〕较对照组〔(45.92±4.21)、(72.05±6.24)μmol/L〕降低了 32.99%、45.09%,差异有统计学意义(P<0.01)。

图1 高尿酸对HUVECs eNOS蛋白表达的影响
2.3高尿酸对HUVECs成管能力的影响 与对照组相比,高尿酸组HUVECs在高尿酸条件下培养24 h,尚能形成管腔样网络结构,继续培养至48 h,细胞则有聚集倾向,但没有形成完整的管腔样网络结构。说明高尿酸抑制HUVECs的管腔形成,见图2。
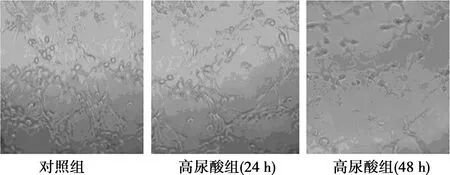
图2 高尿酸对HUVECs管腔形成能力的影响(×200)
2.4高尿酸对CAM血管新生的影响 对照组CAM的大血管和微血管分支呈叶脉状均匀分布,可见放射状密集生长的血管网。与对照组相比,高尿酸组大血管直径明显变窄,二级血管与微血管数量明显减少且稀疏,见图3。与对照组〔(55.72±3.16)%〕相比,高尿酸组血管新生面积比率〔(27.98±1.95)%〕降低49.78%,差异有统计学意义(P<0.01)。
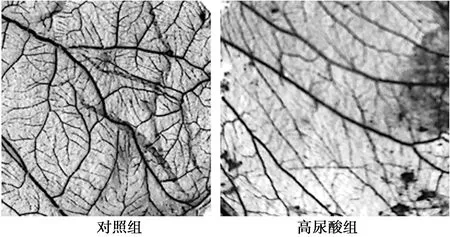
图3 高尿酸对CAM血管新生的影响(×50)
2.5高尿酸对HUVECs增殖和迁移的影响 与对照组比较,高尿酸浓度环境下,HUVECs的增殖明显受抑制(P<0.05),见表1。

表1 两组相对增殖抑制率比较
与对照组比较:1)P<0.05,2)P<0.01
划“一”操作24、48 h后,与对照组〔(56.29±3.16)%、(88.57±7.23)%〕相比,高尿酸组细胞愈合率〔(38.96±4.77)%、(54.29±4.08)%〕下降30.79%、38.70%,差异有统计学意义(均P<0.01),提示高尿酸条件下,HUVECs的迁移受到一定抑制,见图4。

图4 高尿酸对HUVECs迁移的影响(×100)
3 讨 论
本研究结果发现,高尿酸显著抑制eNOS基因mRNA转录和蛋白表达,显著抑制HUVECs的成管能力、CAM的血管生成及HUVECs的增殖与迁移。高尿酸对HUVECs血管新生的抑制作用可能与其对eNOS基因的表达相关。
目前,血尿酸的程度与代谢综合征、糖尿病、原发性高血压、冠心病及慢性肾脏病(CKD)等多种疾病的预后呈负性相关关系〔7~9〕。据报道,高尿酸血症引起的病理生理变化并不完全取决于尿酸晶体的沉积,实际上,它对引起的细胞损伤起关键作用〔10〕。以往研究表明,在600 μmol/L尿酸存在下培养的HUVECs与正常条件下培养的反应有所不同,但这种浓度的尿酸不会影响正常HUVECs的生存能力〔11,12〕。在高尿酸条件下,许多细胞基因的表达发生改变,如Toll样受体(TLR)4和核因子(NF)-κB〔11〕及eNOS〔12〕,这些基因的改变很可能参与高尿酸血症及痛风的病理生理过程。
eNOS作为NO生成的关键酶,具有组织特异性,且广泛存在于心血管系统中,其表达异常是心血管疾病的重要危险因素〔13〕。研究发现〔14〕,野百合碱(Monocrotaline)可诱导肺血管内皮功能障碍与PA重构,引起肺动脉高压,而eNOS 基因的表达减少及活性下降在其中起了关键性作用。eNOS基因敲除小鼠表现为全身性高血压,而单次注射裸露eNOS质粒DNA后SHR大鼠血压降低〔15,16〕。另外,研究表明〔17〕,内皮源性NO生物利用度降低,体内 NO 水平下降,同时下降的严重程度与血压的严重程度呈正相关关系。已有研究表明,在高浓度尿酸的刺激下,内皮细胞的eNOS表达下降,NO释放会减少〔18〕。本研究结果均显示,高尿酸培养24 h和48 h后,eNOS的mRNA转录水平和蛋白表达均下降;NO的产生和释放也减少。另外,近年来研究发现,eNOS参与细胞的血管生成,如对干细胞的血管生成有促进作用〔19〕。
血管形成是血管新生的重要反应,涉及多种血管内细胞和血管内调节因子的共同调控。由于血管形成反应与组织缺血区的毛细血管增殖密切相关,并可改善局部组织缺氧,成为了心血管疾病的研究热点。缺血性心血管疾病仍是世界上发病率和死亡率的主要原因之一,促血管生成治疗是治疗缺血性心血管疾病一种可行的方法。研究发现,EfoinB2/ EphB4通路在血管生成中的作用机制,可能有助于开发新的缺血性心血管疾病治疗方法〔20〕。JAZF1过表达可激活心肌缺血再灌注大鼠的Akt信号通路,从而促进心肌微血管内皮细胞的增殖和血管生成〔21〕。然而,血管生成受体内外多种因素的影响,如氧化应激、高糖及高尿酸等〔22~24〕。高尿酸刺激下,miR-92a的表达下调, Krüppel样转录因子(KLF)2表达增加,随后抑制血管内皮生长因子(VEGF)A的表达,从而抑制HUVECs的管腔形成。前期研究显示,eNOS基因的表达下调,血管内皮细胞增殖、迁移能力和成管能力受到抑制〔25,26〕,因此,高尿酸刺激有可能通过减少eNOS的表达,从而抑制细胞的成管及CAM的新生血管,然而所述过程的相关机制是否仍有其他影响因素尚未得知,仍需进一步研究。
综上所述,在高尿酸(600 μmol/L)条件的刺激下,血管内皮细胞的eNOS基因表达下降,NO的生成与释放减少,对eNOS基因的表达调控,可能为今后高尿酸血症的防治提供实验依据,eNOS可能是高尿酸血症治疗的靶基因之一。
