玉米tasselseed突变体ts12的遗传分析与分子鉴定
2020-04-16秦利萍董二飞任岚扬张任凤刘朝显蔡一林
秦利萍 董二飞 白 洋 周 练 任岚扬 张任凤 刘朝显蔡一林
玉米tasselseed突变体的遗传分析与分子鉴定
秦利萍**董二飞**白 洋 周 练 任岚扬 张任凤 刘朝显*蔡一林*
西南大学玉米研究所 / 南方山地农业教育部工程研究中心, 重庆 400715
性别决定与玉米雄穗和雌穗发育密切相关, 性别决定基因功能研究对性别决定分子机制的解析具有重要意义。利用甲基磺酸乙酯(EMS)处理B73花粉, 获得了一个玉米雄穗结实突变体()。用扫描电镜对突变体雄穗的形态学观察, 发现未成熟雄穗长13 mm时, 小穗呈现出明显的雌性化特征。利用图位克隆的方法, 把定位于分子标记LM4和RM5之间, 物理距离约为290 kb, 该区间共有9个注释基因, 其中包括已报道的性别决定基因()。通过克隆突变体中基因编码序列, 发现基因编码区第196个碱基鸟嘌呤被替换为腺嘌呤, 导致该位点编码的甘氨酸被替换为精氨酸, 由此推测该保守位点突变可能是tasselseed表型产生的原因。和等位性测验结果表明所有F1、F2代植株雄穗均可产生花丝, 推测是基因一个新的等位突变体。以加外源茉莉酸(JA, 1 mmol L–1)处理突变体, 发现处理后的小穗大部分可恢复正常。基因表达分析揭示在正常植株未成熟雄穗中的表达量最高, 其次是未成熟雌穗及叶片中; 在未成熟雄穗和雌穗中, 该基因的表达量极显著降低。保守位点的突变及其引起的表达量的降低可能是tasselseed表型产生的原因。
;; 雄穗结实; 精细定位; 等位测验
玉米(L.)是典型的雌雄同株、雌雄异花植物, 是研究性别决定的重要模式植物之一[1]。玉米花序发育过程中产生了4种类型的侧生分生组织, 在发育中按产生先后顺序分为侧支分生组织、小穗成对分生组织、小穗分生组织和小花分生组织[2]。玉米小花分生组织继续分化形成包括3个雄蕊和3个心皮的两性花, 随后雄穗中的雌蕊原基和雌穗中的雄蕊原基分别发生选择败育, 最终形成了单性花, 这一性别决定过程是一个复杂的生物学过程, 受到植物激素、遗传因子和环境因素的共同调控[3]。
大量研究表明植物激素茉莉酸(jasmonic acid, JA)、赤霉素(GA)和油菜素内酯(BR)等参与了玉米性别决定过程。前人研究表明、、、和与JA信号通路有关, 该通路调控了玉米雄蕊和雌蕊的发育。编码一个脂氧合酶[4], 是JA合成途径中的一个关键酶; 其功能的缺失导致脂氧合酶活性消失, 玉米内源JA浓度下降, 最终导致雄穗性别反转, 小穗雌性化, 产生大量花丝。基因编码一个短链乙醇脱氢酶[5], 该酶可能会产生一个促进凋亡的信号或者降解细胞存活所需要的底物[6-7];基因功能的丧失同样会导致玉米雄穗产生与突变体类似的tasselseed表型。不同于和基因功能丧失后表现为隐性突变,为显性突变体, 除了雄穗小穗性别发生反转, 产生雌性化的小穗外, 雌穗下位花不能败育, 导致果穗籽粒排列紊乱;编码一个创伤诱导表达的蛋白酶ZmCYP94B1, 该酶可使有生物活性的JA和异亮氨酸偶联物JA-Ile失活, 影响了JA的代谢, 致使植株内源JA含量降低, 最终影响性别决定[8]。对、和突变体施加外源JA, 均可恢复小穗雄蕊发育, 产生有功能的花粉[4,8], 该结果进一步证实了这3个基因与JA代谢和信号转导过程密切相关。在玉米雄穗发育过程中,和基因调控了雄穗和雌穗下位花雌蕊的败育, 与此相反,基因促进雌蕊的发育[9]。基因突变后, 导致雌穗不能正常产生花丝;基因过表达导致T0代转基因植株雄穗完全雌性化, 雌穗上位花和下位花雌蕊均可发育。基因编码一个UDP-糖基转移酶, 该酶可能使过氧化物酶体中的JA或者JA前体失活, 从而破坏了JA信号通路, 使和调控的雌蕊败育过程受阻[10];发挥功能的区域因受到基因的限制, 而仅限于雌穗上位花, 从而保证了雄穗中的雌蕊和雌穗下位花雌蕊的败育[11]。与拟南芥直系同源的玉米基因和, 在单个基因功能丧失情况下, JA合成没有受到明显影响, 雄穗和雌穗均能正常发育; 然而在双突变体中, JA的含量显著下降, 雄穗明显表现出类似和的雌性化特征, 施加外源JA则可使雄穗发育恢复正常[12-13]。
除了JA, 赤霉素在玉米性别决定中也扮演了重要角色。矮秆突变体、、、和均表现为雄蕊不能正常败育[14], 这是因为赤霉素正常合成途径受到抑制造成的[15-16], 施加外源赤霉素则可恢复正常表型[17]。同时用外源赤霉素对性别分化前正常植株持续处理, 会导致部分雄穗小穗雄蕊完全转变成雌蕊[18], 这充分说明了赤霉素在玉米雌蕊发育中发挥重要作用。亦有研究表明油菜素内酯等激素参与了玉米性别决定过程。通过对经典矮秆突变体的鉴定, 发现植株在BR生物合成途径中携带一个功能缺失突变的同源基因[19], 导致DET2特异性底物累积, 下游BR代谢物减少。用BR生物合成抑制剂处理野生型玉米植株完全模拟了突变体的矮化和tasselseed表型, 揭示了BR对玉米性别的控制作用。此外,和分子机制的阐释, 揭示了其在转录调控水平上, 而不是在激素的生物合成上发挥的重要作用。编码一个花同源异型基因-like转录因子, 在小穗分生组织的确定性方面具重要功能;编码一个microRNA zma-MIR172e, 其调控了基因的表达[20]。
我们利用EMS诱变B73花粉, 获得了一个tasselseed突变体。本研究对的表型进行了鉴定, 利用F2作图群体开展了目标基因的分子定位, 并与突变体进行了等位性测验。该研究为进一步深入解析玉米性别决定分子机制提供了有价值的参考。
1 材料与方法
1.1 实验材料
突变体(-N2409)来自Maize Genetics Cooperation Stock Center (http://maizecoop.cropsci.uiuc. edu/)。2016年3月于重庆市北碚区西南大学歇马实验基地种植自交系B73和Mo17。参照Neuffer等[21]的方法, 用EMS和液体石蜡配制体积比6.7×10–4∶1的工作液对B73花粉进行诱变处理, 将诱变后的花粉用毛笔涂抹于Mo17花丝; 同年9月于云南玉溪播种获得的M0代籽粒并自交。2017年6月在诱变群体中鉴定出3个雄穗结实突变体, 依次命名为和; 同时用与Mo17建构F2分离群体, 用于的分子定位。2018年6月, 在植株雌性化雄穗未抽出前套袋, 待雌性化雄穗抽出后, 把花粉授予植株雌性化雄穗, 得到F1代杂交籽粒; 同年9月把杂交后代种植于云南玉溪, 观察F1代植株雄穗发育形态, 且对能产生花粉的植株进行自交。
1.2 Simple sequence repeat (SSR) 标记开发及连锁标记筛选
从Gramene (http://www.gramene.org/)数据库下载玉米基因组序列, 用SSR Hunter[22]搜索构成重复元件核苷酸数最多是4个, 重复次数最少为4次的SSR序列; 然后在NCBI网站 (https://blast.ncbi. nlm.nih.gov/Blast.cgi)进行Blast比对, 以单拷贝SSR序列为模板用Primer-BLAST (https://www.ncbi.nlm. nih.gov/tools/primer-blast/index.cgi)设计引物。正向引物位于模板1~150 bp之间, 反向引物位于170~308 bp之间, 扩增片段最低120 bp, 正、反向引物长22 bp, 最短20 bp, 最长不超过25 bp, GC含量在40%~60%之间, 正、反向引物退火温度差异不超过1℃, 其他参数为默认设置。然后利用开发的SSR标记对B73和Mo17基因组DNA进行扩增, PCR产物经6%聚丙烯酰胺电泳及银染后判断其是否具有多态性[23]。
在F2分离群体中, 根据表型分别取10株正常植株和突变植株叶片提取DNA, 等量混合构建野生型DNA池和突变体DNA池; 用在B73和Mo17之间具有多态性的432对SSR标记[24]对2个DNA池扩增, 鉴定出与连锁的分子标记。用筛选出的及新开发的SSR标记(附表1)对所有突变体个体的基因型进行分析, 鉴定出发生染色体片段交换的突变植株, 对基因精细定位。
1.3 ts12形态学观察
将F2分离群体播于大田, 20 d后取幼苗叶片, 提取DNA, 进行个体基因型鉴定。筛选出带型与突变体、杂合带型植株及与Mo17一致的纯合带型植株(野生型)。待玉米生长至V7时期, 剥离不同发育阶段和野生型植株新鲜未成熟雄穗, 直接在扫描电镜(Hitachi SU3500, Tokyo, Japan)下观察其形态结构变化。
1.4 外源JA处理
将JA溶于无水乙醇, 配成1 mmol L–1的工作液, 保存于4℃; 以0.05%乙醇为对照。待F2群体中植株及野生型植株生长至35 d, 每天下午5:00左右用移液器吸取1 mL 1 mmol L–1JA溶液和0.05%乙醇注入玉米心叶, 持续处理14 d。统计JA、乙醇处理及无任何处理的雄穗结实数。
1.5 精细定位区间基因注释
在Gramene网站下载精细定位区间内基因及其编码蛋白序列, 然后以蛋白序列为种子序列Blast比对NCBI蛋白质无冗余数据库(Non-redundant protein sequences), 搜索目标蛋白在其他物种中的注释及功能, 从而对玉米中的同源基因进行功能注释。
1.6 ts12突变体中ts2基因的克隆和序列分析
根据基因(Zm00001d028806)序列, 利用Primer-BLAST设计扩增引物(附表1)扩增B73和雄穗cDNA。PCR扩增体系含模板cDNA 1 μL、2 × KOD buffer 10 μL、KOD FX NEO (1.0 U μL–1) 0.5 μL、引物 (10 μmol L–1) 1.5 μL、dNTPs (10 mmol L–1) 0.2 μL, 添加ddH2O至20 μL。PCR扩增条件为94℃预变性5 min, 94℃变性10 s, 62℃退火30 s, 68℃延伸1 min, 扩增35个循环, 最后68℃延伸5 min。用1%琼脂糖凝胶电泳检测, 胶回收PCR产物后连接到PEASY-Blunt载体上, 连接产物转化大肠杆菌感受态细胞, 经过PCR鉴定后, 选取含有目的条带的5个菌株样本送上海英骏生物技术有限公司测序。使用DNAMAN (https://www.lynnon.com/)比对分析测序结果。
1.7 RNA提取及基因表达量分析
对F2分离群体植株基因型鉴定后, 取V7时期及野生型植株的根、茎、叶、雄穗(1~2 cm), V9时期的雌穗(1~2 cm), 及未抽出苞叶的花丝和授粉后20 d的胚、胚乳, 速冻于液氮, 于–80℃保存。在150℃烘箱中对研钵处理4 h后, 将各组织研磨。用RNA提取试剂盒(RNAprep Pure Plant Kit)和RNA反转录试剂盒(RevertAid RT Reverse Transcription Kit)提取RNA及合成cDNA第1链。以cDNA为模板, 用定量引物-qPCR (附表1), 以为内参, 在实时定量PCR仪(Analytik Jena qTOWER, Jena, Germany)上定量分析。PCR扩增体系含cDNA 1 μL、引物0.75 μL、SYBR 6.25 μL, 补超纯水至13 μL。PCR扩增条件为95℃预变性3 min; 95℃变性15 s, 62℃退火15 s, 循环数为40。使用公式2–DDCT计算基因相对表达量。
2 结果与分析
2.1 ts12突变体表型观察及遗传方式分析
突变体营养生长阶段发育正常, 与野生型植株没有明显差异; 然而抽雄后成熟雄穗产生大量花丝(图1-B), 授粉后能正常结实; 同时发现雄穗主穗及侧枝顶端部分小穗仍能正常发育、散粉(图1-C), 自交后可获得纯合突变体。在扫描电镜下观察V7阶段未成熟雄穗可见, 野生型未成熟雄穗长约12 mm时, 小穗分生组织分化产生雄蕊和雌蕊(图1-D), 但未见雌蕊产生心皮组织; 相反, 在未成熟雄穗长约13 mm时, 则明显可见雌蕊产生胚珠原基和心皮结构(图1-E)。表明突变体雄穗长约13 mm时小穗发育异常, 表现出了雌性化的特征。
用纯合突变体与Mo17杂交产生的F1代雄穗发育为正常植株, 然后自交构建了F2分离群体。在F2代群体150个植株中, 突变植株35株, 正常植株115株(表1)。经过卡平方检验, 野生型和突变体符合3∶1的分离比例(χ2= 0.22 <χ20.05= 3.84), 说明突变体是由隐性单基因控制。
2.2 ts12精细定位
用在B73和Mo17之间有多态性且能覆盖整个玉米基因组的432对SSR标记, 对构建的突变体DNA池和野生型植株DNA池进行连锁标记的筛选。结果显示第1染色体1.04 bin的SSR标记umc1169的扩增产物在两个DNA混合池之间具有多态性(图2-A); 用该标记对15个植株基因型鉴定发现, 除了交换单株基因型为杂合外(图2-B), 其他植株基因型均与表型一致, 推测umc1169与呈连锁关系。在umc1169附近开发了6个SSR标记(附表1), 并分别对F2群体中501株突变体的基因型进行鉴定。在umc1169位点鉴定交换单株86个, 且在这86株中分别鉴定出24、12、6个植株分别在RM1、RM2和RM3位点发生了交换; 在LM1位点鉴定交换单株28个, 且在28个重组植株中, 有10株在LM2位点发生了交换, 从而把目标基因初步定位于SSR标记LM2和RM3之间, 物理距离约为1.6 Mb的区间内(图3-A)。然后继续开发SSR和InDel标记, 并分别在LM3、LM4位点鉴定4个和2个交换单株, 在RM4和RM5位点分别鉴定交换单株2个和1个, 最终把目标基因定位于InDel标记LM4和RM5之间约290 kb的物理区间内(图3-B)。

图1 ts12表型观察
A和B: 野生型和成熟雄穗; C:雄穗上能正常发育产生花粉的小穗; D和E: 未成熟野生型雄穗(12 mm)和雄穗(13 mm)扫描电镜观察。WT: 野生型; G: 雌蕊; ST: 雄蕊; C: 心皮。
A and B: mature tassel of the wild type and; C: the normal spikelets that could produce pollens ontassels. D and E: immature tassel of the wild type (12 mm) and(13 mm) under scanning electron microscope. WT: wild type; G: gynoecium; ST: stamen; C: carpel.

表1 ts12显隐性的分离比检验
#3:1分离比适合性检验。#Chi-square test for 3:1 segregation ratio.

图2 ts12连锁标记umc1169的筛选及验证
MT:DNA混合池; WT: 野生型DNA混合池。
MT: DNA pool of; WT: DNA pool of wild-type plants.
2.3 ts12候选基因及突变位点分析
定位区间290 kb内共含有9个注释基因(表2), 其中包括已经克隆的玉米性别决定基因(Zm00001d028806), 推测突变表型可能是基因突变造成的。提取纯合突变体雄穗总RNA, 反转录合成cDNA。设计-JD引物(附表1)扩增基因序列, 扩增片段序列与B73CDS比对发现第196个碱基鸟嘌呤G被替换为腺嘌呤A (图4), 导致该位点编码氨基酸甘氨酸被替换为精氨酸; 该突变位点位于Ts2蛋白乙醇脱氢酶保守结构域A中。截取突变位点附近DNA序列与B104、EP1、F7、Mo17、PH207和W22 自交系中基因相应位置序列比对发现, 该位点在其他自交系中非常保守, 没有SNP变异(图5)。由此推测基因中单核苷酸的转换可能是导致tasselseed表型的原因。
2.4 ts12和ts2突变体等位性测验
突变体雌性化雄穗主穗及侧枝顶部个别小穗可正常发育产生有功能的花粉, 而突变体雄穗小穗完全雌性化, 不能产生有功能的花粉(图6-A), 因此取植株花粉对雌性化雄穗花丝授粉, 3 d后重复授粉一次。将获得的F1代植株播于大田, 待抽雄后观察雄穗表型。通过对56个F1植株表型的观察, 发现F1植株雄穗均发生雌性化(图6-B), 可产一样能正常发育产生少量有功能的花粉, 可产生自交后代F2; 进一步观察113株F2雄穗表型, 发现所有植株均产生与F1植株一样的雌性化雄穗。由此推断是的等位突变体, 即突变表型是由编码乙醇脱氢酶基因的突变引起的。

图3 ts12精细定位
黑色实线上方相邻标记之间的数字代表物理距离, 括号内数字代表标记在染色体上的确切位置, 标记下方的红色数字代表交换单株数目。
The numbers above the solid back line between SSR markers represent physical distance. The numbers in parenthesis represent the exact position of the marker on chromosome. The red numbers under SSR markers represent recombination events.

表2 ts12定位区间内基因功能注释

图4 B73和ts12中Ts2基因CDS序列比对
红色下画线部分代表保守结构域A, 绿色方框代表中氨基酸发生替换的位点。
The parts underlined in red color represent the conserved domain A of. The green rectangle indicates the mutation site of the amino acid substitution in.

图5 ts12突变体和6个自交系中的Ts2基因突变位点序列比对
蓝色方框代表基因的单核苷酸突变位点。
The blue rectangle indicates the single nucleotide mutation site of the

图6 ts12和ts2突变体等位测验
A:植株雌性化雄穗; B:和等位测验后代表型。
A: the feminized tassel ofmutant; B: the mutant phenotype in the offspring of allelism test ofand.
2.5 外源植物激素JA处理
JA在玉米性别决定调控中发挥重要作用, 已知在外源JA处理后雌性化雄穗可恢复正常[4]。用1 mmol L–1JA溶液、0.05%乙醇分别处理23株和16株生长35 d的突变体, 雄穗发育成熟后, 分别观察小穗性别恢复情况, 并统计雄穗结实数(图7)。未实施任何处理的15株和用0.05%乙醇处理的16株突变体平均结实数分别为133粒和144粒, 雄穗结实数在统计学上并无明显差异(图7-A, B, D); 相反用JA处理的植株雄穗性别得到了恢复(图7-C), 花丝数量明显减少, 平均雄穗结实29粒, 与未实施任何处理和用0.05%乙醇处理植株的雄穗结实数有极显著差异。同时在田间发现JA处理植株性别恢复程度并不完全一致, 部分植株雌性化小穗恢复程度较低, 但也有部分植株99%雌性化小穗得到恢复。该结果证实基因参与JA合成途径, 从而影响了玉米性别决定过程。
A: 未处理的雄穗表型; B: 0.05%乙醇处理的雄穗表型; C: JA处理的雄穗表型; D: 雄穗结实数统计; 柱形图上方数字代表标准差; **代表JA处理植株雄穗结实数量与未处理植株和0.05%乙醇处理植株雄穗结实数在统计学上有极显著差异(< 0.01)。
A: untreatedtassel phenotype; B: 0.05% ethanol-treatedtassel phenotype; C: JA-treatedtassel phenotype; D: number of tassel seeds permutant. The numbers on top of the column represent the standard deviation. ** indicates extremely significant difference of tassel seeds number between JA-treatedand untreated and 0.05% ethanol-treatedplants (< 0.01).
2.6 ts2基因表达分析
基因表达水平是一个基因在特定组织中功能重要与否的重要评判依据。提取F2群体中突变体和野生型植株各组织总RNA, 对基因表达进行定量分析(图8)。发现基因在玉米雄穗中表达量最高, 雌穗和叶片中次之, 而在根、茎、花丝中的表达水平较低, 在授粉后20 d的胚乳和胚中没有检测到表达, 由此可知基因主要在玉米雄穗中发挥重要作用。同时在突变体中,基因突变后, 其表达在未成熟雄穗和雌穗中极显著降低, 从而可能导致雄穗中的雌蕊不能正常败育, 最终产生tasselseed的表型。
3 讨论
玉米雄穗和雌穗发育与玉米产量密切相关。玉米雄穗小花中的雌蕊、雌穗小花中的雄蕊的选择性败育产生了单性花, 这一过程是多个基因表达调控网络及遗传位点控制的。目前, 已有多个控制玉米性别的遗传位点被鉴定[25-26]。我们通过化学诱变获得了一个tasselseed表型突变体, 利用图位克隆的方法分离目标基因, 发现已知基因可能就是导致突变表型的原因。克隆分析基因发现, 其编码蛋白保守结构域中发生了氨基酸的替换。等位性测验结果表明突变表型是已报道的性别决定基因的突变引起的(图7-A)。外源施加茉莉酸处理后, 性别明显得到恢复; 杨松青等[27]研究也揭示了表达受到JA的诱导, 进一步证实了是一个典型的依赖于JA的性别决定基因。
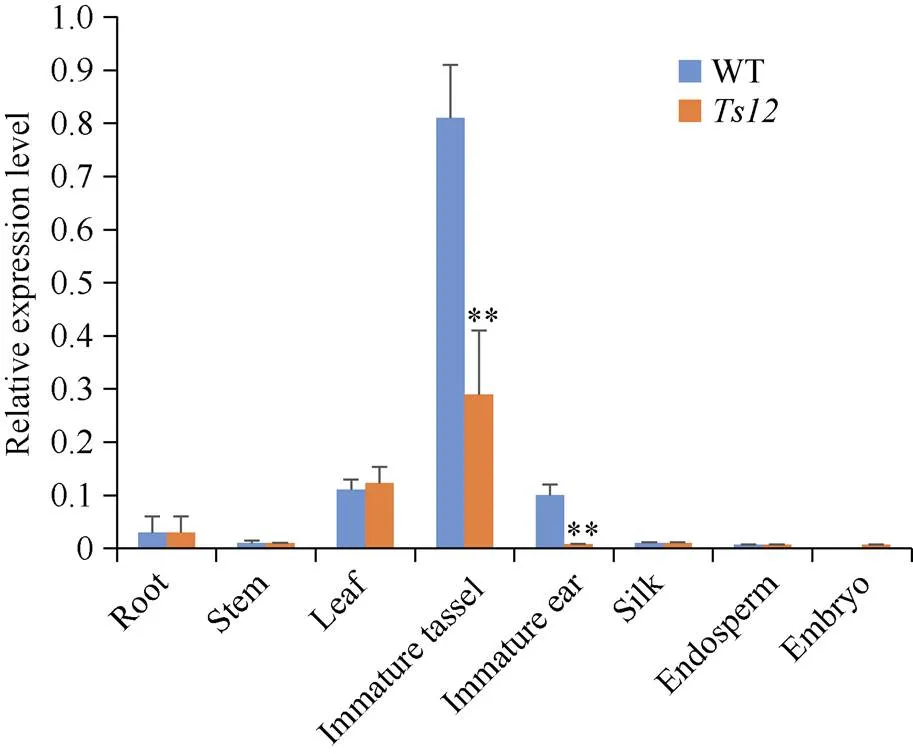
图8 Ts2基因表达分析
Root: 根; Stem: 茎; Leaf: 叶; Silk: 花丝; Immature ear: 雌穗; Immature tassel: 雄穗; Embryo: 授粉后20 d胚; Endosperm: 授粉后20 d胚乳。
**代表在特定组织中基因表达与野生型相比在统计学上有极显著差异(< 0.01)。
** indicates extremely significant difference of expression in specific tissues betweenand WT (< 0.01).
基因编码一个短链乙醇脱氢酶。短链乙醇脱氢酶超家族蛋白是一类与系统发育相关的酶, 催化作用于多种底物, 如糖、类固醇、前列腺素、芳香烃、抗生素和参与氮代谢的化合物[28]。短链乙醇脱氢酶超家族蛋白具有一个保守的结构域A, 它可以与NAD(P)辅助因子结合[29]。通过比较高粱、小米、水稻、二穗短柄草、拟南芥的Ts2直系同源蛋白及小鼠[30]、人类[31]、黄杆菌[32]、假单胞菌[33]和大肠肝菌[34]短链乙醇脱氢酶发现, 在其保守结构域A中具有典型的短链脱氢酶基序特征“TGxxxGhG”(附图1), 该基序在与辅酶结合过程中具有重要作用[35-36]。在突变体中, Ts2蛋白的第66个氨基酸, 也即基序TGxxxGhG中的第2个G (甘氨酸)被替换为R (精氨酸), 可能导致Ts2无法与辅酶稳定结合, Ts2蛋白复合体催化效率降低。突变体雄穗主穗及侧枝顶端部分雄蕊可正常发育, 产生有功能的花粉, 可自交获得纯合的突变体后代。然而突变表型为雄穗小穗完全雌性化, 仅能产生雌性的单性花, 而且雌性化的小穗均能产生正常功能的雌配子[5]。由于突变体是由Ac转座子插入引起的, 导致基因功能完全丧失; 而突变体则是EMS诱变导致基因CDS序列发生单核苷酸突变, 除了该基因编码蛋白第66个氨基酸发生了替换外, 其他氨基酸序列与野生型一致。因此, 我们推测突变体中, 单个氨基酸的替换虽然导致Ts2蛋白不能与辅酶稳定结合, 催化效率降低, 但仍能发挥部分功能, 致使部分小穗可正常散粉。与突变体测验后代与一样可产生有功能的花粉, 进一步印证了这一论断。但同时我们也注意到在突变体中,基因在雄穗和雌穗中的表达水平与正常植株相比, 显著降低(图8), 这一因素可能也是造成性别决定发生反转的原因之一。通过对基因转录起始位点上游包括启动子区域的3 kb序列进行测序分析, 没有发现碱基的突变, 因此推测表达水平的改变可能是因单位点突变后造成mRNA不稳定, 也可能是基因表达调控网络反馈抑制的结果。
玉米性别决定过程中, 雌蕊的败育依赖于植物激素茉莉酸调节的基因表达调控网络。外源施加茉莉酸可恢复、和突变体表型[4,8], 因此这3个基因均参与了茉莉酸的合成和代谢。、双突变体和、双突变体表型分析表明和与均呈上位性效应[37], 而mRNA在雌蕊中的积累依赖于的生物学功能[6], 因此位于茉莉酸代谢合成基因表达调控网络的下游节点。Wu等[7]在大肠杆菌中制备了TS2重组蛋白, 发现TS2以四聚体形式发挥功能, 起3β-或17β-羟基类固醇脱氢酶或羰基/醌还原酶的作用。然而其在玉米性别决定过程中发挥重要功能的具体作用机制依然不是十分清楚。我们新发现的等位突变体丰富了与玉米性别决定研究材料, 为进一步解析基因在玉米性别决定过程中的分子机制奠定了基础。
4 结论
通过EMS诱变, 新发现了一个与玉米性别决定相关的突变体。被定位于玉米1号染色体1.04 bin 290 kb的物理区间。基因CDS中的第196个碱基鸟嘌呤被替换为腺嘌呤, 导致该位点编码的氨基酸甘氨酸被替换为精氨酸。是的等位突变体。突变体为深入探究基因的功能提供了新的研究材料。
[1] 齐光, 穆靖, 吴秀菊. 植物的性别决定机制. 东北农业大学学报, 2009, 40(3): 140–144. Qi G, Mu J, Wu X J. Sex-determining mechanisms in plants., 2009, 40(3): 140–144 (in Chinese with English abstract).
[2] Wu X, Mcsteen P. The role of auxin transport during inflorescence development in maize (, Poaceae)., 2007, 94: 1745–1755.
[3] Dellaporta S L, Calderon-Urrea A. The sex determination process in maize., 1994, 266: 1501–1505.
[4] Acosta I F, Laparra H, Romero S P, Schmelz E, Hamberg M, Mottinger J P, Moreno M A, Dellaporta S L.is a lipoxygenase affecting jasmonic acid signaling in sex determination of maize., 2009, 323: 262–265.
[5] DeLong A, Calderon-Urrea A, Dellaporta S L. Sex determination geneof maize encodes a short-chain alcohol dehydrogenase required for stage-specific floral organ abortion., 1993, 74: 757–768.
[6] Calderon-Urrea A, Dellaporta S L. Cell death and cell protection genes determine the fate of pistils in maize., 1999, 126: 435–441.
[7] Wu X, Knapp S, Stamp A, Stammers D K, Jörnvall H, Dellaporta S L, Oppermann U. Biochemical characterization of, an essential plant short-chain dehydrogenase/reductase with broad spectrum activities., 2007, 274: 1172–1182.
[8] Kimberlin A, Leiboff S, Koo A J, Hake S.overexpresses a wound-inducible enzyme,, that affects jasmonate catabolism, sex determination, and plant architecture in maize., 2019, 2: 114.
[9] Hayward A P, Moreno M A, Howard T P, Hague J, Nelson K, Heffelfinger C, Mottinger J P. Control of sexuality by the-encoded UDP-glycosyltransferase of maize., 2016, 2: e1600991.
[10] Li Q, Liu B. Genetic regulation of maize flower development and sex determination., 2017, 245: 1–14.
[11] Parkinson S E, Gross S M, Hollick J B. Maize sex determination and abaxial leaf fates are canalized by a factor that maintains repressed epigenetic states., 2007, 308: 462–473.
[12] Yan Y, Christensen S, Isakeit T, Engelberth J, Meeley R, Hayward A, Emery R J N, Kolomiets M V. Disruption ofandreveals the versatile functions of jasmonic acid in maize development and defense., 2012, 24: 1420–1436.
[13] Yan Y, Huang P C, Borrego E, Kolomiets M. New perspectives into jasmonate roles in maize., 2014, 9: e970442.
[14] 杨同文, 李潮海. 玉米性别决定的激素调控. 植物学报, 2012, 47: 65–73. Yang T W, Li C H. Hormone regulation of sex determination in maize., 2012, 47: 65–73 (in Chinese with English abstract).
[15] Fujioka S, Yamane H, Spray C R, Gaskin P, Macmillan J, Phinney B O, Takahashi N. Qualitative and quantitative analyses of gibberellins in vegetative shoots of normal,,,, andseedlings ofL., 1988, 88: 1367–1372.
[16] Bensen R J, Johal G S, Crane V C, Tossberg J T, Schnable P S, Meeley R B, Briggs S P. Cloning and characterization of the maizegene., 1995, 7: 75–84.
[17] Yamasaki S, Fujii N, Takahashi H. Hormonal regulation of sex expression in plants., 2005, 72: 79–110.
[18] Hansen D J, Bellman S K, Sacher R M. Gibberellic acid-controlled sex expression of corn tassels., 1976, 16: 371–374.
[19] Hartwig T, Chuck G S, Fujioka S, Klempien A, Weizbauer R, Potluri D P V, Choe G, Johal G S, Schulz B. Brassinosteroid control of sex determination in maize., 2011, 108: 19814–19819.
[20] Chuck G, Meeley R, Irish E, Sakai H, Hake S. The maizemicroRNA controls sex determination and meristem cell fate by targeting/., 2007, 39: 1517–1521.
[21] Neuffer M G, Coe E H. Paraffin oil technique for treating mature corn pollen with chemical mutagens., 1978, 23: 21–28.
[22] 李强, 万建民. SSRHunter, 一个本地化的SSR位点搜索软件的开发. 遗传, 2005, 27: 808–810. Li Q, Wan J M. SSRHunter: development of a local searching software for SSR sites., 2005, 27: 808–810 (in Chinese with English abstract).
[23] 张军, 武耀廷, 郭旺珍, 张天真. 棉花微卫星标记的PAGE/银染快速检测. 棉花学报, 2000, 12: 267–269. Zhang J, Wu Y T, Guo W T, Zhang T Z. Fast screening of microsatellite markers in cotton with PAGE/silver staining., 2000, 12: 267–269 (in Chinese with English abstract).
[24] Liu C X, Wang G Q, Gao J, Li C Y, Zhang Z R, Yu T T, Wang J G, Zhou L, Cai Y L. Characterization, fine mapping and candidate gene analysis of novel, dominant, nuclear male-sterile genein maize., 2018, 214: 52.
[25] Veit B, Schmidt R J, Hake S, Yanofsky M F. Maize floral development: new genes and old mutants., 1993, 5: 1205.
[26] 张赛赛, 席章营, 安云权, 李明娜, 谢慧玲, 张莹莹, 崔新建, 陈彦惠, 吴连成. 玉米雄穗结实基因的初步定位. 河南农业大学学报, 2015, 49: 301–304. Zhang S S, Xi Z Y, An Y Q, Li M N, Xie H L, Zhang Y Y, Cui X J, Chen Y H, Wu L C. Initial genetic mapping of a tassel seed genein maize., 2015, 49: 301–304 (in Chinese with English abstract).
[27] 杨松青, 安立昆, 严远鑫. 玉米性别决定基因的表达模式分析. 南京农业大学学报, 2017, 40: 936–940. Yang S Q, An L K, Yan Y X. The gene expression analysis of2 in maize organs/tissues., 2017, 40: 936–940 (in Chinese with English abstract).
[28] Krozowski Z. The short-chain alcohol dehydrogenase superfamily: variations on a common theme., 1994, 51: 125–130.
[29] Coleman J P, White W B, Lijewski M, Hylemon P B. Nucleotide sequence and regulation of a gene involved in bile acid 7-dehydroxylation bysp. strain VPI 12708., 1988, 170: 2070–2077.
[30] Churchill P, Hempel J, Romovacek H, Zhang W W, Brennan M, Churchill S. Primary structure of rat liver D-β-hydroxybutyrate dehydrogenase from cDNA and protein analyses: a short-chain alcohol dehydrogenase., 1992, 31: 3793–3799.
[31] Peltoketo H, Isomaa V, Mäentausta O, Vihko R. Complete amino acid sequence of human placental 17 β-hydroxysteroid dehydrogenase deduced from cDNA., 1988, 239: 73–77.
[32] Yamamoto-Otake H, Koyama Y, Horiuchi T, Nakano E. Cloning, sequencing, and expression of the N-acyl-D-mannosamine dehydrogenase gene fromsp. strain 141-8 in., 1991, 57: 1418–1422.
[33] Abalain J H, Di Stefano S, Amet Y, Quemener E, Abalain-Colloc M L, Floch H H. Cloning, DNA sequencing and expression of (3–17) β-hydroxysteroid dehydrogenase from., 1993, 44: 133–139.
[34] Rawlings M, Cronan J E. The gene encodingacyl carrier protein lies within a cluster of fatty acid biosynthetic genes., 1992, 267: 5751–5754.
[35] Oppermann U C T, Filling C, Berndt K D, Persson B, Benach J, Ladenstein R, Jörnvall H. Active site directed mutagenesis of 3β/17β-hydroxysteroid dehydrogenase establishes differential effects on short-chain dehydrogenase/reductase reactions., 1997, 36: 34–40.
[36] Jörnvall H, Höög J O, Persson B. SDR and MDR: completed genome sequences show these protein families to be large, of old origin, and of complex nature., 1999, 445: 261–264.
[37] Irish E E, Langdale J A, Nelson T M. Interactions between tassel seed genes and other sex determining genes in maize., 1994, 15: 155–171.
Genetic analysis and molecular characterization of tasselseed mutantin maize
QIN Li-Ping**, DONG Er-Fei**, BAI Yang, ZHOU Lian, REN Lan-Yang, ZHANG Ren-Feng, LIU Chao-Xian*, and CAI Yi-Lin*
Maize Research Institute, Southwest University / Engineering Research Center of South Upland Agriculture, Ministry of Education, Chongqing 400715, China
Sex determination is closely associated with development of maize tassel and ear. Function study of the genes underlying maize sex determination is critical for elucidating its regulation network. One sex determination mutant with feminized tassel, named(), was created through B73 pollen treatment with chemical agent ethyl methyl sulfonate (EMS). The feminized tassel spikelets were observed under scanning electron microscope when the immature tassels were 13 mm long. Using map-based cloning strategy, thewas mapped to an interval about 290 kb, flanked by markers LM4 and RM5, which harbored nine annotated genes including the reported sex determination gene(). Thecoding sequence frommutant revealed the 196th base guanine was substituted by adenine, leading to the substitution of amino acids from glycine to arginine, which probably resulted in the tasselseed phenotype. An allelic test crossingwithshowed that all the F1, F2plants could produce feminized tassels with lots of silks, which indicatedwas a new allelic mutant of. The exogenous jasmonic acid (JA, 1 mmol L–1) could recover the normal phenotype of most of spikelets. The expression analysis ofin wild-type plants showed a high expression level in immature tassels, and moderate one in immature ears and leaves. However, its expression was dramatically decreased in immature tassels and ears of. The mutation in conserved region and the reduced expression ofprobably are the causes of tasselseed phenotype.
;; tasselseed; fine mapping; allelism test
附表1基因定位、候选基因克隆及表达分析引物序列
Supplementary table 1 Primer sequences formapping, candidate gene cloning and expression analysis

引物名称Primer name正向引物序列Forward primer sequence (5′–3′)反向引物序列Reverse primer sequence (5′–3′)标记类型Genetic marker types LM1CACAGCAAGAGTACAGCATCAGTGATCCCAGTTCTCGATGTAGCSSR LM2GGAAATGTTTGACGTGACCTGCCACTTGGCAAACCAATCCAACGSSR LM3AATAGCGTGCTCCCGTGTTATCCTGTCGTTGCTTGCTTCTTCCASSR LM4AATGGGATAAAGACCGGATTCTATAAGCGTTGTAGGACAGGAGCInDel RM1TCGGAGAGGACACGGTTTAGTACATGAACATTGGCGAAGCTACCSSR RM2GCTCCTGTGTGCAACTTGTTAGGCATATGAATCGGTGTTCGGTGSSR RM3CTGTTCCTTCGCTTTCACAGAAAGTAGCTCTCTAGTTGTGTCCCSSR RM4GCTGATTTAAGATATAAAGTGCCTCCCCCTGCTGGACCGGAGTAAAGInDel RM5AGAACGGTGATTTTTGTCTGGTGTTTTGCATGCTCATGTAGACGInDel Ts2-JDACAGCAGAGTAGAGTAGCACACGCCATGGGAATGGGATATTTGG Ts2-qPCRGTGGAGAAGATGGAGGAGGTGGTATTGATTCACAAGCCGATGAGGTT ActinTCACCCTGTGCTGCTGACCGGAACCGTGTGGCTCACACCA
附图1 短链乙醇脱氢酶同源蛋白保守结构域A序列分析
Supplementary fig. 1 Sequence analysis of conservative domain A of short-chain alcohol dehydrogenases
SbTs2: 高粱Ts2; SiTs2: 小米Ts2; OsTs2: 水稻Ts2; BdTs2: 二穗短柄草Ts2; ATSDR2: 拟南芥Ts2直系同源蛋白; BHD: 来自小鼠的短链乙醇脱氢酶; 17βHSD1: 来自人的短链乙醇脱氢酶; NACMAN: 来自黄杆菌的短链乙醇脱氢酶; 3βHSD: 来自假单胞菌的短链乙醇脱氢酶; FABG: 来自大肠杆菌的短链乙醇脱氢酶。
SbTs2: Ts2 ortholog from sorghum; SiTs2: Ts2 ortholog from; OsTs2: Ts2 ortholog from rice; BdTs2: Ts2 ortholog from; ATSDR2: Ts2 ortholog from; BHD: a short-chain alcohol dehydrogenase from rat; 17βHSD1: a short-chain alcohol dehydrogenase from human; NACMAN: a short-chain alcohol dehydrogenase from; 3βHSD: a short-chain alcohol dehydrogenase from; FABG: a short-chain alcohol dehydrogenase from.
10.3724/SP.J.1006.2020.93051
本研究由国家自然科学基金项目(31601312)和重庆市重大科技攻关项目(cstc2016shms-ztzx80013, cstc2016shms-ztzx80016, cstc2016shms- ztzx80017)资助。
This study was supported by the National Natural Science Foundation of China (31601312) and the Major Project of Chongqing for Science and Technology (cstc2016shms-ztzx80013, cstc2016shms-ztzx80016, cstc2016shms-ztzx80017).
蔡一林, E-mail: caiyilin1789@163.com; 刘朝显, E-mail: cauxian@163.com
秦利萍, E-mail: 919494709@qq.com
2019-09-16;
2020-01-15;
2020-01-23.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200123.1244.004.html
