对马铃薯类受体激酶CRK基因家族的鉴定及响应病原真菌信号的表达分析
2020-04-16张卫娜范艳玲康益晨杨昕宇石铭福赵章平张俊莲秦舒浩
张卫娜 范艳玲 康益晨 杨昕宇 石铭福 要 凯 赵章平 张俊莲 秦舒浩
对马铃薯类受体激酶CRK基因家族的鉴定及响应病原真菌信号的表达分析
张卫娜 范艳玲 康益晨 杨昕宇 石铭福 要 凯 赵章平 张俊莲 秦舒浩*
甘肃农业大学园艺学院, 甘肃兰州 730070
富含半胱氨酸的类受体激酶(cysteine-rich receptor-like kinase, CRK)在植物生长发育和环境适应过程中发挥重要的作用。本研究鉴定了马铃薯()家族成员, 并对其理化性状、进化特征、亚细胞定位、染色体位置和表达模式进行分析。鉴定获得8个s, 其氨基酸序列大小为459~686 aa, 分子量介于50.75~77.50 kD, 等电点介于5.84~8.75, 主要位于质膜。进化分析将来自马铃薯、拟南芥、香蕉、苹果、水稻、番茄和棉花的CRKs分为9个亚组, 2号、3号和5号染色体上的CRKs分布于亚组I (6个成员)和VI (2个成员); 存在2个串联重复基因簇, 包含4个成员。s启动子区域存在多种顺式调控元件, 主要响应激素、低温、防卫和逆境等信号。接种晚疫病菌(,)和干腐病菌(,)后, 分别发现8个和6个s为差异表达。其中,4和8响应和信号, 在接种以上2种病原菌后, 表达量上调8倍以上, 推测其响应多个真菌信号, 可能在马铃薯对真菌病害的广谱抗性中起重要作用, 可作为进一步抗病研究和功能分析的候选基因。
CRK; 顺式表达元件; 生物信息学分析; 硫色镰刀菌; 马铃薯晚疫病菌
植物类受体激酶(receptor-like kinase,RLK)是一类定位在细胞膜上的单次跨膜蛋白,由数量庞大的不同种类的蛋白质组成[1]。RLKs的分子结构和功能与动物的受体蛋白激酶相似,在几乎所有的生命活动中起重要的调控作用。植物中的第1个RLK基因是1990年由开拓者John C Walker和Ren Zhang教授在玉米中发现的[2]。此后,在植物中陆续鉴定到越来越多的RLKs,在模式植物拟南芥中约有600多个[3],而在水稻中约有1130多个,被认为是植物体中最大的一类受体基因[4]。一个典型的RLK由N端信号肽序列、胞外受体结构域、跨膜结构域和胞内激酶区构成[5]。N端信号肽具有疏水的功能,蛋白质合成的过程中起识别胞外信号的作用。植物RLK的胞外结构域能识别细胞外生长、发育和各种环境因子,进而将信息传递至胞内激酶区,使之发生磷酸化或去磷酸化等反应,开启或关闭下游靶蛋白,从而调节植物的生长发育和逆境响应[6-7]。根据RLKs胞外结构域氨基酸序列的差异,可将其分为:富含亮氨酸重复序列型(leucine-rich repeats,LRR)、Malectin、类凝集素型(lectin-like)、Lysin motif (LysM)、DUF26等,进而其分为40余个亚家族[4]。其中,富含半胱氨酸的类受体激酶(cysteine-rich receptor-like kinase,CRK)是一类广泛存在于动物和植物中的膜受体蛋白,具有1个N端信号肽、1个跨膜结构域、1个C端的胞内丝氨酸/苏氨酸蛋白激酶结构域(Ser/Thr protein kinase domain)以及1个通常由1~4个拷贝的strss-antifung结构域构成的胞外结构域(extracellular domain)[8]。研究发现,拟南芥有44个CRKs,陆地棉中有70个[9-10]。
CRKs在植物生长发育、激素信号传导、非生物胁迫和病原体防御以及细胞过敏性死亡中发挥至关重要的作用[11-12]。拟南芥中,过表达、、或均可增强植物防御病原菌早期和中期的免疫反应[13-14]。当拟南芥受丁香假单胞菌DC3000侵染后,或过表达的植株细胞迅速发生过敏性死亡,诱导病原菌相关防御基因上调表达[15-17];而突变体则通过加速胞外活性氧的爆发诱导细胞过敏性死亡,从而抑制病原菌的生长[18]。水稻中也有相似的研究,和与互作可以介导水稻对多种病原菌的广谱性免疫反应[19]。但是,在大麦中,瞬时沉默能够增强表皮细胞对白粉病菌f. sp.的抗性而不影响R基因介导的抗病途径[20],这些研究表明CRKs在植物免疫抗病中起重要调控作用,但是不同CRKs的功能和作用方式不同。
CRKs作为对植物生长发育和抗逆性具有重要功能的植物类受体激酶中的一大类,其在马铃薯基因组中的分布、表达及功能尚未见报道。本研究采用生物信息学的分析方法,分析马铃薯CRK基因家族的成员数量、染色体定位、进化及其分类;预测编码蛋白质的生理生化特性和顺式表达元件; 分析对干腐病和晚疫病病菌侵染时的响应模式,以期为进一步研究马的功能提供理论基础。
1 材料与方法
1.1 数据搜索和CRKs鉴定
马铃薯基因组、CDS和蛋白序列及染色体位置等信息均下载自马铃薯基因组在线数据资源(http:// potato.plantbiology.msu.edu/integrated_searches.shtml)。拟南芥、香蕉、苹果、水稻、番茄和棉花蛋白序列分别下载自拟南芥在线信息资源(Arabidopsis information resource, TAIR: http://www. arabidopsis.org/)、香蕉基因组数据库(https://banana-genome-hub.southgreen. fr/)、苹果基因组数据库(Genome Database of Rosaceae species, GDR: https://www.rosaceae.org/)、水稻基因组数据库(Rice Genome Annotation Project, http://rice. plantbiologymsu.edu/)、茄科植物基因组数据库(Solanaceae Genomics Resource: http://solanaceae. plantbiology.msu.edu/index.shtml)和棉花基因组数据库(http://www.cottongen.org/)。利用HMMER3.0软件(HMMER 3.0, http://hmmer.janelia.org/)鉴定马铃薯基因。利用保守域预测软件Pfam (http://pfam. janelia.org/)和SMART (http://smart.emblheidelberg. de/)初步鉴定获得的候选基因, 确保其N-末端含有一个或多个Stress-antifung结构域、C-末端Pkinase结构域和跨膜结构域。
1.2 马铃薯CRKs的生物信息学分析
分别使用在线分析工具ExPASyProtParam (https:// web.expasy.org/protparam/)、CELLO v.2.5 (http://cello. life.nctu.edu.tw/)、WoLF PSORT (https://www.genscript. com/wolf-psort.html)和MapDraw确认分析[21]理化性质、亚细胞定位和染色体位置可视化。利用ClustalX1.83软件[22]进行多序列比对, 并用进化分析软件MEGA5.0 (http://www.megasoftware.net/), 以邻接法(Neighbor-joining method)构建进化树, 执行参数为Poission模式(Poission Model)、部分删除(Partial deletion)和1000次重复有根树(Bootstrap replicated 1000)。
1.3 马铃薯CRKs结构分析
从马铃薯基因组数据库中下载马铃薯外显子和内含子分布数据的存储文件, 利用GSDS 2.0网站(http://gsds.cbi.pku.edu.cn/)绘制基因结构分布图。
1.4 马铃薯CRKs启动子顺式元件(cis-element)分析
从马铃薯基因组中提取基因转录起始位置上游1500 bp序列查找启动子顺式作用元件, 在PlantCARE数据库(http://bioinformatics.psb.ugent.be/ webtools/plantcare/ html/)预测分析。
1.5 马铃薯CRKs响应干腐病和晚疫病菌侵染的表达模式分析
采用实时荧光定量PCR (Real-time PCR)法检测马铃薯s响应干腐病和晚疫病病菌侵染的表达模式。用于响应干腐病和晚疫病病菌侵染表达模式分析的材料分别是马铃薯‘陇薯7号’块茎和‘荷兰15号’叶片。‘陇薯7号’块茎由甘肃省定西市农业科学研究院提供, 硫色镰刀菌()由甘肃农业大学食品科学与工程学院李永才教授课题组提供。在马铃薯的赤道部位均匀地打3个3 mm深、直径3 mm的小孔, 于每个小孔中接种提前备好的20 µL的孢子悬浮液(浓度1.0×106孢子 mL-1)。用聚乙烯袋包装后装入纸箱, 在室温25℃条件下贮藏。每个处理包括5个马铃薯块茎, 重复3次。接种不同时间(1 d、2 d、3 d和4 d)后, 取接种点向外0.5 cm的块茎组织, 以打孔后不接种块茎为对照。3次生物学试验重复。“陇薯7号”块茎种植后, 取叶片用2.5 mmol L-1水杨酸(salicylic acid, SA)和茉莉酸(jasmonic acid, JA)处理1 h和3 h用于验证试验。“荷兰15号”叶片为本实验室自己种植, 晚疫病菌(HB 09-16-2)由华中农业大学田振东教授课题组惠赠, 接种方法和培养条件参照蒋锐(2017)博士论文[23]。分别于接种1 d、4 d、6 d和8 d等不同时间点采样。每个处理重复3次, 锡箔纸包裹标记, 液氮速冻后保存于-80℃超低温冰箱备用。
利用RNAout试剂盒(160906-50, Tiandz, 北京)提取组织总RNA, 经质量检测合格后分别采用试剂盒PrimeScript RT reagent Kit with gDNA Eraser (RR047, TaKaRa, 大连)和SYBR Premix ExII (TliRNaseH Plus)(RR820, TaKaRa, 大连)进行cDNA合成和qRT-PCR扩增。采用在线软件Primer 3.0 (http:// primer3.ut.ee/)设计引物, 以elongation factor 1-α(GenBank登录号为AB061263)作为内参基因[24], 引物序列如表1所示。反应结束后分析荧光值变化曲线及熔解曲线, 并采用2–∆∆CT计算基因的相对表达量[25]。
1.6 统计分析
利用Microsoft Excel 2010软件处理原始数据, 利用-test (< 0.05)法分析差异显著性, 采用软件OriginPro 8.0进行图形可视化, 所有数值均表示为“平均数±标准差”。

表1 马铃薯CRKs引物
2 结果与分析
2.1 马铃薯CRKs鉴定
以马铃薯基因组序列为参考序列, 经分析和过滤, 共获得14个蛋白序列, 通过与基因编号对应, 发现部分基因对应1个以上的蛋白序列, 所对应蛋白序列完全相同。最终获得对应的8个s, 其对应蛋白的氨基酸序列大小介于459~686, 分子量和等电点分别介于50.75~77.50 kD和5.84~8.75 (表1)。利用在线软件CELLO v.2.5和WoLF PSORT对8个基因的亚细胞定位进行预测, 发现DMG400013524和DMG400015171位于质膜, 其他基因利用2种软件预测的结果有所区别, 其中4个基因位于质膜或者叶绿体, DMG400015170位于质膜或者细胞质, 而DMG400006912位于质膜或者液泡。

表2 马铃薯CRKs
亚细胞定位, “a”和“b”表示通过网络软件CELLO v.2.5和WoLF PSORT预测蛋白的定位; PM: 质膜; Vacu: 液泡; Chlo: 叶绿体; Cyto: 细胞质;#以“PGSC...”开始的基因编号是来自马铃薯基因组测序联盟数据库(http://potatogenomics.plantbiology.msu.edu/)。
For subcellular localization, “a” and “b” indicate the localization of protein predicted by using online software CELLO v.2.5 and WoLF PSORT; PM: plasma membrane; Vacu: vacuole; Chlo: chloroplast; Cyto: cytoplasm;#: Gene ID beginning with “PGSC...” is from Database of Potato Genome Sequencing Consortium (http://potatogenomics.plantbiology.msu.edu/).
2.2 马铃薯、拟南芥、香蕉、苹果、水稻、番茄和棉花CRK家族进化树分析
从图1看出, CRKs可以分为9个亚组(图1), 其亚组Ⅲ和亚组Ⅳ中, 除Gh-A01G2043和MD09G1104200外, 其余成员均来自水稻和香蕉2种单子叶植物, 而亚组VI-Ⅸ的家族成员都来自棉花、马铃薯、苹果、拟南芥、番茄等双子叶植物。马铃薯8个CRKs分布于亚组I和VI, 其中6个分布于亚组I, 2个分布于亚组VI。其亚组I中, 基因PGSC0003DMP400037082和PGSC0003DMP400001023同源性较高, 马铃薯基因PGSC0003DMP400031539、PGSC0003DMP400023928和PGSC0003DMP400012234分别与番茄基因Solyc03g112730.3.1、Solyc05g1005070.2.1和Solyc02g067780.3.1同源性较高, 均达99%以上。
2.3 马铃薯CRKs的染色体定位
通过下载马铃薯s相关染色体定位信息, 利用软件MapDraw进行染色体定位并进行可视化分析。结果显示, 马铃薯的8个s中, 3号和5号染色体上均分布3个s, 2号染色体上分布2个s。其中, PGSC0003DMG400013524和PGSC0003DMG400013525、PGSC0003DMG400015170和PGSC0003DMG400015171在染色体上的相对位置小于100 kb, 推断为串联重复基因簇。
2.4 马铃薯CRKs的结构和蛋白质功能结构域分析
利用CRKs家族成员单独构建的进化树和外显子-内含子结构如图3所示。CRKs家族成员单独构建的进化树和图1所示结果一致。CRKs具有相对保守的基因结构和蛋白功能结构域(图3)。马铃薯s长度介于3.2~5.1 kb, 外显子数目为6~8个, 较为接近。保守结构域分析结果显示, 马铃薯CRK家族中7个蛋白质具有2个stress-antifung结构域和1个Pkinase_Tyr结构域, 而PGSC0003DMP400026615(CRK7)只含有1个stress-antifung结构域和1个Pkinase_Tyr 结构域, 此外, PGSC0003DMP400026615 (CRK7)和PGSC0003DMP400026620 (CRK8)除了具有stress-antifung和Pkinase_Tyr结构域外, 还含有1个功能未知的DUF3403 (PF11883)结构域。结合CRK蛋白家族系统发育树分析结果, 位于进化树同一分支的同源基因具有相似的基因结构和功能结构域, 推测它们具有相似的生物学功能。
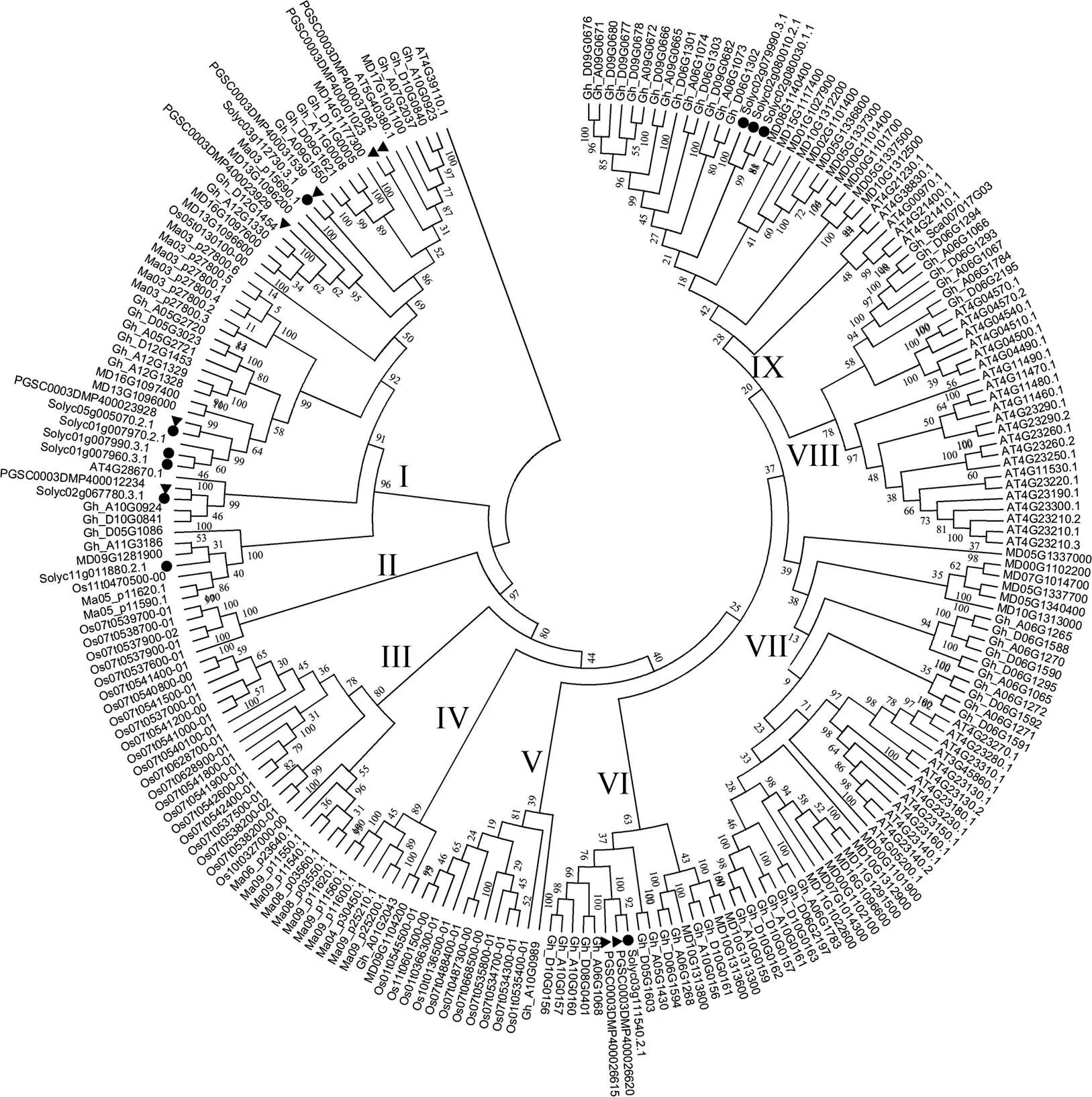
图1 马铃薯、拟南芥、香蕉、苹果、水稻、番茄和棉花CRK家族进化树分析
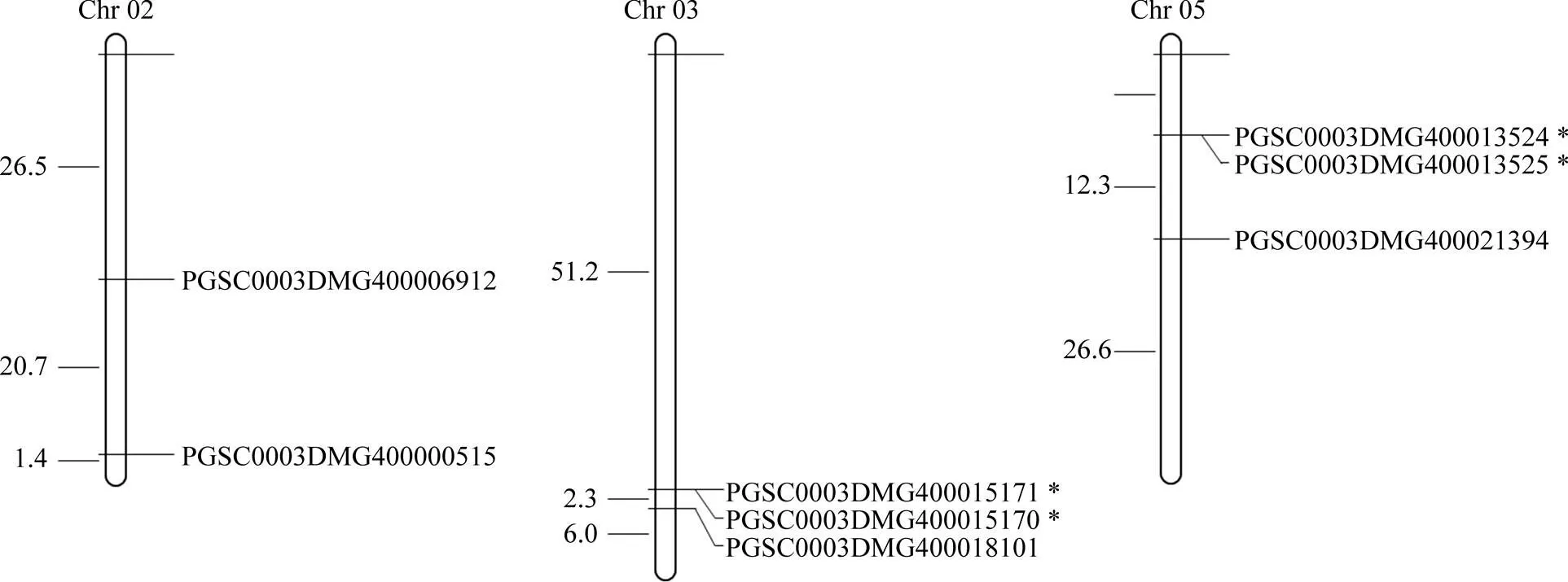
图2 马铃薯CRKs染色体定位
*代表串联重复基因簇。* indicates tandem duplication genes.
2.5 马铃薯CRKs家族cis-element分析
为进一步理解基因的调控功能, 本研究对启动子序列中顺式元件进行了分析。通过马铃薯基因组提取s起始密码子上游1500 bp启动子序列, 利用在线工具PlantCARE进行顺式元件分析, 并提取了响应激素和逆境相关的15类顺式元件。由图4可知,s启动子区域富含响应植物激素和逆境胁迫的顺式作用元件(图4)。如图所示, 与植物激素响应相关的顺式元件有5类, 分别为脱落酸响应元件(A和B)、茉莉酸甲酯响应元件(H)、水杨酸响应元件(I)、赤霉素响应元件(C、D和E)和生长素响应元件(F和G); 与生长发育相关的顺式元件有两类: 玉米醇溶蛋白代谢调控元件(J)和黄酮类代谢元件(N); 而胁迫响应相关的顺式元件主要包括: 厌氧诱导响应元件(K)、缺氧响应元件(L)、低温响应元件(O)和防御和压力响应元件(M)。这暗示了马铃薯CRK基因家族在马铃薯生长发育及多种激素和胁迫中的潜在作用。
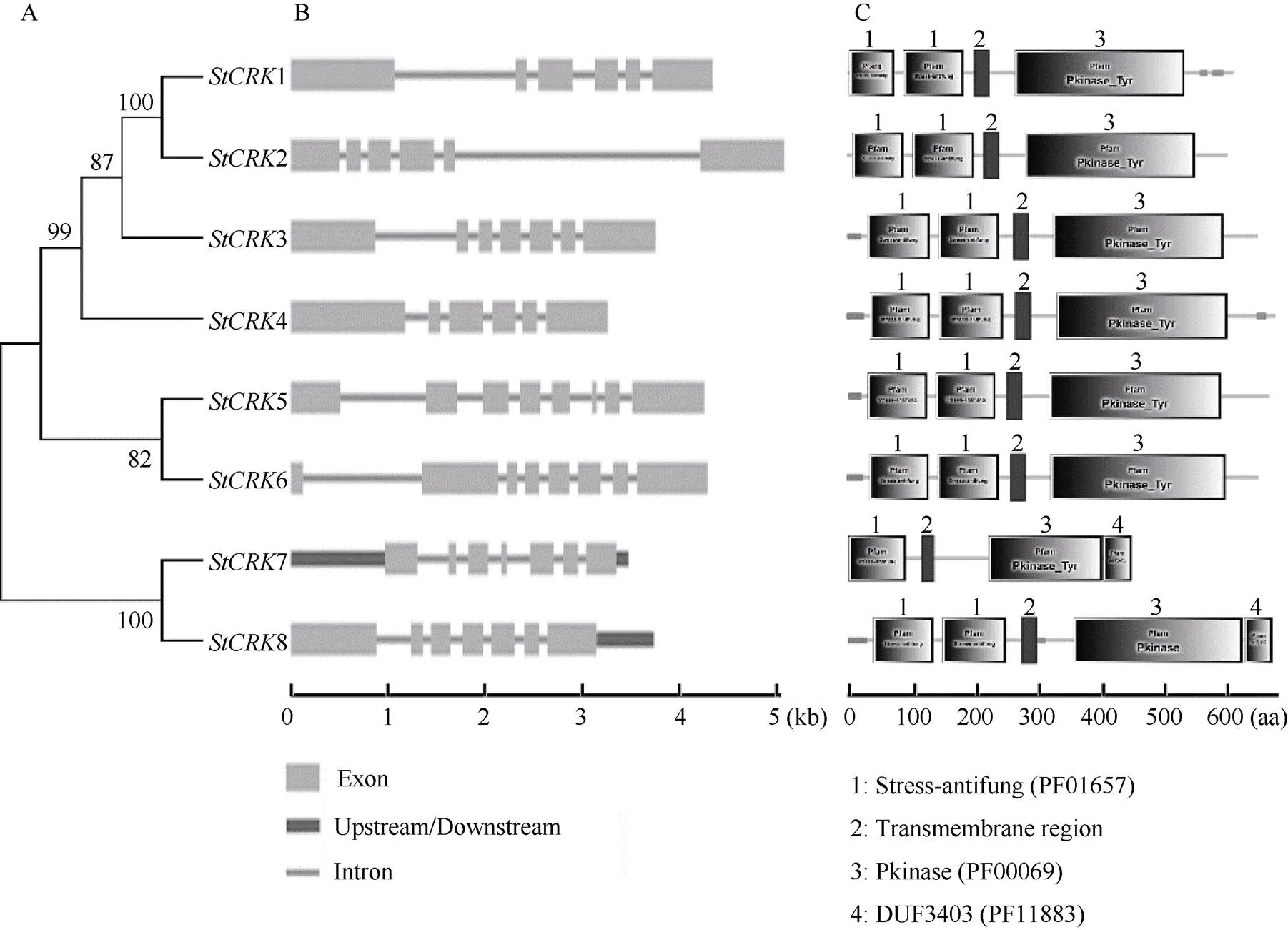
图3 马铃薯CRKs的基因结构和蛋白功能结构域分析
A: 马铃薯CRKs进化树; B: 马铃薯s基因结构; C: 马铃薯CRK蛋白的功能结构域。
A: phylogenetic tree ofCRKs; B: gene structure ofs; C: functional domains ofCRKs.

图4 预测马铃薯CRKs启动子中顺式调控元件
A和B: 脱落酸响应元件; C: GARE-motif; D和E: 赤霉素响应元件; F和G: 生长素响应元件; H: 茉莉酸甲酯响应元件; I: 水杨酸响应元件; J: 玉米醇溶蛋白代谢调控元件; K: 厌氧诱导响应元件; L: 缺氧响应元件; M: 防御和压力响应元件; N: 黄酮类代谢响应元件; O:低温响应元件。
A and B: are the abscisic acid responsive elements; C: GARE-motif; D and E: the Gibberellin responsive elements; F and G: the auxin responsive elements; H: the Methyl jasmonate responsive element; I: the Salicylic acid responsive elements; J: the regulatory element for Zein metabolism; K: the Anaerobic responsive elements; L: the anoxic responsive elements; M: the defense and stress responsive elements; N: the flavonoid responsive elements; O: the low-temperature responsive elements.
为验证所预测-element的准确性, 经SA和JA分别处理马铃薯叶片后检测了6个s的表达情况(图5)。4、5和8启动子区域均存在响应SA信号的-element。SA处理后, 以上3个s均为差异表达。其中,8上调最高, SA处理1 h和3 h后, 其表达量分别上调至对照的5.71倍和11.22倍。此外,7启动子存在响应MeJA信号的-element, JA处理1 h和3 h后其表达量也发生显著上调, 分别上调至对照的5.95倍和4.73倍。2和6启动子区域不存在响应SA和MeJA中任何一种激素的-element。尽管SA和JA处理后以上2个s也发生不同程度的变化, 但变化幅度较小。以上结果表明, 对s启动子区域-element预测的结果准确性较高。
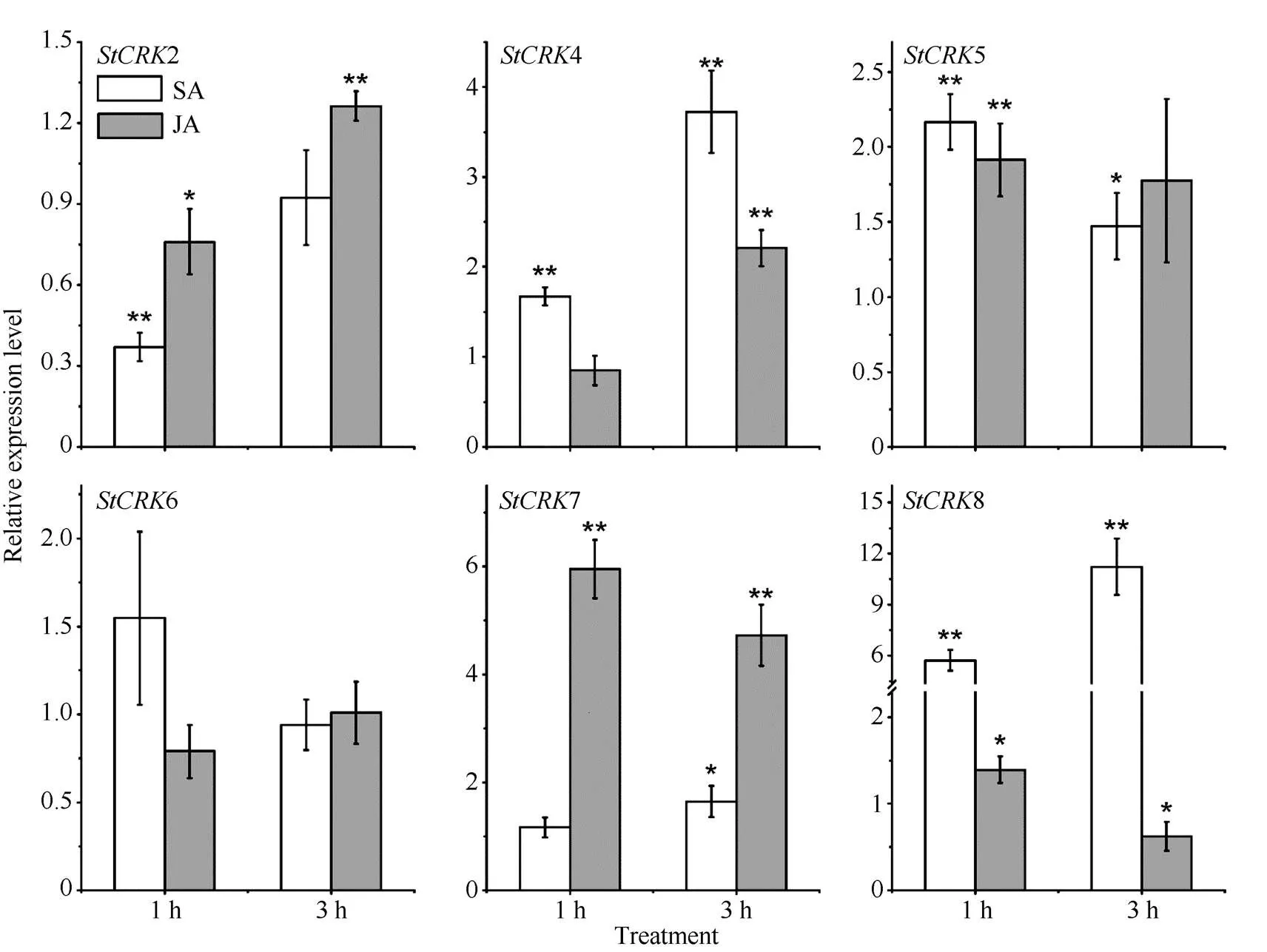
图5 SA和JA处理后6个马铃薯CRKs的表达情况
2.6 CRKs在晚疫病菌侵染马铃薯叶片中的表达分析
植物CRKs蛋白参与调节植物对生物胁迫和非生物胁迫的应答。生产中, 马铃薯晚疫病是由致病疫霉[(Mont.) de Bary]引起的, 晚疫病能够导致马铃薯茎叶死亡和块茎腐烂。为进一步分析Sts响应病原真菌的表达模式, 我们通过对马铃薯叶片接种晚疫病菌, 利用Realtime PCR技术检测了叶片中s的表达特征(图6)。通过实验发现, 8个s对晚疫病菌都有响应。其中,1、4和8随着侵染时间的延长, 其相对表达量呈逐渐上调表达的趋势, 8 d时分别上调到对照的13.02±4.40、24.72±5.40和21.38±2.10倍。3、5、7和8与对照组相比, 不同时间点均有显著差异。
2.7 CRKs基因家族在干腐病菌侵染马铃薯块茎中的表达分析
马铃薯块茎在贮藏期间极易发生腐烂, 其中由硫色镰刀菌()引起的干腐病是造成甘肃马铃薯腐烂的最主要病害, 本实验通过接种硫色镰刀菌, 检测块茎在受到病菌侵染时s的表达特征(图7)。马铃薯块茎在贮藏期受病菌侵染后, 未检测到1和7基因的表达, 而4、5和8随着病菌侵染时间的延长, 其相对表达量呈逐渐上升的趋势, 且在处理4 d时, 分别上升至对照的8.43±0.60、1.72±0.20和36.52±7.80倍;和与对照相比,不同时间点均有显著差异。据此推断, 马铃薯基因家族成员在进化过程中发生了功能分化, 分工协作参与马铃薯对病原菌的响应。
3 讨论
不同物种中CRKs的数目不尽相同, 水稻中有39个CRKs, 而拟南芥中有44个[9], 不同遗传背景的棉花中CRKs数量不同,中有70个而中有54个[10]。拟南芥44个s中19个成员是以串联成簇的形式排列于4号染色体上,而且序列之间高度相似[26]。本研究首次基于转录组数据和结构域保守序列, 对马铃薯CRKs成员进行鉴定及生物信息学分析, 共获得8个家族成员, 无规律地分布于2号、3号和5号染色体上, 进化分析将其分为2个进化分支。荧光实时定量PCR分析表明s对干腐病菌和晚疫病菌侵染的响应情况说明s可能在调控马铃薯对病原真菌的抗性反应中发挥作用。
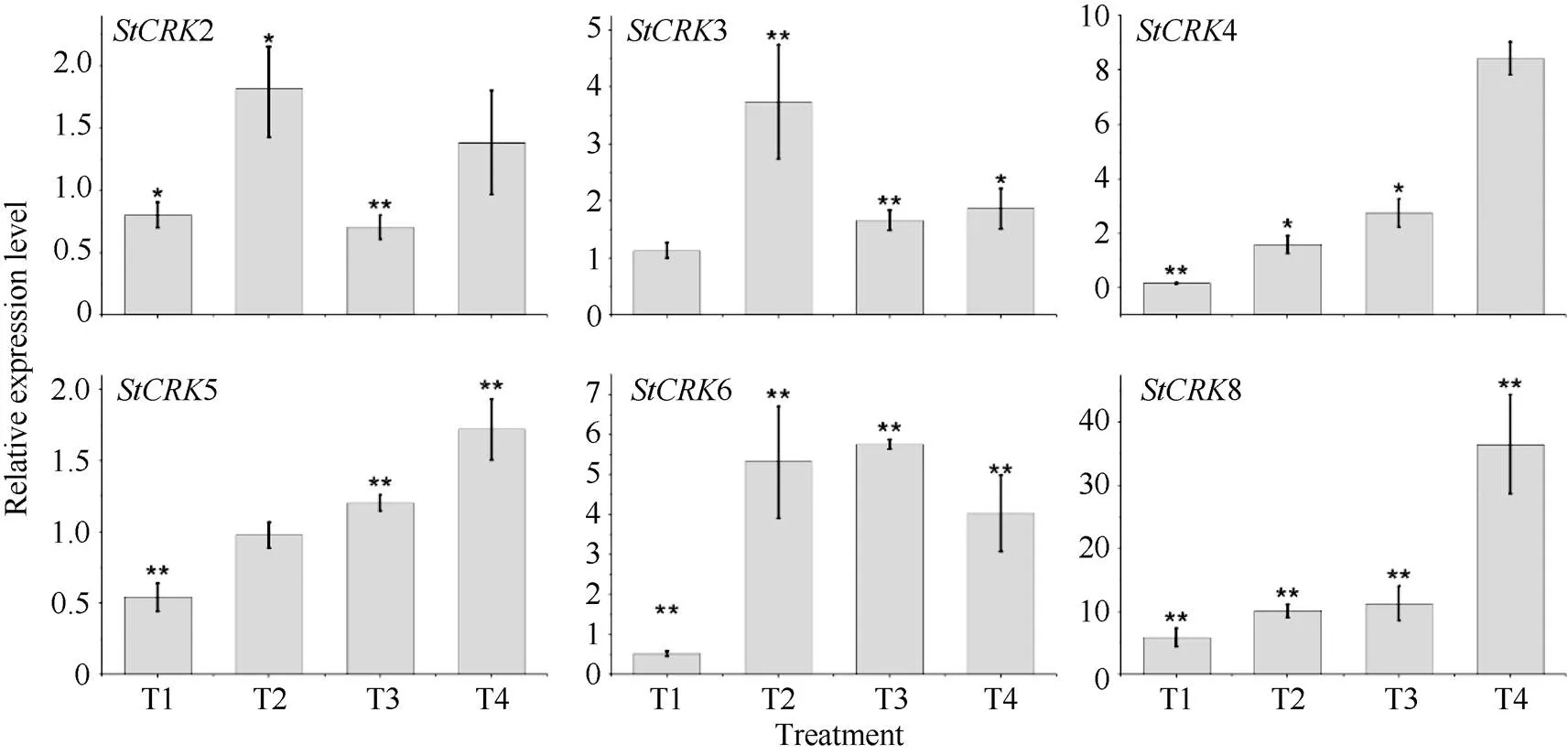
图6 马铃薯CRKs响应晚疫病菌侵染的表达分析
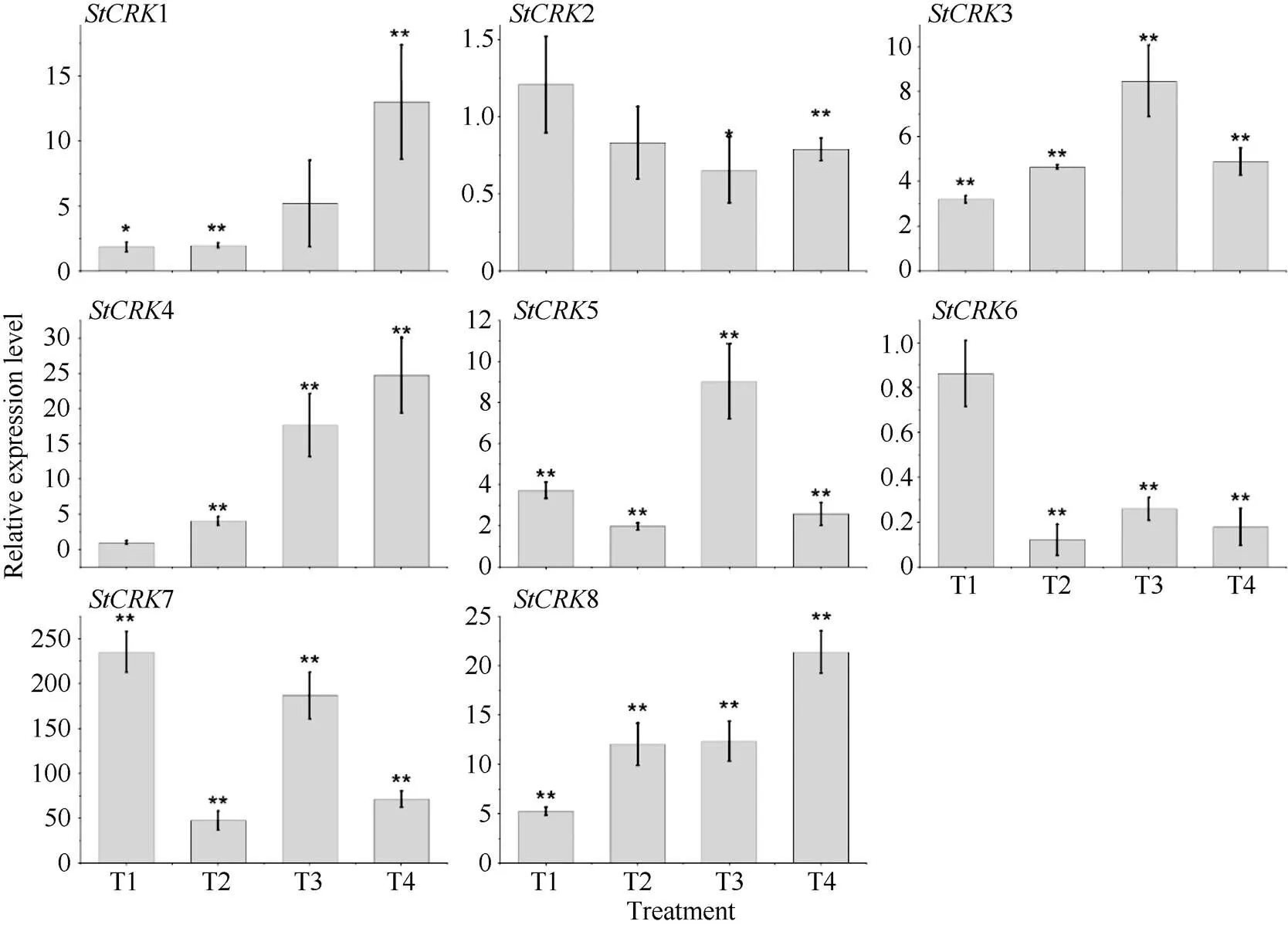
图7 马铃薯CRKs响应干腐病菌侵染的表达分析
部分马铃薯CRKs基因结构和保守结构域特征与其他基因有显著差异。其中, PGSC0003DMP400026615 (CRK7)和PGSC0003DMP400026620 (CRK8)除含有典型的stress-antifung结构域和Pkinase_Tyr结构域外还含有1个功能未知的DUF3403结构域(PF11883);s在进化过程中基因结构和保守结构域的差异, 为成员之间的功能分化提供遗传变异的基础。通过对外显子和内含子的研究, 有助于我们分析了解基因结构和功能上的差异[27]。马铃薯s的外显子为6个至8个, 而且位于进化树同一亚族内的s具有类似的内含子/外显子数目和排列模式, 同时它们的保守结构域也具有类似的数量和位置顺序, 说明亚族内成员间在进化过程中较为保守。
植物启动子要正确调控基因的表达水平和表达模式, 需要核心启动子以及上下游的顺式作用元件协同作用。Xu等[28]对中国华东野生葡萄中受白粉病和赤星病诱导表达的VpSTS诱导型启动子的序列分析发现, 该启动子含有Box-W1、TC-rich repeat element、ABRE、MBS和LTR等顺式作用元件。其中, Box-W1 (TTGACC)与欧芹中真菌激发子响应元件的保守核心序列相似, 特异性地被SA诱导的转录因子WRKY结合蛋白识别[29]。TC-rich repeat element最早是从烟草中识别出来的与防御和胁迫相关的顺式作用元件[30]。MBS是MYB转录因子同源物的结合位点[31], ABRE是ABA响应的元件[32], 而LTR是低温响应顺式元件[33]。本研究发现, 马铃薯的8个s中, 有4个s (1、2、3、4)含有TC-rich repeat element顺式元件, 7个s (1、2、3、4、5、7和8)具有ABRE元件, 1个(1)具有MBS元件, 2个s (4和6)含有LTR元件。研究表明, 植物激素包括IAA、ET、SA、ABA、GA、JA等, 在植物对多种病原菌和真菌的抗性反应中起至关重要的作用[34]。马铃薯s中含有与SA、MeJA、IAA、GA等逆境激素响应元件的基因分别为3、1、1和4个, 推测马铃薯s可能通过响应不同的激素信号参与对病原菌的防卫反应。而SA和JA在植物抗病中的重要作用已被证实, 为进一步验证所预测-elements的准确性和s对生物胁迫的响应情况, 本研究用激素SA和JA对叶片进行了处理, 实验结果表明对s启动子区域element预测的结果准确性较高。而当块茎和叶片分别受到干腐病菌和晚疫病菌侵染后,4和8基因的表达随着侵染时间的延长而逐渐增强, 推断这2个基因在马铃薯响应病原真菌的过程中起重要的作用, 可作为后续功能分析的候选基因。
4 结论
鉴定出8个马铃薯s, 并对其理化性质、染色体定位、基因结构和蛋白功能结构域进行分析, 预测了s启动子区域响应多种激素和胁迫的调控元件, 并检测了s响应马铃薯干腐病菌和晚疫病菌侵染的表达模式, 为后续研究CRKs感受并传递内外环境刺激, 调控其生理机能的分子机制提供了理论基础, 为研究CRKs的功能及其作用机制提供了参考。
[1] Sakamoto T, Deguchi M, Brustolini O J, Santos A A, Silva F F, Fontes E P. The tomato RLK superfamily: phylogeny and functional predictions about the role of the LRRII-RLK subfamily in antiviral defense., 2012, 12: 229.
[2] Walker J C, Zhang R. Relationship of a putative receptor protein kinase from maize to the-locus glycoproteins of Brassica., 1990, 345: 743–746.
[3] Shiu S H, Bleecker A B. Receptor-like kinases from Arabidopsis form a monophyletic gene family related to animal receptor kinases., 2001, 98: 10763–10768.
[4] Shiu S H, Karlowski W M, Pan R, Tzeng Y, Mayer K F, Li W. Comparative analysis of the receptor-like kinase family in Arabidopsis and rice., 2004, 16: 1220–1234.
[5] Lehti-Shiu M D, Zhou C, Shiu S H. Origin, diversity, expansion history, and functional evolution of the plant receptor-like kinase/pelle family. In: Receptor-like kinases in plants. Berlin Heidelberg: Springer, 2012. pp 1–22.
[6] Walker J C. Structure and function of the receptor-like protein kinases of higher plants., 1994, 26: 1599–1609.
[7] Wang G, Ellendorff U, Kemp B, Mansfield J W, Forsyth A, Mitchell K, Bastas K K, Liu C, Woodstor A, Zipfel C, De Wit P J G M, Jones J D G, Tor M, Thomma B P. A genome-wide functional investigation into the roles of receptor-like proteins in Arabidopsis., 2008, 147: 503–517.
[8] Chen Z. A superfamily of proteins with novel cysteine-rich repeats., 2001, 126: 473–476.
[9] Wrzaczek M, Brosche M, Salojarvi J, Kangasjarvi S, Idanheimo N, Mersmann S, Robatzek S, Karpinski S, Karpinska B, Kangasjarvi J. Transcriptional regulation of the CRK/DUF26 group of receptor-like protein kinases by ozone and plant hormones in., 2010, 10: 95.
[10] 张中起, 王娇, 靳炜, 葛冬冬, 刘康, 吕芬妮, 孙敬. 陆地棉CRK基因家族的鉴定及其表达分析. 中国农业科学, 2018, 51: 2442–2461. Zhang Z Q, Wang J, Jin W, Ge D D, Liu K, Lyu F N, Sun J. Identification and expression analysis of CRK gene family in upland cotton., 2018, 51: 2442–2461 (in Chinese with English abstract).
[11] Bourdais G, Burdiak P, Gauthier A, Nitsch L, Salojarvi J, Rayapuram C, Idanheimo N, Hunter K, Kimura S, Merilo E, Vaattovaara A, Oracz K, Kaufholdt D, Pallon A, Anggoro D T, Glow D, Lowe J, Zhou J, Mohammadi O, Puukko T, Albert A, Lang H, Ernst D, Kollist H, Brosche M, Durner J, Borst J W, Collinge D B, Karpinski S, Lyngkjaer M F, Robatzek S, Wrzaczek M, Kangasjarvi J. Large-scale phenomics identifies primary and fine-tuning roles for CRKs in responses related to oxidative stress., 2015, 11: e1005373.
[12] Xu X, Yu T, Xu R, Shi Y, Lin X, Xu Q, Qi X, Weng Y, Chen, X. Fine mapping of a dominantly inherited powdery mildew resistance major-effect QTL, Pm1.1, in cucumber identifies a 41.1 kb region containing two tandemly arrayed cysteine-rich receptor-like protein kinase genes., 2016, 129: 507–516.
[13] Yeh Y, Chang Y, Huang P, Huang J, Zimmerli L. Enhanced Arabidopsis pattern-triggered immunity by overexpression of cysteine-rich receptor-like kinases., 2015, 6: 322.
[14] Lee D S, Kim Y C, Kwon S J, Ryu C, Park O K. Thecysteine-rich receptor-like kinase CRK36 regulates immunity through interaction with the cytoplasmic kinase BIK1., 2017, 8: 1856.
[15] Chen K, Fan B, Du L, Chen Z. Activation of hypersensitive cell death by pathogen-induced receptor-like protein kinases from., 2004, 56: 271–283.
[16] Acharya B R, Raina S, Maqbool S B, Jagadeeswaran G, Mosher S, Appel H M, Schultz J C, Klessig D F, Raina R. Overexpression of CRK13, ancysteine-rich receptor-like kinase, results in enhanced resistance to., 2007, 50: 488–499.
[17] Chen K, Du L, Chen Z. Sensitization of defense responses and activation of programmed cell death by a pathogen-induced receptor-like protein kinase in., 2003, 53: 61–74.
[18] Ederli L, Madeo L, Calderini O, Gehring C, Moretti C, Buonaurio R, Paolocci F, Pasqualini S. The Arabidopsis thaliana cysteine-rich receptor-like kinase CRK20 modulates host responses topvtomato DC3000 infection., 2011, 168: 1784–1794.
[19] Chern M, Xu Q, Bart R, Bai W, Ruan D, Szeto W H, Canlas P E, Jain R, Chen X, Ronald P C. A genetic screen identifies a requirement for cysteine-rich-receptor-like kinases in rice NH1 (OsNPR1)-mediated immunity., 2016, 12: e1006049.
[20] Rayapuram C, Jensen M K, Maiser F, Shanir J V, Hornshoj H, Rung J H, Gregersen P, Schweizer P, Collinge D B, Lyngkjaer M F. Regulation of basal resistance by a powdery mildew-induced cysteine-rich receptor-like protein kinase in barley., 2012, 13: 135–147.
[21] Liu R H, Meng J L. MapDraw: a microsoft excel macro for drawing genetic linkage maps based on given genetic linkage data., 2003, 25: 317–321.
[22] Thompson J D, Gibson T J, Plewniak F, Jeanmougin F, Higgins D G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools., 1997, 25: 4876–4882.
[23] 蒋锐. 马铃薯晚疫病广谱抗性QTL dPI09c的精细定位及抗性基因克隆. 华中农业大学博士学位论文, 湖北武汉, 2017. Jiang R. Fine Mapping, Cloning and Function Dissection of the Gene Conferring Durable Late Blight Resistance of QTL dPI09c in Potato. PhD Dissertation of Huazhong Agricultural University, Wuhan, Hubei, China, 2017 (in Chinese with English abstract).
[24] 巩檑, 甘晓燕, 张丽, 陈虞超, 聂峰杰, 石磊, 郭志乾, 宋玉霞. 马铃薯基因克隆及表达分析. 分子植物育种, 2016, 14: 2589–2595. Gong L, Gan X Y, Zhang L, Chen Y C, Nie F J, Shi L, Guo Z Q, Song Y X. Cloning and function analysis of thegene from potato ()., 2016, 14: 2589–2595 (in Chinese with English abstract).
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method., 2001, 25: 402–408.
[26] Miyakawa T, Miyazono K, Sawano Y, Hatano K, Tanokura M. Crystal structure of ginkbilobin-2 with homology to the extracellular domain of plant cysteine-rich receptor-like kinases., 2009, 77: 247–251.
[27] Xu G, Guo C, Shan H, Kong H. Divergence of duplicate genes in exon-intron structure., 2012, 109: 1187–1192.
[28] Xu W R, Yu Y H, Ding J H, Hua Z Y, Wang Y J. Characterization of a novel stilbene synthase promoter involved in pathogen- and stress-inducible expression from Chinese wild., 2010, 231: 475–487.
[29] Rushton P J, Torres J T, Parniske M, Wernert P, Hahlbrock K, Somssich I E. Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes., 1996, 15: 5690–5700.
[30] Diazdeleon F, Klotz K L, Lagrimini L M. Nucleotide sequence of the tobacco () anionic peroxidase gene., 1993, 101: 1117–1118.
[31] Urao T, Yamaguchishinozaki K, Urao S, Shinozaki K. An Arabidopsis myb homolog is induced by dehydration stress and its gene product binds to the conserved MYB recognition sequence., 1993, 5: 1529–1539.
[32] Yamaguchishinozaki K, Shinozaki K. Arabidopsis DNA encoding two desiccation-responsivegenes., 1993, 101: 1119–1120.
[33] White A J, Dunn M A, Brown K, Hughes M A. Comparative analysis of genomic sequence and expression of a lipid transfer protein gene family in winter barley., 1994, 45: 1885–1892.
[34] Vidhyasekaran P. Plant hormone signaling systems in plant innate immunity. Dordrecht: Springer, 2015. pp 1–458.
Genome wide identification and expression analysis of CRK gene family in response to fungal pathogen signals in potato
ZHANG Wei-Na, FAN Yan-Ling, KANG Yi-Chen, YANG Xin-Yu, SHI Ming-Fu, YAO Kai, ZHAO Zhang-Ping, ZHANG Jun-Lian, and QIN Shu-Hao*
College of Horticulture, Gansu Agricultural University, Lanzhou 730070, Gansu, China
Cysteine-rich receptor-like kinase (CRK) plays an important role in plant growth and environmental adaptation. In this study, potato CRK () family members were identified, and their physical and chemical characteristics, evolutionary characteristics, subcellular location, chromosome location and expression patterns were analyzed. Eightmembers were identified, with amino acid size from 459 to 686 aa, molecular weight of 50.75–77.50 kD, and isoelectric point of 5.84–8.75.s were mainly located on plasma membrane. CRKs from potato (), apple (Mill), Thale Cress (), rice (), cotton (), banana (), and tomato ()could be divided into nine subgroups, andCRKs were belonged to subgroups I (6 members) and VI (2 members). Moreover,s distributed on chromosomes 2, 3, and 5, contained two tandem repeat gene clusters, including four members. There were many cis-regulated elements in thes promoter region, which mainly respond to hormones, low temperature, defense and stress signals. After inoculating() and(), eight and sixs gene differentially expressed, among them,4and8 had the expression levels by more than eight times. It is speculated that they may respond to multiple fungal signals, and play an important role in potato's broad-spectrum resistance to fungal diseases, and can be used as candidate genes for further needed on disease resistance and functional analysis.
CRK;-elements; bioinformatic analysis;();()
10.3724/SP.J.1006.2020.94096
本研究由甘肃农业大学园艺学科建设基金项目(GAU-XKJS-2018-225), 国家自然科学基金项目(31260311), 甘肃省自然科学基金项目(1606RJZA034), 中国博士后科学基金项目(2012M512042, 2014T70942)和国家现代农业产业技术体系(马铃薯)建设专项(CARS-09-P14)资助。
This study was supported by the Discipline Construction Fund Project of Gansu Agricultural University (GAU-XKJS-2018-225), the National Natural Science Foundation of China (31260311), the Natural Science Foundation of Gansu Province (1606RJZA034), the China Postdoctoral Science Foundation (2012M512042, 2014T70942), and the China Agriculture Research System (Potato, CARS-09-P14).
秦舒浩, E-mail: qinsh@gsau.edu.cn
E-mail: 844741204@qq.com
2019-06-28;
2019-12-26;
2020-01-19.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200119.1526.002.html
