培养基成分和培养条件对出芽短梗霉ZUST-I13产聚苹果酸的影响
2020-04-16章雨卉吕磊磊陈林杰魏培莲
章雨卉,吕磊磊,陈林杰,魏培莲
(浙江科技学院 生物与化学工程学院,浙江 杭州 310023)
聚苹果酸(Poly-malic acid,PMA)是以L-苹果酸为单体脱水聚合形成的一种高分子酯类化合物。聚苹果酸具有较好的水溶性、生物相容性以及化学衍生性,在食品、医药、化妆品等行业具有广泛的应用前景[1-3]。聚苹果酸的水解产物L-苹果酸也广泛应用于食品、医疗和保健品等领域[4-5]。目前,聚苹果酸的生产主要有化学合成[6]和生物发酵两种方法[7-9]。化学合成法生产聚苹果酸存在生产工艺复杂、有机溶剂残留等问题,不利于工业化生产;微生物发酵法工艺简单,耗能低,又能得到更大分子量的聚合产物,近年来受到广泛关注。目前,发酵产聚苹果酸的微生物主要是出芽短梗霉(Aureobasidiumpullulans)菌株,其主要问题是发酵周期较长、产量较低,难以满足商业化生产的需求。笔者所在实验室前期从自然界中筛选到了一株高产聚苹果酸出芽短梗霉菌株。为提高其发酵产量,笔者考察了培养基成分和培养条件对该菌株产PMA的影响,以期为后续发酵工艺的优化提供基础。
1 材料与方法
1.1 实验材料
1.1.1 菌 种
出芽短梗霉(AureobasidiumpullulansZUST-I13),笔者所在实验室分离保藏。
1.1.2 培养基
斜面培养基:PDA(马铃薯葡萄糖琼脂)培养基。
种子培养基(质量分数):5%葡萄糖,0.1%酵母提取物,0.1%蛋白胨,0.5% KH2PO4,0.04% MgSO4·7H2O,0.1% NaCl,pH自然。
发酵培养基(质量分数):12%葡萄糖,0.3% NH4NO3,0.05% KCl,0.01% KH2PO4,0.02% MgSO4·7H2O,3% CaCO3(单独灭菌),pH自然。在进行碳氮源以及锌离子实验时,根据实验需要调整培养基成分。
1.1.3 主要试剂
98% H2SO4、无水乙醇、NH4NO3、NaCl、KCl、KH2PO4、MgSO4·7H2O、ZnSO4·7H2O、NaOH、尿素,分析纯,上海化学试剂有限公司;CaCO3,天津市北辰方正试剂厂;酵母提取物,生物试剂,北京奥博星生物技术有限责任公司;蛋白胨,生物试剂,上海盛思生化科技有限公司;葡萄糖,分析纯,天津市致远化学试剂有限公司;PDA培养基,杭州微生物试剂有限公司。
1.2 仪器与设备
e2695高效液相色谱仪,美国Waters(沃特世)公司;THZ-98A摇床,上海一恒科学仪器实业有限公司;752N分光光度计,上海精密科学仪器有限公司;ME55电子分析天平,瑞士梅特勒;HH-4数显恒温水浴锅,金坛市江南仪器厂;SW-CJ-1D超净工作台,苏州净化设备有限公司;YXQ-LS-高压蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;TDZ4-WS台式低速离心机,湖南湘仪实验室仪器开发有限公司。
1.3 实验方法
1.3.1 培养方法
斜面培养:用接种环挑取斜面保藏菌种一环划线接种于PDA斜面培养基,28 ℃恒温培养48 h。
种子培养:制备种子培养液,装液量为250 mL锥形瓶,每瓶50 mL,用6层纱布封口,121 ℃灭菌20 min,挑取斜面菌种两环接种于种子培养基中,于180 r/min的摇床中28 ℃恒温培养48 h。
发酵培养:配制发酵培养基,把50 mL发酵培养基装入250 mL锥形瓶中,用6层纱布封口,121 ℃灭菌20 min,按V(种子液)∶V(发酵液)=1∶20的接种量将培养好的种子液接种至发酵培养基中,180 r/min的摇床中28 ℃培养6 d。每组实验做3个平行对照。
1.3.2 生物量测定方法
取一定量发酵液于试管中,加入等体积浓度为1 mol/L的HCl溶液充分振荡除去CaCO3,4 000 r/min离心20 min,弃上清液,取沉淀,60 ℃烘干至恒重,称重,换算为质量浓度(单位为g/L)即为生物量。
1.3.3 聚苹果酸的测定方法[10-11]
色谱条件:Waters e2695 HPLC色谱系统,Hypersil ODS C18柱(4.6 mm×250 mm×5 μm),UV检测器(检测波长210 nm),流动相为V(乙腈)∶V(pH为2.5的0.025 mol/L KH2PO4缓冲溶液)=5∶95,柱温25 ℃,进样量10 μL。
样品测定:发酵液4 000 r/min离心20 min,取一定量上清液于试管中,加入等体积1 mol/L H2SO4溶液,90 ℃水浴水解9 h,取一定量水解液,根据需要进行稀释,稀释液用0.22 μm微孔滤膜过滤。取未经过水解的发酵液进行苹果酸质量浓度的测定,根据测定结果,两者之差为苹果酸质量浓度,苹果酸质量浓度乘以与聚苹果酸的换算系数即为聚苹果酸的质量浓度,即
CPMA=0.864×ΔC苹果酸
式中:0.864为苹果酸与聚苹果酸的换算系数,ΔC苹果酸为发酵液酸水解前后的苹果酸质量浓度差。
2 结果与讨论
2.1 碳源对聚苹果酸发酵的影响
菌株对不同碳源的利用能力不一样,为考察A.pullulansZUST-I13对不同碳源的利用能力,分别选用质量分数为12%的葡萄糖、蔗糖、木糖作为碳源进行实验,结果如图1所示。
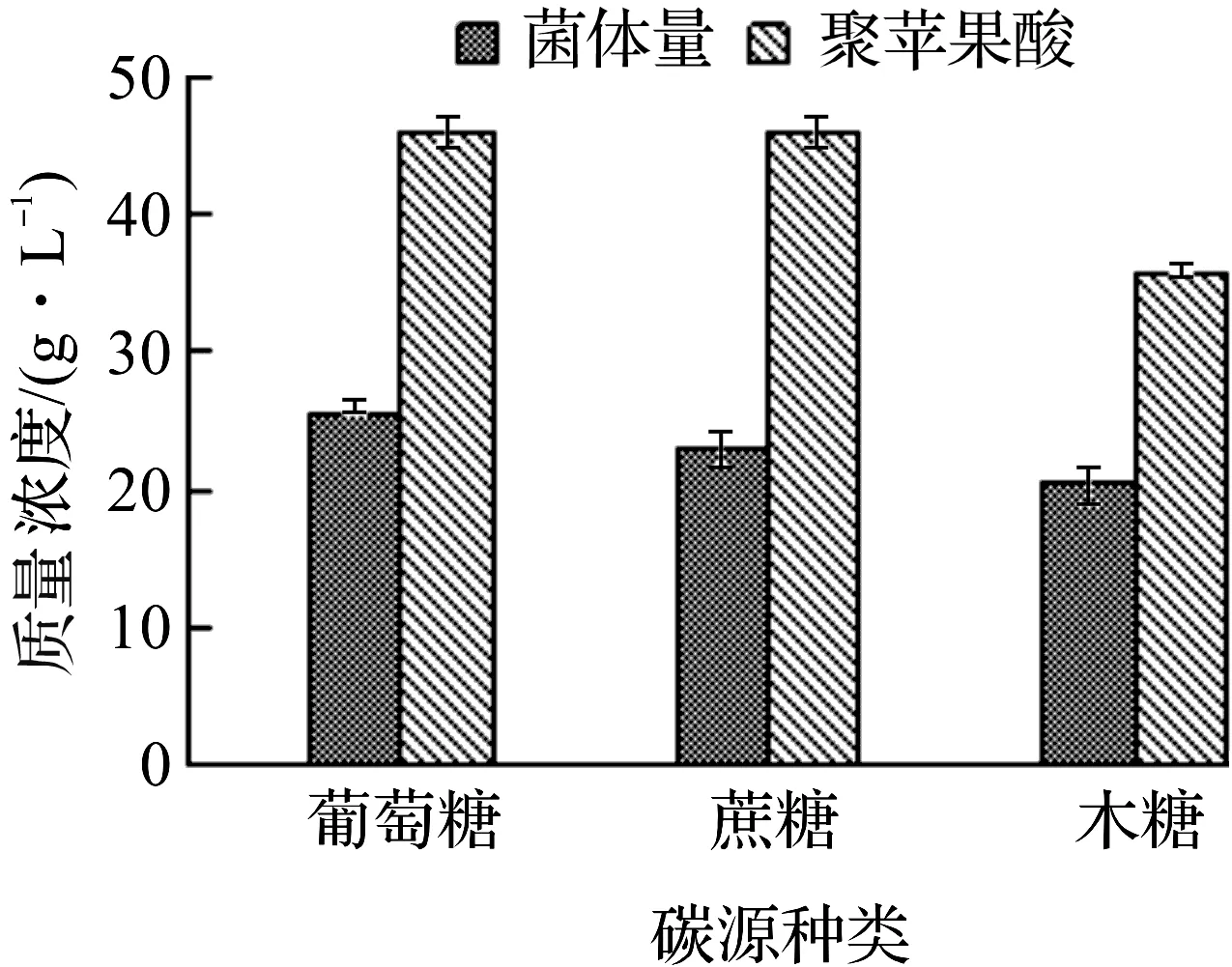
图1 不同碳源对聚苹果酸发酵的影响Fig.1 Effects of different carbon sources on PMA fermentation
由图1可知:葡萄糖作为碳源时聚苹果酸产量和菌体量都最高,分别达到48.08 g/L和23.22 g/L,蔗糖次之,木糖最低,这一结果与文献[2,7,9]报道一致。目前出芽短梗霉发酵生产聚苹果酸的碳源主要为葡萄糖和蔗糖。
2.2 氮源对聚苹果酸发酵的影响
氮源对微生物的生长以及代谢产物的合成有着非常重要的影响[12],为考察A.pullulansZUST-I13菌株对不同氮源的利用能力,分别选用质量分数为0.3%的硫酸铵、尿素、硝酸铵作为氮源进行实验,结果如图2所示。
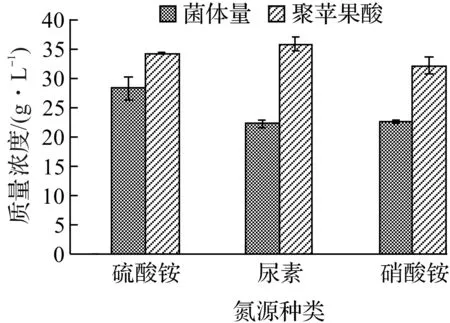
图2 氮源对聚苹果酸发酵的影响Fig.2 Effects of nitrogen sources on PMA fermentation
由图2可知:在所测试的3种氮源中,尿素作为氮源时聚苹果酸产量最高,为33.22 g/L,硫酸铵和硝酸铵则次之,但三者之间的产量差别不大。目前文献中报道的出芽短梗霉发酵产聚苹果酸的氮源主要有硝酸铵、硫酸铵、尿素、丁二酸铵等无机氮源[13-14],这些氮源均能较好地支持聚苹果酸的生产,说明出芽短梗霉菌株可能对氮源的选择性不强。
2.3 初始pH对聚苹果酸发酵的影响
调节发酵液的初始pH分别至3.0,4.0,5.0,6.0,7.0,8.0进行发酵实验,结果见图3。
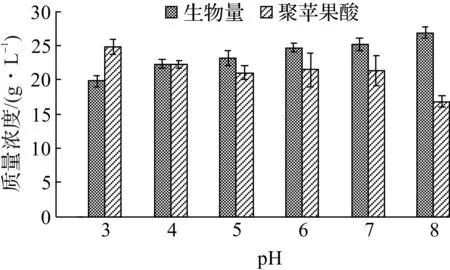
图3 培养基pH对聚苹果酸发酵的影响Fig.3 Effects of pH of the medium on PMA fermentation
由图3可知:出芽短梗霉在偏酸性环境下聚苹果酸产量较高,在pH为5~7时变化不大,在pH为3时最大产量达到24.79 g/L。偏碱性环境有利于出芽短梗霉生长,最终的菌体量也较高,在pH为8时达到26.83 g/L。对比已有文献[13,15]发现A.pullulansZUST-I13产聚苹果酸的最适pH更低一些,聚苹果酸的最大产量普遍为pH 4~6时。
2.4 培养温度对聚苹果酸发酵的影响
选择培养温度25,28 ℃进行发酵实验考察温度对聚苹果酸发酵的影响,结果如图4所示。
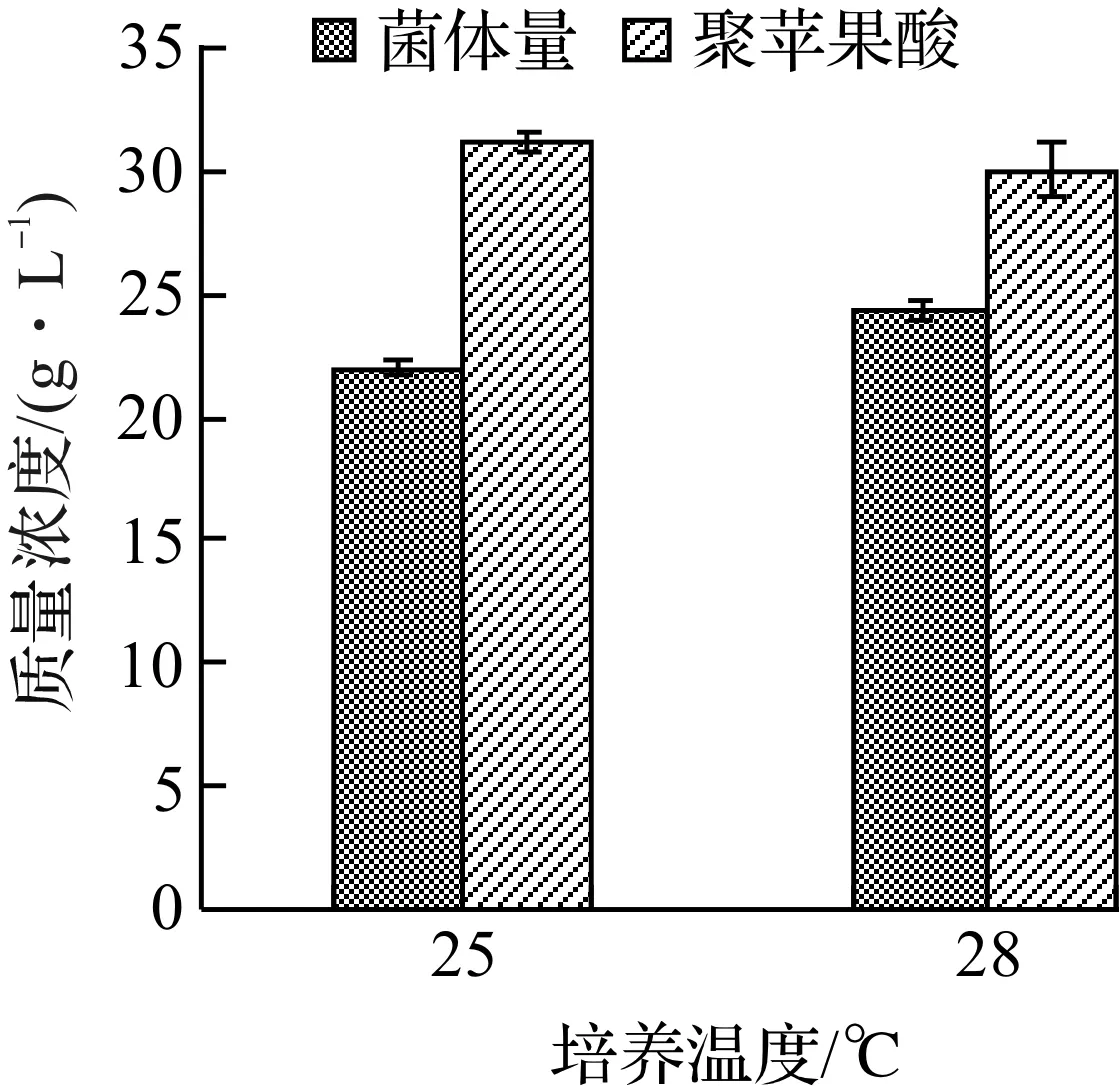
图4 培养温度对聚苹果酸发酵的影响Fig.4 Effects of culture temperature on PMA fermentation
由图4可知:25 ℃进行发酵时聚苹果酸产量较高,为32.43 g/L;28 ℃进行发酵时菌体量较高,达23.67 g/L。出芽短梗霉生长繁殖和产聚苹果酸的最适温度有所不同,与殷海松[9]、李睿颖[15]等的研究结果比较一致。根据这一特点,在进行聚苹果酸的生产时,可以考虑采用变温控制的方式,以获得较高的产量。
2.5 Zn2+对聚苹果酸发酵的影响
锌(Zn2+)对微生物的代谢活动起着重要的调节作用,一方面它作为酶的辅基影响多种催化酶的活性;另一方面,它在蛋白质中形成锌指结构参与基因表达的调控[16-17]。在培养基中分别加入0.05,0.1,0.15 g/L的ZnSO4·7H2O进行发酵实验,结果如图5所示。
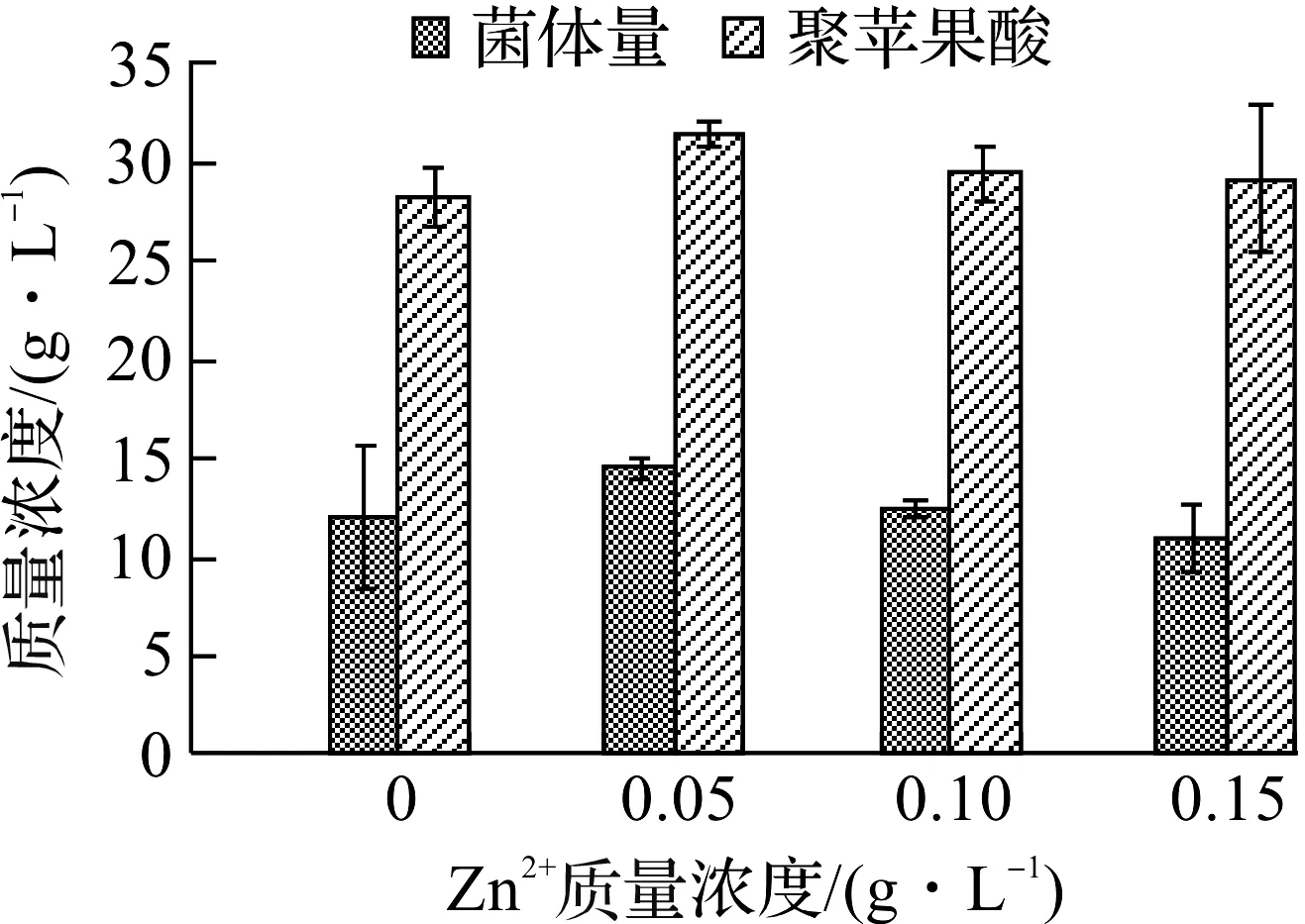
图5 Zn2+浓度对聚苹果酸发酵的影响Fig.5 Effects of Zn2+ concentration on PMA fermentation
由图5可知:Zn2+对出芽短梗霉产聚苹果酸有一定的促进作用,在Zn2+质量浓度为0.05 g/L时聚苹果酸产量最大,达31.37 g/L,Zn2+质量浓度大于0.05 g/L时聚苹果酸产量略有下降,但仍高于不添加Zn2+时的产量。目前,Zn2+对出芽短梗霉发酵产聚苹果酸的影响还未见报道,其促进聚苹果酸生产的机理尚有待进一步研究。
3 结 论
对影响出芽短梗霉菌株ZUST-I13发酵产聚苹果酸的常见培养基成分和培养条件进行了研究,结果表明:ZUST-I13菌株发酵产聚苹果酸最适合的碳源为葡萄糖,其次为蔗糖,木糖最差;在硫酸铵、尿素、硝酸铵3种氮源中最适氮源为尿素;酸性环境(初始pH 3~4)适宜出芽短梗霉发酵产聚苹果酸;发酵温度25 ℃适合聚苹果酸的生产,28 ℃适合菌体的生长;金属离子Zn2+对出芽短梗霉产聚苹果酸有一定的促进作用,在Zn2+质量浓度为0.05 g/L时聚苹果酸产量最大。以上研究结果可为出芽短梗霉菌株发酵产聚苹果酸的进一步优化提供基础。
