HPLC法检测艾叶中伞形花内酯含量
2020-04-15姚武,罗辉
姚 武,罗 辉
HPLC法检测艾叶中伞形花内酯含量
*姚 武1,*罗 辉2
(1. 黄山学院化学化工学院,安徽,黄山 245041;2. 井冈山大学医学部,江西,吉安 343009)
本实验首次运用HPLC方法分析了艾叶中伞形花内酯的含量。采用Agilent TC-C18色谱柱(250 mm×4.6 mm, 5 μm),甲醇-水-四氢呋喃(4:15:1)为流动相,流速为1.0 mL/min,检测波长为325 nm。实验结果显示,伞形花内酯在0.1~2.0 μg/mL浓度范围内与峰面积之间具有良好的线性关系,回归方程为A=74.3869-0.6815(= 0.9998),平均回收率为99.5%,RSD为1.06%。本法操作简便、高效、准确,可以为建立和完善中药材艾叶的质量标准提供了借鉴。
艾叶;伞形花内酯;高效液相色谱;检测
引言
艾叶()为菊科蒿属植物艾(et Vant)的干燥叶,夏季花未开时采摘,除去杂质,晒干即得,它是我国临床常用中药材之一[1]。艾叶性温,味辛、苦,有较好的散寒止痛、温经止血的作用[2]。现代药理研究也表明艾叶具有抗菌抗病毒、平喘镇咳祛痰、止血与抗凝血、抗过敏、镇静、免疫、护肝利胆及补体激活等作用[3]。
伞形花内酯又名伞形酮、7-羟基香豆素,属于酚类物质,能够与血清蛋白、酶等生物大分子结合,具有较强的抗菌、消炎、防止肝纤维化等功能[4-6],其广泛存在于多种中草药植物中[7-12]。根据有关研究报道,艾叶中也含有伞形花内酯成分[13]。
我国2015版药典一部,艾叶的含量测定项下,只规定了气相色谱法测定桉精油的含量,没有规定艾叶中伞形花内酯的含量质量指标。有关艾叶中伞形花内酯的含量分析也尚未见报道。HPLC法具有简便、快速、准确的特点,它是中药材成分含量分析的常用分析方法[14-15]。本文研究了HPLC法测定艾叶中伞形花内酯含量的方法,为建立和完善中药材艾叶的质量标准提供参考。
1 实验部分
1.1 实验药品与仪器
艾叶,采摘于安徽省屯溪地区,经黄山学院植物学张慧冲副教授鉴定。伞形花内酯标准品(≥ 98%),购于上海纯优生物科技有限公司。甲醇、冰醋酸、四氢呋喃等试剂均为分析纯,购于国药集团化学试剂有限公司。
UV-2550型紫外可见分光光度计,北京久盛康科技有限公司。Agilent 1260 型高效液相色谱仪,安捷伦科技有限公司。
1.2 色谱条件
色谱柱:Agilent TC-C18柱(250 mm×4.6 mm, 5 μm);流动相:甲醇-水-四氢呋喃(4:15:1),水-四氢呋喃用冰醋酸调pH = 2.70;柱温:室温;流速1.0 mL/min;进样量:20 μL;检测波长:325 nm。
1.3 溶液制备
精密称取伞形花内酯对照品5.0 mg,置50 mL烧杯中,加适量甲醇溶解,转移至50 mL棕色容量瓶中,定容,摇匀,得浓度为100 μg/mL对照品储备液,于冰箱中保存备用。对照品储备液用甲醇适当稀释后作为对照品溶液使用。
取适量艾叶,去除杆和茎,用粉碎机粉碎后过100目筛,在干燥箱中70 ℃烘10 h。称取2.0000 g艾叶粉末于磨口锥形瓶中,用25 mL移液管向其中加入50 mL甲醇,振荡,于55 ℃超声(频率45 kHz,功率100%)45 min,抽滤;滤液置于50 mL容量瓶中,用胶头滴管加甲醇至刻度,摇匀,再用0.45 μm(有机系)微孔滤膜过滤,得绿色澄清液体,得供试品溶液。
2 结果与讨论
2.1 检测波长的选择
将伞形花内酯对照品储备液稀释到适当浓度,在250~400 nm波长范围内做紫外扫描,结果如图1所示,在325 nm波长处有最大吸收,故选择325 nm作为HPLC紫外检测器的检测波长。
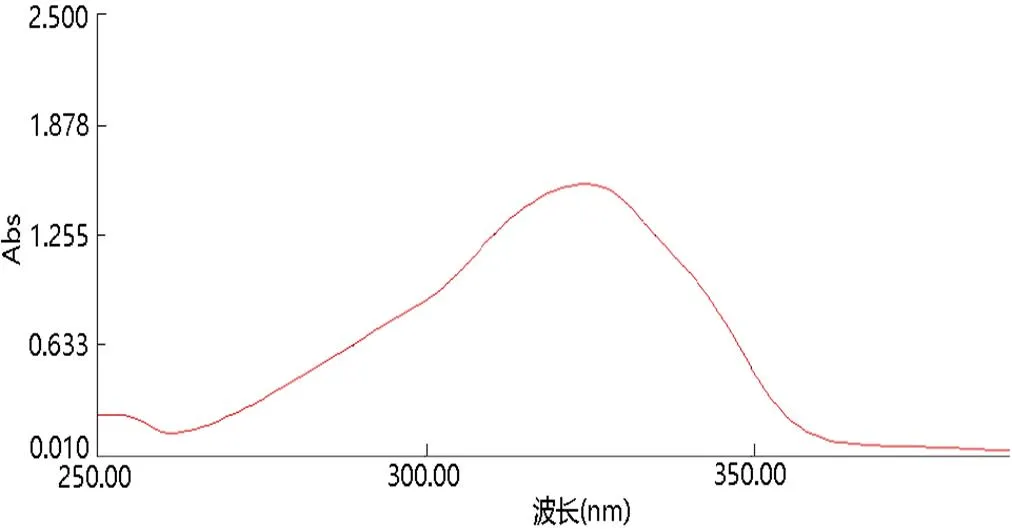
图1 伞形花内酯对照品溶液紫外扫描图
2.2 实验条件的优化
高效液相色谱实验中,流动相对分离起着极其重要的作用,流动相的选择是关键。本实验主要对流动相的pH值、组成配比和流速进行了优化。
2.2.1 流动相pH值的影响
固定流动相甲醇-水-四氢呋喃(4:15:1)的比例,用冰醋酸调节水-四氢呋喃的pH值为2.40、2.60、2.70、2.80、3.00、3.20,再加入甲醇配成流动相。进样量为20 μL,流速为1.0 mL/min。实验结果表明,pH值为2.70时分离效果好,保留时间适宜,信号强度较大。
2.2.2 流动相配比的影响
固定流动相中甲醇和水的组成,研究流动相中不同四氢呋喃的量对实验结果的影响。所选用流动相的组成分别为:(A)甲醇-水-四氢呋喃(4:15:0)、(B)甲醇-水-四氢呋喃(4:15:0.5),(C)甲醇-水-四氢呋喃(4:15:1),(D)甲醇-水-四氢呋喃(4:15:1.5)。pH值固定为2.70,进样量为20 μL,流速为1.0 mL/min。结果显示,使用A和B流动相时,伞形花内酯对照品保留时间较长,样品中伞形花内酯信号很弱。使用D流动相时,伞形花内酯信号较小,与其它成分的分离度较低。选用C流动相时,伞形花内酯信号较好,与其它成分的分离度也较高。固选用C流动相作为后续试验条件。
2.2.3 流动相流速的影响
固定流动相甲醇-水-四氢呋喃(4:15:1)的配比,pH值为2.70,进样量为20 μL,流速分别为0.80、1.00、1.20 mL/min。结果发现,当选用流速1.20 mL/min时则保留时间缩短,但信号不能很好地分离;当采用流速0.80 mL/min时,分离效果较好,但是信号强度比较小;而当选用流速1.00 mL/min时,保留时间较为合适,分离效果好,信号强度也较强。故选择1.00 mL/min的流速。
综上所述,由分离效果、保留时间、信号强度等方面综合分析,最佳实验条件为:流动相的组成为甲醇-水-四氢呋喃(4:15:1),pH值为2.70,流速为1.00 mL/min。伞形花内酯对照品溶液和艾叶供试品溶液的色谱图分别如图2(A)和图2(B)所示。
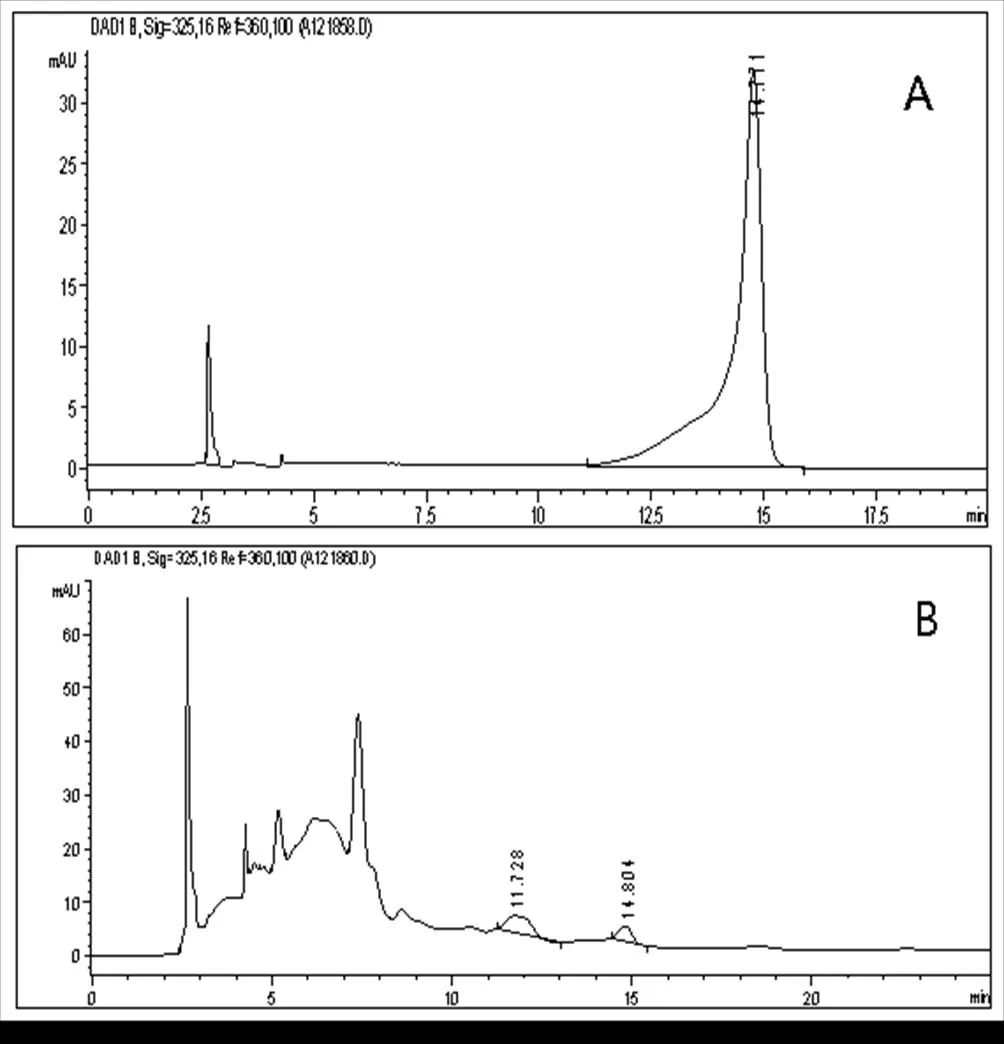
图2 伞形花内酯对照品溶液(A)和艾叶供试品溶液(B)的色谱图
2.3 线性关系
用对照品储备液配制得到浓度为10 μg/mL的对照品溶液,精密量取该对照品溶液0.1、0.3 、0.5、1.0 、1.5、2.0 mL置10 mL容量瓶中,加甲醇稀释至刻度,摇匀,按上述色谱条件进样20 μL。以峰面积对浓度进行回归分析,得线性回归方程= 74.3869-0.6815 (= 0.9998),伞形花内酯浓度在0.1~2.0 μg/mL范围内与峰面积呈良好的线性关系,如图3所示。

图3 伞形花内酯标准曲线
2.4 精密度实验
取上述1.0 μg/mL对照品溶液,按上述色谱条件重复进样5次,每次进样20 μL,测得伞形花内酯峰面积的RSD = 0.69%,精密度良好,如表1所示。
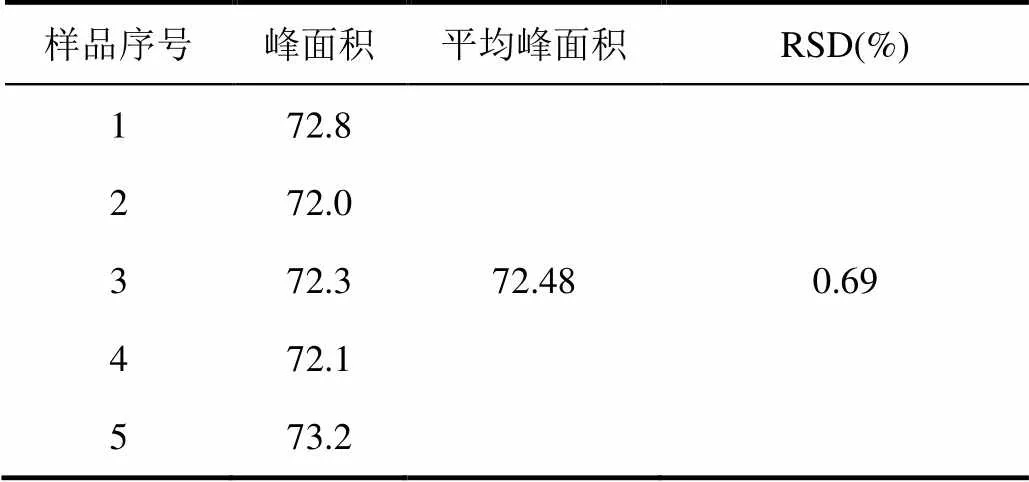
表1 伞形花内酯精密度实验
2.5 稳定性实验
在上述实验色谱条件下,1.0 μg/mL对照品溶液分别放置1、2、3、4、5 h进样,每次20 μL,测定峰面积,峰面积的RSD为0.95%,表明对照品溶液在5 h内稳定性良好。所得稳定性实验数据如表2所示。
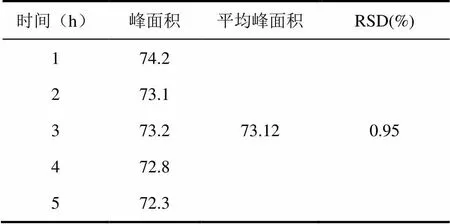
表2 伞形花内酯的稳定性实验
2.6 样品重复性实验和含量测定
分别称取3份2.0000 g已干燥艾叶粉末,按实验方法制备3份供试品溶液。在上述色谱条件下分别进样,每次20 μL,峰面积的RSD为1.65%,重复性良好,结果如表3所示。
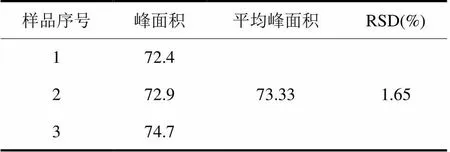
表3 样品溶液的重复性实验
将重复性实验中3个供试品溶液的平均峰面积代入线性回归方程,计算得供试品溶液中伞形花内酯的浓度C = 0.995 μg/mL,质量为49.75 μg,艾叶中伞形花内酯的含量为0.0025%。
2.7 加样回收实验
分别取上述2.3中供试品溶液5.0 mL于3个不同的10 mL容量瓶中,再分别向其中加入0.8、1.0、1.2 mL 5 μg/mL的对照品溶液,加甲醇稀释至刻度,摇匀后用0.45 μm(有机系)微孔滤膜过滤。按上述色谱条件进样,每次20 μL,按照样品含量测定方法测定伞形花内酯的平均加样回收率,结果如表4所示。
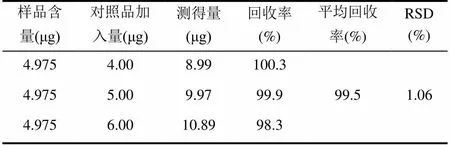
表4 加标回收率实验
平均加样回收率为99.5%,相对标准偏差为1.06%,由此可知分析方法可行,测量准确度高。
3 小结
本实验采用高效液相色谱法测定艾叶中伞形花内酯的含量,研究了不同流动相pH值、流动相组成、流动相流速等因素的影响。结果表明,此种方法具有较好的精密度、重现性和稳定性,可以用于艾叶中伞形花内酯的含量测定,为建立和完善药材用艾叶的质量标准提供了借鉴。
[1] 中华人民共和国国家药典委员会.《中华人民共和国药典(2015年版,一部)》[M].北京:中国医药科技出版社,2015:89.
[2] 《全国中草药汇编》编写组.《全国中草药汇编(上册)》[M]. 北京:人民卫生出版社,1976:27.
[3] 周倩,孙立立,石典花.艾叶的研究进展[C].中华中医药学会中药炮制分会2008学术研讨会论文集,2008:113.
[4] 白雪娜,卜春亚,谷继成,等.伞形花内酯对植物病原真菌的抑制作用[M].植物保护,2012,38(2) :42-45.
[5] Mahmoud A M, Hozayen W G, Hasan I H, et al. Umbelliferone ameliorates CCl4-induced liver fibrosis in rats by upregulating PPARγ and attenuating oxidative stress, inflammation, and TGF-β1/Smad3 signaling[J]. Inflammation, 2019, 42 (3): 1103-1116.
[6] Telange D R, Nirgulkar S B, Umekar M J, et al. Enhanced transdermal permeation and anti-inflammatory potential of phospholipids complex-loaded matrix film of umbelliferone: Formulation development, physico- chemical and functional characterization[J]. Eur J Pharm Sci. 2019, 131(4): 23-38.
[7] 廖昌能,潘勇.HPLC测定壮药马蹄金中伞形花内酯的含量[J].中国实验方剂学杂志,2013,19(5):149-151.
[8] 刘丽霞,赵挺,孙立新.HPLC法测定中药了哥王中伞形花内酯的含量[J].沈阳药科大学学报,2010, 27(7): 563-566.
[9] 张金莲,罗雪晴,颜冬梅,等.HPLC法同时测定枳壳中伞形花内酯等9种成分的量[J].中草药,2018,49(14): 3406-3410.
[10] 黄思敏,谢仕伟,彭维,等.东风桔中伞形花内酯的含量测定[J].中药材,2007,30(4): 421-422.
[11] 王伟宇,耿成怀,田慧秀,等.夏枯草中活性成分的毛细管区带电泳-电化学检测[J].药物分析杂志,2008,28(9): 1437-1441.
[12] 苏微微,赵洁,林敬明.高效液相色谱法测定水母雪莲中东茛菪内酯、伞形花内酯的含量[J].第一军医大学学报,2005,25(1): 119-120.
[13] 吉双,卢桂荣,孟大利,等.艾叶的化学成分(Ⅱ)[J].沈阳药科大学学报,2010,27(7):548.
[14] 王博龙,张军雷,邹盛勤. RP-HPLC-PDAD法测定青叶胆中齐墩果酸和熊果酸的含量[J].井冈山大学学报:自然科学版,2018,39(3):84-87.
[15] 宋玉鹏,陈海芳,谭舒舒,等. 不同采收期江枳壳中柚皮素和橙皮素HPLC含量测定[J].井冈山大学学报:自然科学版,2017,38(1):83-87.
DETERMINATION OF UMBELLIFERONE INHPLC
*YAO Wu1,*LUO Hui2
(1. School of Chemistry and Chemical Engineering, Huangshan University, Huangshan, Anhui 245041, China; 2. Health Science Center, Jinggangshan University, Ji’an, Jiangxi 343009, China)
In this paper, the content of umbelliferone in folium artemisiae argyi was firstly detected by HPLC method. Agilent TC-C18 column (250 mm×4.6 mm, 5 μm) was used with a methanol-water-tetrahydrofuran (4:15:1) solution as the mobile phase at a flow rate of 1.0 mL/min. The UV detection wavelength was 325 nm. The concentration of umbelliferone showed good linear relationship with the peak area in the range of 0.1~2.0 μg/mL. The regression equation was A=74.3869-0.6815 (= 0.9998). The average recovery rate was 99.5% (RSD = 1.06%). This method is simple, rapid and accurate, and provides a reference for the establishment and improvement of the quality standard of folium artemisiae argyi.
; umbelliferone; HPLC; determination
1674-8085(2020)01-0021-04
O657.7
A
10.3969/j.issn.1674-8085.2020.01.005
2019-12-12;
2019-12-26
国家自然科学基金项目(31460488);安徽省自然科学基金面上项目(11040606M41);安徽省高校自然科学重点研究项目(KJ2016A683)
*姚 武(1968-),男,安徽屯溪人,教授,主要从事药物化学分析研究(Email:yaowu92@163.com);
*罗 辉(1971-),男,江西吉水人,副教授,硕士,主要从事生物化学教学科研(E-mail: luohui9898@163.com).
