O2血清型肺炎克雷伯氏菌多糖结合疫苗的生物合成
2020-04-15张璐璐潘超冯尔玲华孝挺俞云松王恒樑朱力
张璐璐,潘超,冯尔玲,华孝挺,俞云松,王恒樑,朱力
1 军事科学院军事医学研究院 生物工程研究所,北京 100071
2 浙江大学医学院附属邵逸夫医院 浙江省微生物技术与生物信息研究重点实验室,浙江 杭州 310016
肺炎克雷伯氏菌 (Klebsiella pneumonia,Kp)是一种普遍存在于环境中、人和动物皮肤表面和黏膜上的革兰氏阴性菌。它是条件致病菌,可引起肺炎、眼内炎、肝脓肿以及菌血症等疾病,容易感染幼儿以及年老体弱者,已成为目前医院和社区获得性感染的最主要致病因素之一[1]。Kp常常具有耐药性,为其治疗带来了巨大的困难。近年来报道的能够产生超广谱β-内酰胺酶(Extended-spectrum β-lactamase,ESBL) 的Kp病例逐渐增加,临床上几乎面临无药可用的局面。另外,高毒力Kp的出现,使得健康的成年人也极易感染该病原菌;而且由于耐药菌和高毒力菌株越来越具有交叉和重叠的趋势[2],迫切需要研制出一种能够有效预防其感染的疫苗。
Kp的胞外多糖包括荚膜多糖和O特异多糖。荚膜多糖有77种[3],其中K1血清型流行性较高,有研究者曾制备过荚膜多糖疫苗[4],该疫苗虽能够刺激机体产生较高的IgG抗体效价,但由于生产工艺复杂,难以进一步扩大生产。而KpO特异多糖只有8种,其中O1和O2血清型是主要流行型[5],因此制备O抗原多糖疫苗比荚膜疫苗更具备可行性。目前大部分针对KpO多糖结合疫苗的研究主要集中在化学交联法制备的疫苗上[6],其免疫原性强,能够增强细胞吞噬作用,但缺点是过程繁琐、成本高昂并且产品质控困难。
同化学交联法相比,多糖结合疫苗的生物法制备是在构建工程菌株的基础上,利用细菌在周间质酶促合成糖蛋白,省去了对多糖和底物蛋白的多次纯化,因此降低了生产成本,更有利于产品质控,并且不存在复杂的环保排放问题。据报道已有研究者利用生物法成功制备了KpK1/K2型荚膜多糖结合疫苗[7]。
相对于荚膜多糖结合疫苗,KpO血清型种类少,因此制备O血清型疫苗更具有经济性。本文以临床分离株Kp355为研究对象,通过生物法制备多糖结合疫苗。Kp355由浙江大学医学院附属邵逸夫医院馈赠,经验证其血清型为O2型。Kp355waaL基因编码O抗原连接酶,能够将自身的O多糖转移到核心寡糖上形成脂多糖LPS,敲除该基因后细菌无法合成完整的脂多糖,毒力明显降低且周间质中出现大量游离的O多糖。脑膜炎耐瑟氏菌编码的糖基转移酶PglL具有非常宽松的底物特异性,可以识别并催化O多糖转移到含29个糖化位点的重组霍乱毒素B亚单位 (rCTB) 上。将具有上述两种蛋白 (PglL和rCTB) 编码基因的糖基工程载体导入构建的Kp355waaL缺失株(Kp355△waaL) 中后,PglL可催化游离的O多糖转移到rCTB上,从而能够在突变株细菌周间质中合成带有Kp355 O抗原结构的糖蛋白(C-OPSKp)。这种多糖蛋白缀合物有望成为新型多糖结合疫苗。
1 材料与方法
1.1 实验材料
1.1.1 菌株与实验动物
Kp355由浙江大学医学院附属邵逸夫医院分离并保存,大肠杆菌Escherichia coliDH5α感受态购自江苏康为世纪生物科技有限公司;SPF级BALB/c小鼠,5–6周龄,雌性,购自斯贝福 (北京) 生物技术有限公司。
1.1.2 质粒与试剂
糖基工程载体pET28a-PglL-CTB以及质粒pET28a-CTB、pKOBEG、pET-Kan、pCP20等均为军事医学研究院生物工程研究所保存。质粒提取试剂盒、胶回收与PCR产物回收试剂盒均购自江苏康为世纪生物科技有限公司。蛋白亲和纯化树脂购自罗氏公司。Superdex200分子排阻色谱树脂购自GE公司。引物由北京天一辉远公司合成。
1.2 实验方法
1.2.1 Kp355 O抗原连接酶基因waaL的敲除
利用λ-Red重组系统[8]敲除Kp355waaL基因。根据Kp355waaL基因及其上下游序列,设计构建基因打靶片段所需引物,具体引物名称及序列见表1。其中引物waaL-up-F、waaL-up-R扩增waaL基因上游同源臂,waaL-dw-F、waaL-dw-R扩增下游同源臂;同时为了验证突变体构建是否成功,设计了基因组上waaL基因上下游同源臂以外的一对引物waaL-out-F和waaL-out-R,内部检测引物waaL-in-F和waaL-in-R。将上下游同源臂通过酶切连接的方式,分步连接到载体pET-Kan上;之后以含有靶基因上下游同源臂的载体pET-Kan为模板,利用引物waaL-up-F和waaL-dw-R扩增waaL基因打靶片段,将扩增产物进行回收得到打靶片段。

表1 基因敲除引物Table 1 Primers for gene-knockout experiments
通过电击转化将质粒pKOBEG导入Kp355中,其中pKOBEG编码合成3种与同源重组相关的酶Exo、Beta、Gam;在打靶片段存在下,可以将宿主基因组上的目的基因片段置换下来从而实现基因的敲除。将含有该质粒的Kp355阳性克隆在试管中转接两代后再接种至50 mL低盐LB培养基中,置于30 ℃摇床培养,在细菌培养到600 nm紫外吸收峰 (OD600) 为0.5前的1 h加入终浓度为1 mmol/L的阿拉伯糖;1 h后将菌液置于冰上30 min,之后8 000 r/min离心8 min收菌,并用预冷的10%甘油洗3次制备Kp355/pKOBEG感受态细胞,最后电转打靶片段到制备好的Kp355/pKOBEG感受态中,30 ℃复苏1–2 h后涂布于卡那霉素终浓度为50 μg/mL的抗性平板,次日利用内外部引物进行PCR筛选阳性克隆。由于筛选到的重组菌株含有Kan筛选基因及两侧的FRT位点,因此将其培养于42 ℃摇床并转接3代去除pKOBEG后,再导入另一温敏质粒pCP20,pCP20编码Flp重组酶可诱导两侧FRT位点重组从而去除Kan片段,最终得到不含筛选标记的缺失株Kp355△waaL。对野生株Kp355以及缺失株Kp355△waaL进行表型鉴定,即通过银染观察敲除前后细菌LPS结构的差异,并用梅里埃API 50 CH 试剂条检测糖代谢差异。
1.2.2 底物蛋白rCTB的表达及其糖基化水平的检测
将Kp355以及Kp355△waaL制成感受态,均导入实验室保存的糖基工程质粒pET28a-PglL-CTB以及对照质粒pET28a-CTB,加入液体LB培养基在37 ℃摇床复苏1–2 h,涂布到抗性平板上,37 ℃温箱培养过夜。第2天挑选PCR验证正确的阳性单克隆,将其在试管中转接两代;第2代37 ℃摇床培养到对数生长期后,加入终浓度为1 mmol/L的异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-Dthiogalactopyranoside,IPTG)诱导剂,置于30 ℃摇床过夜诱导目的蛋白表达。第2天将每组样品各取1 mL,13 000 r/min离心1 min,弃上清收集菌体沉淀,加入100 μL蒸馏水重悬菌体,再加入等体积的2×SDS上样缓冲液,沸水浴10 min后进行SDS-PAGE;待电泳结束后用半干转印仪将胶上的蛋白转至PVDF膜上,15 V恒压转印65 min,用鼠源HRP-Anti-His tag 单克隆抗体检测不同菌株中底物蛋白的表达情况。
1.2.3 Kp355 C-OPSKp的纯化与糖定量
将携带糖基工程载体pET28a-PglL-CTB的Kp355△waaL,以1︰100的比例接种于2 L三角瓶中,37 ℃摇床培养至对数生长期后加入终浓度为1 mmol/L的IPTG诱导剂,30 ℃诱导表达过夜。第2天8 000 r/min离心8 min收集菌体沉淀,以溶液A1 (0.5 mol/L NaCl,10 mmol/L咪唑,20 mmol/L Tris-HCl,pH 7.5) 重悬菌体后,经过匀浆机充分破碎直至菌悬液澄清,离心取上清;将上清通过A1平衡过的镍离子亲和层析柱,之后洗脱非特异性结合的杂蛋白,用高浓度咪唑溶液B1 (0.5 mol/L NaCl,500 mmol/L咪唑,20 mmol/L Tris-HCl,pH 7.5) 洗脱目的蛋白;将得到的样品浓缩后经过凝胶过滤层析 (Superdex200分子排阻色谱树脂) 进一步纯化,根据蛋白质在280 nm处吸收值的变化收集样品,样品经SDS-PAGE后用考马斯亮蓝染色和蛋白免疫印迹检测蛋白表达情况,蒽酮浓硫酸法检测其糖含量。
1.2.4 候选疫苗的实验动物免疫评价
将Kp355培养至OD600为2.0时的菌液进行梯度稀释涂布,计算每毫升菌液所含有的菌落形成单位 (Colony forming unit,CFU)。根据Kp355OD600为2.0时的菌液浓度,预先设置3个梯度,即分别以106CFU/只、107CFU/只、108CFU/只的菌量腹腔注射小鼠,每组5只;再根据攻毒后小鼠一周的存活率,将致死剂量的范围进一步缩小:每组设置10只,每组的活菌注射量相差不超过0.5×107CFU,攻毒后观察小鼠一周存活情况,确定小鼠攻毒实验的半数致死剂量 (LD50)。
将5–6周龄雌性BALB/c随机分为5组,每组8只,分别是PBS组、糖蛋白组、糖蛋白+铝佐剂(Al(OH)3) 组、糖蛋白+角鲨烯 (Squalene) 组以及糖蛋白+Poly(I:C)[9]组。每只小鼠按照2.5 μg多糖含量分别于第0、14、28天进行腹腔免疫,第3次免疫后10 d断尾取血,分离血清;以Kp355 LPS为抗原包被酶标板,间接ELISA法测定血清抗体效价,三免后第14天进行腹腔攻毒,观察各组小鼠存活率。通过测定的抗体效价以及存活曲线,评价该糖蛋白疫苗的保护效果以及不同佐剂之间保护效果的差异。
1.2.5 数据处理与分析
间接ELISA法测定小鼠血清抗体效价时,以阴性血清值的2.1倍为阳性标准判断;两组比较采用t检验,以P<0.05认为有统计学意义。
2 结果与分析
2.1 Kp355 O抗原连接酶基因waaL的缺失
通过λ-Red重组技术敲除了Kp355waaL基因,缺失株PCR验证结果如图1A所示,用内部引物PCR扩增后,缺失株结果为阴性,而野生株为阳性;外部引物扩增后缺失株和野生株产物的条带大小均符合理论值1.4 kb和2.2 kb,并且外部引物扩增产物测序结果与理论序列结果一致;khe引物为验证Kp种属特征性引物[10],以排除杂菌污染。结果表明我们在基因层面成功敲除了waaL基因,得到缺失株Kp355△waaL。之后将蛋白酶K消化后的野生株和缺失株全菌蛋白样品经SDS-PAGE分离后进行银染,结果如图1B所示,由于野生株LPS O侧链重复单位的数量并不相同,因此呈现分子量差异相对固定的典型梯状LPS条带[5],而缺失株由于waaL基因缺失糖链无法转移到脂质A核心,因此无LPS典型条带。接着,又对Kp355和Kp355△waaL的生长状态和生理生化特性进行了探究。结果如图1C所示,两株菌生长曲线无明显差异,通过参考API 50CH试验条成分 (表2) 发现其糖代谢能力除D-塔格糖以及2-酮基-葡萄糖酸盐代谢有略微差异外,其他种类糖代谢未见明显差异 (图1D),表明waaL基因的缺失对菌株的生长和代谢无明显影响。

图1 Kp355 waaL基因缺失株的构建及鉴定Fig.1 The construction of Kp355 waaL gene deletion mutants.(A) Identification of Kp355 waaL gene deletion by PCR.(B) Silver staining of Kp355 wild type and waaL mutant.(C) Growth curves of Kp355 wild type and waaL mutant strain.(D) Carbohydrate metabolism tests of Kp355 wild type and waaL mutant strain using API 50 CH kits.

表2 API 50CH试验条成分Table 2 Components of API® 50 CH kit
2.2 底物蛋白rCTB的表达及其糖基化水平的检测
在Kp355和Kp355△waaL中均导入质粒pET28a-PglL-CTB以及pET28a-CTB后,将其全菌蛋白样品经过SDS-PAGE分离后,通过蛋白免疫印迹 (Western blotting,WB) 检测rCTB的表达,其中质粒pET28a-PglL-CTB表达的PglL和rCTB分别定位于细菌内膜上和周间质中。结果如图2所示,在Kp355△waaL中共表达PglL和底物蛋白rCTB时,细菌本身游离的O-抗原多糖在糖基转移酶PglL催化下转移到载体蛋白rCTB上,因此WB条带上呈现了底物蛋白条带向高分子量区域迁移的现象;同时,由于细菌多糖为串联重复单位,因此呈现出典型的梯状条带,表明蛋白与细菌多糖成功偶联,得到了带有Kp355 O多糖的糖蛋白 (C-OPSKp);而对照组在无PglL的情况下只有底物蛋白的表达。

图2 rCTB蛋白糖基化鉴定Fig.2 Identification of glycosylated rCTB.
2.3 Kp355 C-OPSKp的纯化
通过对表达Kp355 O抗原糖蛋白工程菌的大量培养和发酵纯化,得到了纯度较高的糖蛋白。由于底物蛋白rCTB带有6个组氨酸标签,通过镍柱亲和层析进行第一步纯化,可用低浓度咪唑溶液A1洗脱杂蛋白,高浓度咪唑溶液B1洗脱目的蛋白;再根据目的蛋白与杂蛋白分子大小的差异将样品通过凝胶过滤层析进一步纯化,以尽可能地除去杂蛋白。图3A为将样品注射入分子排阻色谱柱后,OD280值随流经色谱柱缓冲液体积的变化,箭头所示为样品收集峰,约为上样后80 mL处。通过考马斯亮蓝染色检测糖蛋白样品 (图3B) 可以看出,纯化得到的C-OPSKp糖蛋白纯度较高,样品中几乎没有杂蛋白,说明镍柱亲和层析以及凝胶过滤层析两步足以去掉绝大多数杂蛋白。经计算每升LB培养基得到的糖蛋白中糖含量约为120 μg左右。
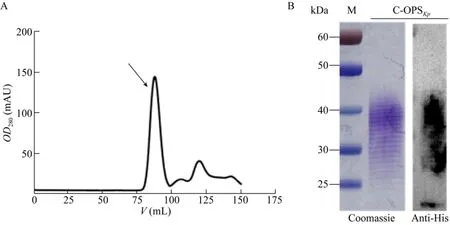
图3 糖蛋白C-OPSKp的纯化Fig.3 Purification of glycoprotein C-OPSKp.(A) The optical density at 280 nm changes with PBS elution after sample injection.The arrow points to the appearance peak of C-OPSKp.(B) Detection of the purified glycoprotein by commassie stain and Western blotting.
2.4 Kp355 LD50测定与疫苗保护效果评价
将Kp355培养至OD600为2.0时,对其进行计数,经计算每毫升菌液约含有1×109CFU。通过观察不同活菌剂量组小鼠一周存活率的变化,得出其LD50为2.0×107CFU。
随后,我们通过糖蛋白疫苗刺激小鼠产生的抗体效价、抗体亚型效价以及攻毒后不同佐剂组小鼠一周存活率的差异,来探究该疫苗的保护效果[11]。如图4A–E所示,各组小鼠血清抗体效价以10为底做对数变换后的结果为纵坐标,横坐标为不同试验组以及PBS组,试验组的总体IgG抗体效价均与PBS组差异明显,无佐剂组、角鲨烯佐剂组以及Poly(I:C) 佐剂组的抗体效价均高于铝佐剂组;按照上述Kp355两倍半数致死剂量腹腔攻击小鼠,结果如图4F所示,同总体IgG抗体效价测定结果一致,无佐剂组、角鲨烯佐剂组以及Poly(I:C) 佐剂组小鼠的存活率均可达75%,与PBS组差异明显,表明本研究制备的糖蛋白疫苗能够保护小鼠免于Kp355致死剂量的攻击。

图4 C-OPSKp的保护效果Fig.4 Protective effect of C-OPSKp.Serum anti-LPS IgG (A),IgG1 (B),IgG3 (C),IgG2a (D),IgG2b (E) antibody titers were detected by ELISA.(F) Survival rate of different groups in one week after injection with Kp355 lethal dose at 4.0×107 CFU.*:P<0.05;**:P<0.01;***:P<0.001;****:P<0.000 1.
3 讨论
来自脑膜炎奈瑟球菌的糖基转移酶PglL具有非常宽松的底物特异性[12],能够催化多种糖单位转移到底物蛋白的丝氨酸、苏氨酸残基上,使底物蛋白发生O糖基化修饰。本研究所用糖基工程载体编码合成的糖基转移酶PglL可在细菌周间质将多糖转移到底物蛋白上,目前已实现在多个菌种的底物蛋白糖基化,如志贺菌、鲍曼不动杆菌以及霍乱弧菌等。在本研究中,该载体在Kp waaL缺失株中也能将细菌Kp的O多糖转移到底物蛋白上,说明PglL也能够识别此类型的O糖结构,拓展了O-连接多糖体系的应用。
本研究制备的KpO2血清型糖蛋白能够刺激小鼠产生较高的抗体效价、保护75%的小鼠免于致死剂量的攻击,且配伍不同佐剂糖蛋白疫苗组的抗体亚型效价之间存在一定的差异。聚肌苷酸Poly(I:C)是一种双链RNA、干扰素诱导剂,能够激活TLR3,可在抵抗病毒感染中发挥重要作用,其主要介导粘膜免疫;配伍角鲨烯佐剂糖蛋白疫苗组小鼠产生的IgG1抗体效价高达1︰10 000,与其他试验组差异明显 (P<0.05),并且IgG3和IgG2b的抗体效价均不低于1︰1 000。
根据相关流行病学调查研究,KpO1和O2属于主要流行株,其中O2血清型多糖由于其较低的免疫原性不能有效激发机体的免疫反应[13],感染后难以被人体免疫系统清除,因此最近流行性呈上升趋势,而单独的多糖制备的疫苗由于这种较低的免疫原性,无法作为有效的疫苗产品。本研究制备的Kp多糖结合疫苗携带的多糖属于O2型,通过简单的糖基转移反应,一步将多糖连在载体蛋白rCTB上,成功制备多糖结合疫苗。此候选疫苗能够刺激小鼠产生较高的抗体效价,并且攻毒后试验组小鼠具有较高的存活率,能够保护小鼠免于Kp355致死剂量的攻击,有望成为针对肺炎克雷伯氏菌的新型候选疫苗,对预防医院和社区获得性感染具有重要的意义[14]。
另有研究表明KpO1血清型抗体的被动免疫能够保护小鼠免受致死剂量的攻击[15]。已有研究表明通过将O2多糖基因簇与Kp的wbbY和wbbZ基因共表达可得到O1多糖,因此理论上我们的技术可以进一步制备O1血清型多糖结合疫苗,从而实现针对Kp不同血清型更为广泛的保护。
