葡萄糖氧化酶在枯草芽孢杆菌芽孢表面的展示及其酶电极制备
2020-04-15林平宋龙祥常德军马耀宏王腾飞
林平,宋龙祥,常德军,马耀宏,王腾飞
1 齐鲁工业大学 (山东省科学院) 生物基材料与绿色造纸国家重点实验室,山东 济南 250353
2 齐鲁工业大学 (山东省科学院) 山东省微生物工程重点实验室,山东 济南 250353
3 齐鲁工业大学 (山东省科学院) 生物研究所山东省生物传感器重点实验室,山东 济南 250103
葡萄糖-1-氧化酶 (Glucose oxidase,GOD)(β-D-葡萄糖氧化还原酶,EC 1.1.3.4) 是一种重要的糖蛋白,由2个相同的80 kDa亚基和2个黄素腺嘌呤二核苷酸 (FAD) 辅酶组成。在有氧条件下,能够以分子氧为电子受体,将葡萄糖氧化为葡萄糖酸和过氧化氢。GOD主要生产菌株为黑曲霉和青霉,由于其氧化能力,显示出较高的酶稳定性,因此与其他酶相比,GOD在酶电极中起着主导作用[1-2]。但是,在电极的固定化过程中需要酶的纯化,这增加了成本,并且已成为固定化酶电极开发领域的瓶颈[3]。另外,常规的物理或化学固定方法经常导致酶活性损失、酶泄漏和传质阻抗[4]。
近几年,随着微生物表面展示技术的不断发展,实现了微生物表面展示酶与酶电化学生物传感器的结合。在传感器的发展中,纯度较高的商品酶应用较多,但由于其制备和提取工艺极其繁琐,使得酶的成本增加,这也就限制了商品酶生物传感器的使用范围。通过微生物表面展示技术,将外源蛋白展示在微生物表面,有利于提高酶的热稳定性和pH耐受性[5-8]。相比于商品酶,展示在微生物表面的酶不需要复杂的制备工艺,容易获取,节约成本。因此,微生物表面展示技术与酶电化学生物传感器的结合是一种必然趋势。随着完成枯草芽孢杆菌Bacillus subtilis基因组的测序工作,B.subtilis芽孢表面已成功展示了多种外源蛋白,并因该菌株为安全菌株,无内毒素,在许多生产领域备受认可,如食品与医药、水质净化、饲料生产等领域[9-11]。构建B.subtilis芽孢表面表达体系时,以芽孢衣壳蛋白为锚定蛋白,将外源蛋白融合展示在芽孢表面,因为芽孢是在细菌细胞质中合成的,所以外源蛋白的表达都不需要穿过任何膜,并且芽孢能抵抗恶劣的环境条件,有利于提高外源蛋白质在复杂环境中的使用稳定性[12-14]。发酵得到的重组芽孢可以直接用于电极修饰,避免因细胞破碎、杂质分离造成的成本增加。
氧化石墨烯 (Graphene oxide,GO) 是石墨烯的氧化物,其片层上有大量的羟基和羧基活性基团[15],含氧官能团隔开了石墨烯共轭自由基团,使氧化石墨烯具有良好的亲水性和机械性能[16],而且为固定生物分子提供表面修饰活性位置和较大的比表面积,在电化学传感器中还起到了信号放大的作用[17]。普鲁士蓝 (Prussian blue,PB) 在低电位下可以迅速催化还原H2O2,因此,又被称为“人工过氧化物酶”[18-19]。同时使用GO材料和PB电子媒介体构建葡萄糖酶生物传感器,有利于增强生物传感器的灵敏度,这是因为GOD催化葡萄糖产生的H2O2能接着被PB还原[19-20]。聚四氟乙烯 (Nafion) 能将酶包埋在聚合物材料的网格或微胶囊结构中,防止酶的渗漏,而对应的底物可以通过网格与Nafion内部包埋的酶接触使催化反应正常进行,这样几乎不改变活性物质的高级结构,因而不破坏酶的生物活性[21]。
本研究以枯草芽孢杆菌为宿主菌,构建了芽孢展示GOD的重组菌,利用GO材料、PB电子媒介体构筑了一种新型葡萄糖电化学生物传感器。通过Western blotting、免疫荧光分析以及酶活检测等手段证明GOD成功在芽孢表面展示并有效表达,同时还研究了所制备的基于芽孢表面展示GOD构筑的葡萄糖电化学生物传感器的各种影响因素、传感器的检测方法以及性能参数。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
pDG1730质粒 (含amyE基因上下游同源臂)购自山东沃森生物科技有限公司。pET28a-god质粒实验室保存。感受态细胞大肠杆菌Escherichia coliDH5α购自南京诺唯赞生物科技有限公司。B.subtilisWB800n为实验室保存菌株,为cotX基因的来源菌株,也是外源蛋白的表达宿主菌。
1.1.2 培养基与实验试剂
SanPrep柱式DNA胶回收试剂盒、DNA纯化回收试剂盒、细菌基因组抽提试剂盒、质粒提取试剂盒购于生工生物工程 (上海) 股份有限公司。限制性核酸内切酶BamHⅠ和HindⅢ、2×Phanta Max Master Mix等工具酶购自赛默飞公司。无缝克隆试剂盒、核酸分子量Marker(DL5000)、蛋白分子量Marker购自南京诺唯赞生物科技有限公司。BSA、山羊血清、BCA蛋白浓度测定试剂盒、FITC-羊抗兔IgG、辣根酶标记山羊抗兔IgG购自博士德生物工程有限公司。Anti-GODZ antibody购自英国Abcam公司。5 wt%Nafion购自Sigma-Aldrich公司。氧化石墨烯 (GO)购自南京吉仓纳米科技有限公司。D-(+)-葡萄糖购买于国药集团化学试剂有限公司。0.1 mol/L PBS(pH 7.0) 实验室自制。
LB (Luria-Bertani medium) 培养基(W/V):1%NaCl、0.5%酵母浸粉、1%蛋白胨;LB固体培养基在液体培养基中加入1.5%–2%琼脂粉即可;LB淀粉培养基在LB培养基中添加1%淀粉即可,用于检测淀粉酶酶活。
DSM (Difico sporulation medium):0.8% (W/V)营养肉汤,0.1% KCl,0.025% MgSO4·7H2O,1 mmol/L Ca(NO3)2,0.01 mmol/L MnCl2,0.01 mmol/L FeSO4。
普鲁士蓝沉积液配制方法:用二次蒸馏水配制2.5 mmol/L K3[Fe(CN)6]溶液,记为A液;2.5 mmol/L FeCl3,0.1 mol/L KCl,0.2 mol/L HCl溶液,记为B液;以及0.1 mol/L EDTA-Na2溶液,记为C液。使用时4.5 mL的A液、4.5 mL的B液和1 mL的C液混合。
1.1.3 主要仪器
DNA扩增仪 (美国ABI);水平电泳槽、蛋白质电泳仪 (北京六一仪器厂);湿式转印槽 (北京君意);超声波破碎仪 (新芝生物科技股份有限公司);高速冷冻离心机 (Eppendorf);生物电泳凝胶成像分析系统 (北京赛智创业科技有限公司);激光共聚焦显微镜 (德国Leica) 等。电化学测量法是在CHI760D电化学分析仪 (中国上海辰华仪器公司) 完成的。台式扫描电子显微镜;高速冷冻离心机 (Eppendorf);电子分析天平;KQ3200DE型数控超声波清洗器。
1.2 方法
1.2.1 重组质粒的构建
使用特异性引物cotX-BamHⅠ-F和cotX-R从B.subtilisWB800n菌株基因组DNA中扩增克隆芽孢衣壳蛋白基因cotX;使用特异性引物god-F和god-Hind Ⅲ-R,以pET28a-god质粒为模板扩增目的基因god(序列见表1)。将得到的PCR产物通过多片段无缝克隆技术连入经BamHⅠ和HindⅢ双酶切的pDG1730质粒中,得到重组质粒pDG730-cotX-god,通过化学转化法转入B.subtilisWB800n感受态细胞,构建重组菌B.subtilisWB800n-cotX-god。
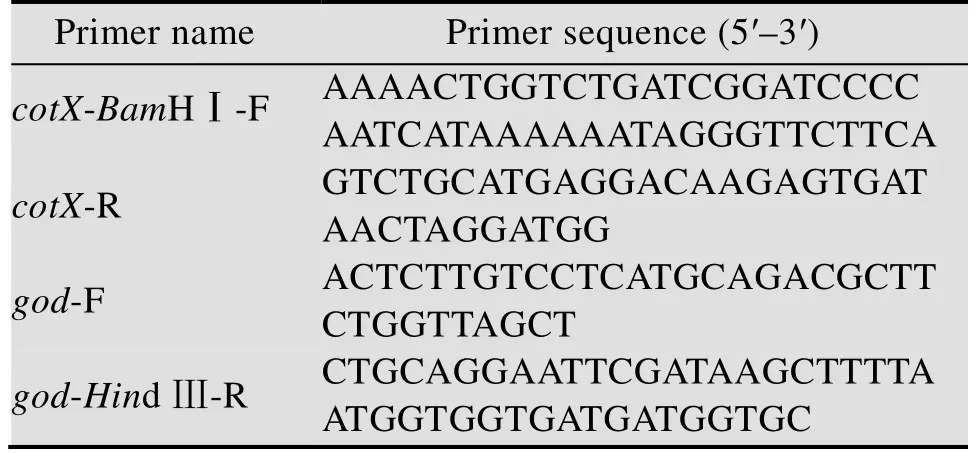
表1 本研究中所用的引物序列Table 1 Primers used in this study
1.2.2 重组芽孢的制备
利用饥饿法在DSM (Difico sporulation medium) 培养基上诱导重组菌产生芽孢。取重组菌落点接5 mL LB (含壮观霉素,工作浓度为100 μg/mL) 液体培养基 中,37 ℃过夜培养,然后在含壮观霉素 (工作浓度为100 μg/mL) 的50 mL DSM中接入1% (V/V) 的菌液,37 ℃、200 r/min摇床培养96 h。培养结束后的菌体8 000 r/min离心20 min,除去上清,用无菌去离子水将沉淀洗涤2次,最后得到重组芽孢[22]。
1.2.3 重组芽孢Western blotting分析
提取重组菌B.subtilisWB800n-cotX-god芽孢表面总蛋白,采用SDS-PAGE分离蛋白质样品[23],分离后的蛋白用湿转法从凝胶上转移到PVDF膜上,再用封闭液室温下封闭1 h,将膜上封闭液洗净后,把膜置于一抗 (Anti-GODZ antibody) 中,4 ℃条件下孵育12 h,将一抗回收,用TBST把膜洗3次,每一次振荡洗涤5 min。再用对应的二抗稀释液与膜接触,于室温下孵育1 h,同样回收二抗,用TBST洗膜3次,每次10 min,化学发光反应后扫描[24]。
1.2.4 重组芽孢免疫荧光分析
将制得的重组芽孢加入适量一抗 (Anti-GODZ antibody),置于冰上2 h,用抗体结合缓冲液洗涤离心尽量除去上清,再向其中加入由PBS适当稀释的FITC标记的羊抗兔IgG (二抗),置于冰上2 h,反应结束后,再用抗体结合缓冲液洗涤离心,将适量芽孢悬液滴涂在载玻片上,盖上盖玻片,在室温避光的环境中将其吹干,用荧光显微镜观察[25]。
1.2.5 芽孢表面展示GOD的酶活分析[26]
一个酶活力单位为:30 ℃、pH 6.0的磷酸盐缓冲体系下,每分钟催化1 μmol/L葡萄糖转化为葡萄糖酸的酶的量。
取20 g/L的葡萄糖磷酸缓冲溶液25 mL于锥形瓶中,在30 ℃恒温水浴中预热3 min,加入样品,混匀后立即计时反应,准确反应60 min后立即加入0.1 mol/L的NaOH溶液20 mL,混匀终止反应,加入1滴酚酞,用0.1 mol/L的HCl标准溶液进行滴定,记录消耗HCl的体积V。
空白对照:用水代替酶液,其余步骤相同,消耗HCl标准溶液体积为V0。
计算:GOD(U/g)=(V0−V)×C×N×1 000/(60×m)。
式中,C为HCl标准溶液的准确反应浓度;N为酶液的稀释倍数;1 000为换算系数;60为反应时间,单位为min;m为菌体干重。
1.2.6 Nafion/Spore-GOD/PB/GO/GCE修饰电极的制备
将预处理玻碳电极表面快速晾干,向电极工作面滴涂5 μL氧化石墨烯溶胶,电极记作GO/GCE。晾干后浸入PB沉积储备溶液中进行PB沉积,沉积方法为循环伏安法,沉积条件为电压−0.2–0.6 V,扫描速度50 mV/s,扫描圈数50圈。以去离子水充分清洗工作电极表面,晾干后向工作面滴涂5 μL的Spore-GOD悬液,置于4 ℃冰箱晾干,最后滴加5 μL的0.5 wt% Nafion溶液,晾干,修饰电极记作Nafion/Spore-GOD/PB/GO/GCE,其制作方法和原理如图1所示。

图1 电极的制作过程及作用原理示意图[27]Fig.1 Schematic diagram of electrode fabrication process and catalytic reaction mechanism[27].
2 结果与分析
2.1 重组枯草芽孢杆菌的PCR验证
将重组质粒pDG1730-cotX-god转入B.subtilisWB800n感受态细胞中,得到可以表达GOD的转化子。PCR验证表明扩增得到2 500 bp左右的目的片段 (图2),与理论值相同。未转质粒的B.subtilisWB800n没有出现相应的条带,说明重组质粒已经成功转入。

图2 重组菌B.subtilis WB800n-cotX-god的PCR验证Fig.2 PCR validation of recombinant B.subtilis WB800n-cotX-god.1:5 000 bp DNA marker;2–6:B.subtilis WB800n-cotX-god ;7:B.subtilis WB800n.
2.2 芽孢表面展示GOD的Western blotting分析
提取B.subtilisWB800n-cotX-god芽孢衣壳总蛋白后,Western blotting分析结果见图3。图中得到的82 kDa左右的特异性条带表明重组芽孢表面成功展示了葡萄糖氧化酶。

图3 重组菌B.subtilis WB800n-cotX-god的芽孢表面融合蛋白Western blotting分析图Fig.3 Western blotting analysis of spore surface fusion enzyme of recombinant B.subtilis WB800n-cotX-god.
2.3 芽孢表面展示GOD的IF分析
取阳性转化子B.subtilisWB800n-cotX-god的芽孢以及B.subtilisWB800n的芽孢进行了IF分析,图4A中可以看到,对照菌B.subtilisWB800n的芽孢在紫外光的激发下没有出现荧光,而图4B中B.subtilisWB800n-cotX-god的芽孢表面可以看到红色荧光,表明外源蛋白GOD已经成功展示在芽孢表面。

图4 免疫荧光分析图 (A:B.subtilis WB800n免疫荧光分析;B:B.subtilis WB800n-cotX-god免疫荧光分析)Fig.4 Immunofluorescence analysis of B.subtilis WB800n (A) and B.subtilis WB800n-cotX-god (B).
2.4 Nafion/Spore-GOD/PB/GO/GCE修饰电极的表征
SEM被用于表征GO,GO/PB和Spore-GOD/GO/PB等材料的形态和分散情况。图5A中GO表面具有褶皱,这种自然的褶皱对保持GO具有高的比表面积非常有利,有利于生物材料的吸附。图5B为芽孢包埋在GO/PB复合材料表面的SEM,图中可观察到PB纳米颗粒自由分散在GO表面,且GO表面的褶皱使芽孢更稳定存在电极表面。

图5 电极SEM表征图 (A:GO;B:Spore-GOD/PB/GO)Fig.5 SEM characterizations of GO (A) and Spore-GOD/PB/GO (B).
2.5 修饰电极的电化学表征
循环伏安法 (CV) 被用以表征Nafion/Spore-GOD/PB/GO/GCE电极的修饰过程,裸玻碳电极、GO/GCE电极和Nafion/Spore-GOD/PB/GO/GCE电极都是在0.20 mol/L的KNO3溶液中记录10–3mol/L K3Fe(CN)6溶液的循环伏安曲线。如图6A所示,将GO滴在裸玻碳电极表面后,峰电流有所增加,这是因为GO具有导电能力,可促进电子传递。但是修饰电极Nafion/Spore-GOD/PB/GO/GCE的峰电流较GO/GCE的降低了,这是由于Spore-GOD不导电,阻止了电子向电极表面的传递。
交流阻抗法 (EIS) 也是表征修饰电极的方法之一。如图6B所示,图谱中的半圆大小表明了电极的阻抗大小,其中GO/GCE修饰电极的半圆最小,阻抗最低,因为电极表面的GO可以促进电子传递,使该电极的阻抗小于裸玻碳电极;而修饰电极Nafion/Spore-GOD/PB/GO/GCE的阻抗值最大,这是因为大量芽孢阻碍了电子的传递。由EIS得到的结论与CV一致。
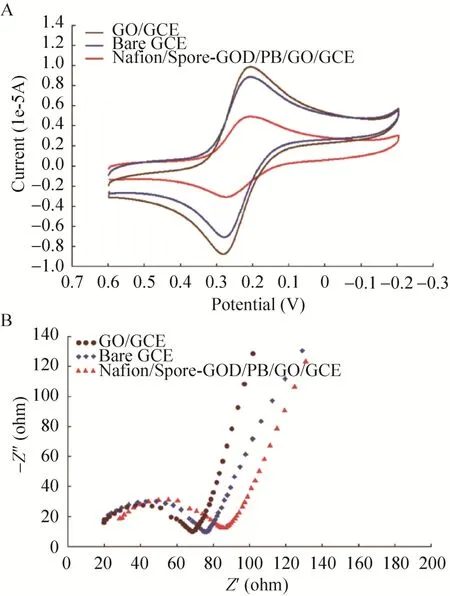
图6 不同修饰电极的CV图和EIS图 (A:不同修饰电机的CV图;B:不同修饰电极的EIS图)Fig.6 CVs (A) and EIS (B) of different modified electrodes.
2.6 pH和温度对传感器的影响
影响生物传感器响应特性的因素主要有测试溶液的pH值和温度。考察Nafion/Spore-GOD/PB/GO/GCE传感器在pH 2.5–10范围内对1 mmol/L葡萄糖溶液的电流响应,结果如图7所示。在pH小于7范围内,随着pH的增大电流值也增大;在pH为7时,电流响应最大;pH大于7.0时,电流响应呈下降趋势。所以本研究选择pH 7.0的PBS作为检测溶液。
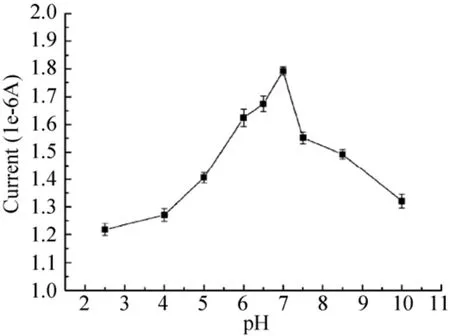
图7 溶液pH值对电流响应的影响Fig.7 Effect of solution pH on current response.
实验还考察了测试温度 (在20–70 ℃范围内)对传感器的影响。结果如图8所示,温度在20–40 ℃范围内时,随着温度的升高,传感器的电流响应值也会增大;温度在40 ℃时,电流值达到最大;温度大于40 ℃时,电流值开始下降。因为考虑到过高的温度会使酶失去活性而影响实验的准确性和实验过程中操作的方便性,所以选择室温25 ℃作为检测温度。

图8 溶液温度对电流响应的影响Fig.8 Effect of solution temperature on current response.
2.7 传感器的性能研究
为了进一步检测Nafion/Spore-GOD/PB/GO/GCE修饰电极的工作性能,采用循环伏安法研究了修饰电极的检测线性范围。
如图9所示,Nafion/Spore-GOD/PB/GO/GCE电极对葡萄糖的响应良好,电极峰电流随着底物浓度的增加而逐渐增大,在0.1–7.0 mmol/L的葡萄糖浓度范围内线性关系良好,相关系数为0.992 9。信噪比为3时 (S/N=3),根据3 σ规则计算可得葡萄糖的检测下限为7.5 μmol/L,灵敏度为41.55 μA·L/(mmol·cm2)。因此,人体的空腹血糖浓度 (空腹血糖的正常范围为3.89–6.11 mmol/L)在酶电极的线性范围内,可适用于人体血液中葡萄糖的直接检测。该生物传感器性能优于其他文献报道的用于葡萄糖检测的传感器,Zhang等[28]通过将MnO2纳米线修饰玻碳电极,并将GOD固定在其表面制得葡萄糖生物传感器,线性范围为0.2–3.8 mmol/L,检出限为25.56 μmol/L,灵敏度为38.2 μA·L/(mmol·cm2);Zhao[29]在聚苯胺修饰的玻碳电极 (PANI/GCE) 上进行了GOD的固载,制得的传感器线性范围为0.5–2.25 mmol/L;Wang等[30]制备的用于葡萄糖检测的ZnO纳米梳生物传感器其检测限为20 μmol/L,灵敏度为15.33 μA·L/(mmol·cm2)。
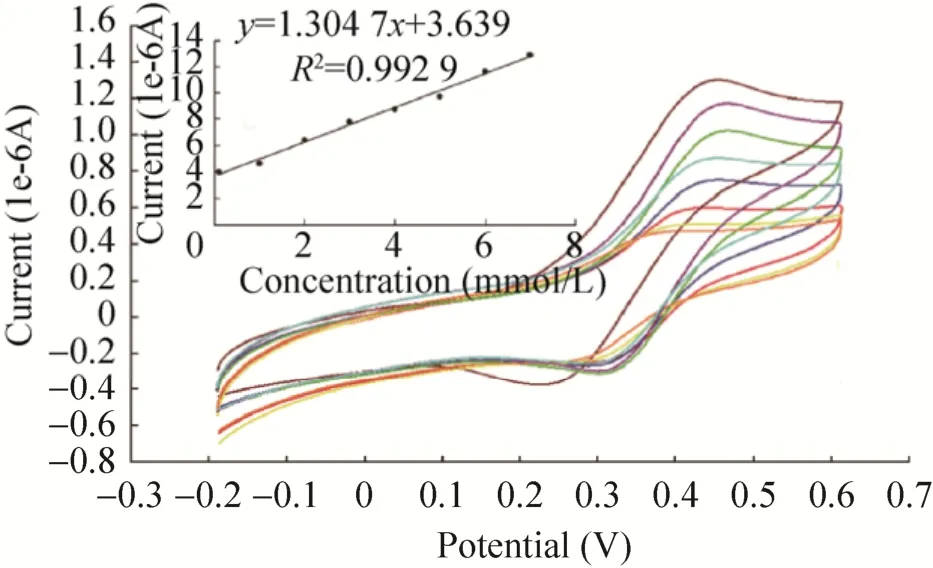
图9 传感器对不同浓度葡萄糖溶液的催化响应图Fig.9 Catalytic response of the sensor to glucose solutions with different concentrations.
2.8 传感器的抗干扰性、重现性和稳定性
实验主要考察了抗坏血酸 (AA) 和尿酸(UA) 是否会对传感器Nafion/Spore-GOD/PB/GO/GCE产生干扰,在待检测的1.0 mmol/L葡萄糖溶液里加入1.0 mmol/L抗坏血酸,1.0 mmol/L尿酸,葡萄糖的电流响应没有明显的变化。说明该传感器的抗干扰能力良好。
Nafion/Spore-GOD/PB/GO/GCE传感器的稳定性和重复性。通过将Nafion/Spore-GOD/PB/GO/GCE置于0.1 mmol/L葡萄糖溶液中进行循环伏安扫描50圈,比较氧化峰电流,考察传感器的稳定性,得到电流值比最初电流增加了约5%,说明传感器具有很好的稳定性和可重复性。用同样的方法分别制备了5根Nafion/Spore-GOD/PB/GO/GCE传感器,测定同一份0.1 mmol/L葡萄糖溶液,电流值的相对标准偏差 (Relative standard deviation,RSD) 为4.2%,这表明传感器的制备方法具有较好的重现性。不使用时将该电极保存在4 ℃冰箱内,用该电极每天测定0.1 mmol/L葡萄糖溶液,在1–10 d内电流强度保持平稳,未出现大幅度波动情况,10 d后电峰电流强度有所下降,这表明所制备的电极在10 d内具有一定的稳定性。
2.9 传感器在实际样品中的应用
为描述该传感器在实际分析中的可行性,将该传感器用于实际血清中的葡萄糖检测。为适应该生物传感器的检测范围,提高检测准确度,在检测前将血样用0.1 mol/L PBS (pH 7.0)适当稀释,每个样品同时检测3次。从表2可知,传感器的回收率好,这表明构建的电极具有实际应用的可能性。
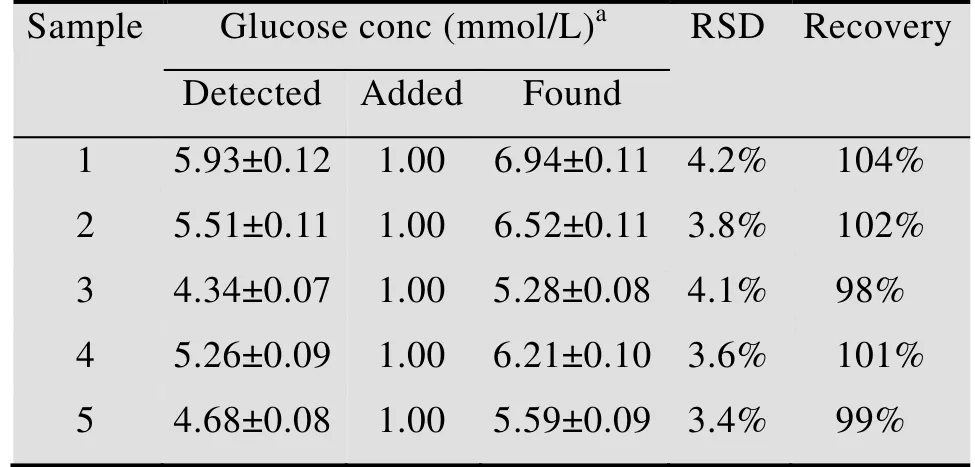
表2 实际样品中葡萄糖含量的检测Table 2 Determination of glucose content in actual samples
3 总结
利用重组芽孢以及GO材料和PB电子媒介体构筑的新型葡萄糖电化学生物传感器性能优良,主要原因可能是:通过枯草芽孢杆菌芽孢表面展示GOD,芽孢优良的抗逆性可有效提高外源蛋白GOD的稳定性,从而有利于修饰电极的应用和稳定储存;在电极构建过程中引入Nafion溶液可以改善检测过程中酶的渗漏问题,使得传感器的稳定性提高;GO-PB中的PB可以和Spore-GOD形成拟双酶体系,使得信号放大,从而增强了生物传感器的灵敏度;电极制备过程温和,具有很好的生物兼容性,可以有效地保持酶的构型和活性。
葡萄糖参与生命体代谢,是生命体能量的重要来源,对人体内血糖含量的测定有利于疾病的诊断和预防。葡萄糖氧化酶是工业生产和医学检测中的一种重要用酶,但是由于酶分子的活性中心深埋其内部、直接吸附在电极表面容易变形和污染等原因,大大限制了葡萄糖氧化酶电极的进一步发展。本研究利用枯草芽孢杆菌芽孢表面展示技术将GOD展示到芽孢表面,可直接发酵获取大量重组芽孢,避免了细胞破碎引起的污染及酶的纯化成本问题,具有一定的应用价值。将GO/PB复合膜修饰玻碳电极制成电化学传感器用于葡萄糖的灵敏测定。此修饰电极具有良好的导电性能、催化性能、稳定性和重现性,可适合于检测人体血糖浓度。
