重组枯草芽孢杆菌全细胞催化合成2-O-α-D-甘油葡糖苷
2020-04-15段培枫尤甲甲徐美娟杨套伟邵明龙张显饶志明
段培枫,尤甲甲,徐美娟,杨套伟,邵明龙,张显,饶志明
江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
2-O-α-D-甘油葡糖苷 (2-O-α-D-glu-copyranosylsn-glycerol) 是一种由一个葡糖基和一个甘油基通过糖苷键连接的糖苷类物质[1],在自然界广泛存在,特别是在耐盐的蓝细菌[2]和南非密罗木中,它是密罗木能在极端环境中生存和重新激活复生的最主要的活性物质[3];另外,在日本清酒中也发现含有活性成分2-O-α-D-甘油葡糖苷[4]。2-O-α-D-甘油葡糖苷对生物体具有保护作用,当细胞处在高渗透压、强紫外线或干旱等恶劣条件下时,它能在细胞表面形成保护膜,从而有效防止蛋白质分子变性、失活[5],因此,2-O-α-D-甘油葡糖苷可作为蛋白质和酶的稳定剂[6-7]。此外,由于其高保湿性、低吸水性的特点,2-O-α-D-甘油葡糖苷常被用作化妆品原料,以提高皮肤的保湿效果[8-9];2-O-α-D-甘油葡糖苷还可以作为一种无致龋性的甜味剂添加到食品中[10]。因此,2-O-α-D-甘油葡糖苷在化妆品、食品、医药[11-12]、保健品[13]等领域发挥着重要作用,具有广阔的应用和市场前景;但截至目前,德国的Bitop AG公司是唯一一家在工业规模上实现了2-O-α-D-甘油葡糖苷生产的公司[14],而国内关于2-O-α-D-甘油葡糖苷的产业化仍处于起步、探索阶段。
2-O-α-D-甘油葡糖苷具有多种合成方式,主要包括化学法合成、微生物合成和酶转化合成[15]。化学法合成的产物中由于存在多种同分异构体[4],需多步纯化,2-O-α-D-甘油葡糖苷产率较低,工艺复杂[10],一般不在工业上采用。微生物合成法[2]是指利用经基因改造后的蓝细菌等微生物在盐胁迫条件下进行光合作用合成2-O-α-D-甘油葡糖苷[16],Martin等曾经报道了利用嗜根寡养单胞菌Stenotrophomonas rhizophilastrainDSM14405合成2-O-α-D-甘油葡糖苷,但产量仅约为29 mg/L[17]。近些年一些学者通过分子改造和胁迫培养条件的优化[18],提高了生物体内合成2-O-α-D-甘油葡糖苷的产量,但据报道最高产量也仅约为0.3 g/L[19],仍不具工业应用价值。酶转化法包括α-葡糖苷酶转化法和蔗糖磷酸化酶转化法[15]。α-葡糖苷酶转化法是以麦芽糖和甘油为底物,通过α-葡糖苷酶的转糖基化,进行体外酶促合成2-O-α-D-甘油葡糖苷的方法,转化产物是包括2-O-α-D-甘油葡糖苷在内的3种不同立体异构体的混合物[10],分离纯化较为困难,生产成本高,不利于大规模生产;蔗糖磷酸化酶转化法是奥地利学者Goedl等将蔗糖磷酸化酶基因在大肠杆菌中克隆表达,以蔗糖和甘油为底物,建立的一种酶促合成2-O-α-D-甘油葡糖苷的方法[20],这种方法具有底物原料低廉、产物简单的优点,但也存在转化时间长、体外条件下酶的稳定性差、容易失活等问题,同时大肠杆菌作为宿主菌的安全性问题[21-22],这都限制了2-O-α-D-甘油葡糖苷在食品、药品领域的工业化应用。
本研究首先将来源于肠膜明串珠菌Leuconostoc mesenteroides的蔗糖磷酸化酶基因(gtfA) 在大肠杆菌Escherichia coli中克隆表达,然后通过Ni-NTA亲和柱对目标产物进行纯化,收集SPase纯酶并测定其酶学性质,再将gtfA基因导入食品安全级枯草芽孢杆菌Bacillus subtilis中,构建重组菌株B.subtilis168/pMA5-gtfA,通过优化培养条件,改善重组酶在胞内的表达水平,并将重组枯草芽孢杆菌作为全细胞催化剂以蔗糖和甘油为底物合成2-O-α-D-甘油葡糖苷,反应式如图1所示。这也是首次将枯草芽孢杆菌全细胞催化的方法应用于2-O-α-D-甘油葡糖苷的合成,同时通过全细胞转化条件优化,获得了较高的蔗糖转化率和2-O-α-D-甘油葡糖苷产量,这为2-O-α-D-甘油葡糖苷的工业化生产提供了实验基础。
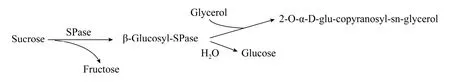
图1 蔗糖磷酸化酶催化合成2-O-α-D-甘油葡糖苷[23]Fig.1 Synthesis of 2-O-α-D-glu-copyranosyl-sn-glycerol catalyzed by sucrose phosphorylase[23].
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
高校教师是一流大学及学科专业建设的主体力量。对于行业特色型大学而言,“双一流”建设使命的完成有赖于高素质的教师队伍。在此背景下,科学有效地激发高校教师队伍围绕“双一流”建设任务和目标要求,积极投身到“双一流”建设大潮之中就显得非常急迫而重要。高校教师绩效考核评价体系是教师行为的“指挥棒”,科学设计能够反映行业特色型大学“双一流”建设任务的考核评价机制就成为实现“双一流”建设目标的重要手段。[2]
枯草芽孢杆菌Bacillus subtilis168、大肠杆菌E.coliBL21(DE3)及质粒pMA5、pET-28a均为本实验室保藏。
1.1.2 酶和试剂
1.2.7 酶的最适pH的测定
BamHⅠ、XhoⅠ等限制性核酸内切酶与DNA聚合酶购于TaKaRa公司;小量质粒提取试剂盒、同源重组试剂盒和胶回收试剂盒购于南京诺维赞生物科技有限公司;2-O-α-D-甘油葡糖购于德国Bitop AG公司;蔗糖、甘油和果糖等分析纯试剂均购于上海麦克林生化科技有限公司。
1.1.3 培养基
LB培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠10 g/L。
发酵培养基:葡萄糖60 g/L,酵母粉20 g/L,蛋白胨20 g/L,七水合硫酸镁2 g/L,尿素3 g/L,磷酸二氢钾5 g/L,磷酸氢二钾5 g/L,硫酸锌0.143 g/L,柠檬酸钠5 g/L;pH 7.0–7.2。
1.2 方法
1.2.1 引物设计
通过NCBI数据库获得编码肠膜明串珠菌蔗糖磷酸化酶的基因序列,选择合适的酶切位点,设计并合成两对同源臂引物,序列参见表1。

表1 本研究中使用的引物Table 1 Primers used in this study
1.2.2 构建重组表达菌株
酶活测定体系为1 mL,其中蔗糖0.4 mol/L,甘油1 mol/L,MES缓冲液 (pH 7.0) 50 mmol/L,50 μg纯酶,35 ℃下反应30 min,煮沸10 min终止反应。将反应液用0.2 μm滤膜过滤,稀释后进行HPLC检测。检测条件为[20]:Agilent Hi-Plex Ca色谱柱,RID检测器,超纯水作流动相,柱温85 ℃,流速 0.6 mL/min。酶活定义为:每1 min生成1 μmol 2-O-α-D-甘油葡糖苷所需的酶量为1个酶活单位 (U)。
这里还是“甜渣党”们的天堂,一定得去一趟那些特色的wine shop,里面可谓是“卧虎藏龙”。同行的侍酒师孙昕就偶遇一间natural wine shop,里面竟然有着3000年前米西比亚时期的墓穴,不过更让他兴奋的是那丰富、独特的自然酒和那颇有Geek范的老板。两人兴致勃勃地聊了好一会,小伙伴果断花掉身上最后一个钢,提着两箱酒开开心心地走回酒店。
张自立回到五连至今,一直和母亲住在一起。他和爱人申学群于2002年相识相爱,进而走进幸福的婚姻生活,儿子张睿健今年也9岁了,上小学三年级。现如今,他们是三世同堂的幸福家庭。
挑重组菌E.coliBL21/pET-28a-gtfA于10 mL LB培养基中,37 ℃培养11–12 h后,以3% (V/V)的接种量转接100 mL LB培养基,培养至OD600达0.8–1.0时,加入IPTG诱导后,25 ℃培养11–12 h,离心收集菌体,缓冲液悬浮后进行超声破碎,将裂解液低温离心,所得上清即重组菌粗酶液。将粗酶液用0.2 μm滤膜过滤处理,经Ni-NTA亲和柱纯化后收集SPase纯酶,测定其酶学性质。
1.2.4 Spase在枯草芽孢杆菌中的表达
挑重组菌B.subtilis168/pMA5-gtfA于10 mL LB培养基中,37 ℃培养11–12 h后,以2% (V/V)的接种量转接100 mL发酵培养基中,30 ℃培养20 h后离心收集菌体,超声破碎后进行SDS-PAGE分析。
将酶反应体系分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃的条件下测定酶活,确定酶反应的最适温度,设置酶活最高组为100%对照。
就他本人研究初唐诗而言,章句家的诗、类书家的诗和“诗中的诗”,均有眼力判断。他的《孟浩然》是从孙润夫家藏的王维所画的“孟浩然像”说起,《贾岛》开篇勾勒贾岛、姚合阴黯的形象,确乎源自性格的考量。定其品第,别其体性,估其价值,用历史的眼光来研究,则已然是“综合”下一阶段的重心了。
以肠膜明串珠菌基因gtfA为模板,pET-28a-SP-F和pET-28a-SP-R为引物,PCR扩增,并用BamHⅠ和XhoⅠ酶切质粒pET-28a,胶回收酶切产物和PCR产物后用同源重组试剂盒进行连接,然后将连接产物转化入E.coliBL21感受态细胞,涂布浓度为50 μg/mL卡那霉素的LB抗性平板过夜培养,挑取阳性转化子,送苏州金唯智生物科技有限公司测序,若测序正确,即重组菌株E.coliBL21/pET-28a-gtfA构建成功。以基因gtfA为模板,pMA5-SP-F和pMA5-SP-R为引物,PCR扩增,并用BamHⅠ和NheⅠ酶切质粒pMA5,将酶切产物与PCR产物经同源重组连接后转化入E.coliBL21感受态细胞,涂布浓度为100 μg/mL氨苄青霉素的LB抗性平板过夜培养,挑选测序正确的菌株,抽提质粒pMA5-gtfA,转化到B.subtilis168感受态细胞中,涂布浓度为50 μg/mL卡那霉素的LB抗性平板过夜培养,挑取阳性转化子,送苏州金唯智生物科技有限公司测序,若测序正确,即重组菌株B.subtilis168/pMA5-gtfA构建 成功。
Sensory evaluation of foreign high-end branded creams 7 20
1.2.6 酶的最适温度的测定
1.2.5 酶活测定
1.2.3 Spase在大肠杆菌中的表达和纯化
因此,高校在大学生生涯规划指导中应紧密结合思想政治教育,变思政课程为课程思政,积极创新思政教育新模式,切合大学生的自主意识,充分调动学生的主动性、参与性,将教学重点与学生的兴趣点有机结合起来,以学生喜闻乐见的方式呈现出来,让学生易于接受。有的高校采用生动的展板方式,组织学生辩论赛,组织学生拍摄微电影,借助微信平台创建特色栏目,如江南大学的宝哥说,内容诙谐幽默,深受学生喜爱。同时把思政教育层面扩展开来,学生并不是只在思政课上接受思想政治教育,全校的每一位教职工都应肩负起学生思想政治教育的责任与重担,把思政教育贯穿于课堂、宿舍、实验室等学校里的任何一个角落,与心理辅导、学生管理有机结合。
2.2 下载频次 54篇高被引论文的总下载频次为45 839次,单篇最高下载频次为4 194次(对应的被引频次为104次),单篇最低下载频次为81次(对应的被引频次为20次),平均下载频次为849次∕篇。其中,下载频次>2 000次的论文有3篇,500次<下载频次≤2 000次的论文有26篇,100次<下载频次≤500次的论文有23篇,下载频次≤100次的论文有2篇。
将酶反应体系分别在pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0的条件下测定酶活,确定酶反应的最适pH,设置酶活最高组为100%对照。其中3种不同的缓冲体系:柠檬酸-柠檬酸钠缓冲液 (pH 4.0–6.0)、MES缓冲液 (pH 6.0–8.0)和甘氨酸-氢氧化钠缓冲液 (pH 8.0–10.0)。
1.2.8 酶的温度稳定性的测定
“经过一段时间的实践,‘联合社’三方共赢的优势逐步显现。”韩素兰说。农业企业通过规模采购向家庭农场供应农业生产资料,获取差额利润;通过直接与家庭农场联结,建立稳定的生产基地,既确保了原料稳定供给,又减少了原料采购中间环节,节约了成本;通过指导监督家庭农场生产,保障了农产品质量安全。服务类农民专业合作社向家庭农场提供技术服务和作业服务,有了稳定的服务面积和集中连片的作业环境;产业类合作社在帮助企业统一组织生产资料供应及产品回收中获得相应的提成。
取纯酶分别置于20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃的条件下保温,定时取样测定残余酶活,设置初始酶活为100%对照。
为了后续利用构建的重组枯草芽孢杆菌作为全细胞催化剂来合成2-O-α-D-甘油葡糖苷,通过优化菌株培养温度和培养时间,改善SPase在宿主枯草芽孢杆菌的表达水平,以提高重组菌全细胞催化合成2-O-α-D-甘油葡糖苷的能力。
2.1.1 心理护理 术前关注患者的心理状态至关重要[7]。患者为年轻女性,病史2年余,因咳嗽、咳痰、发热就诊于多家医院,口服抗结核药物效果不满意,经多次气管镜检查发现气管下段狭窄。随着病情进展呼吸困难加重,雾化、平喘、对症治疗无效,使患者对治疗信心不足。虽然对手术抱有希望,但又担心手术失败。护士及时了解患者心理变化,随时了解各种检查结果,给予心理疏导。告诉其医护人员及家人正在积极想办法、做准备,并列举成功实施气管手术的病例鼓励患者,讲解大致手术过程,增强患者战胜疾病的信心。在不影响治疗、护理的情况下,尽量让家属陪伴,增加患者安全感,使患者能积极配合检查、治疗。
1.2.9 酶的pH稳定性的测定
取纯酶分别置于pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的缓冲液中,保持2 h后,测定残余酶活,以测得残余酶活最高组为100%对照。
2 结果与分析
2.1 肠膜明串珠菌蔗糖磷酸化酶基因gtfA的克隆与表达
从NCBI数据库中检索到肠膜明串珠菌蔗糖磷酸化酶的序列,长度为1 479 bp,合成该序列并作为模板,进行PCR扩增,电泳结果如图2A所示,可见特异性条带位置与目标基本一致。按照方法1.2.2构建重组菌株E.coliBL21/pET-28a-gtfA,细胞破碎后,SDS-PAGE分析结果见图2B,重组菌裂解物上清在约56 kDa位置表达有明显的蛋白质特征条带,与报道中的分子量一致[24],且经Ni-NTA亲和柱纯化后的重组蛋白在相应大小位置也有单一条带,这表明基因gtfA在大肠杆菌中成功表达。

图2 gtfA基因的克隆 (A)、表达及纯化分析 (B)Fig.2 The result of gtfA gene cloning (A),expression and purification (B).(A) Lane M:DL 10 000 marker;lane 1–2:Gene gtfA.(B) lane M:protein marker;lane 1:E.coli BL21/pET-28a crude enzyme;lane 2:E.coli BL21/pET-28a-gtfA crude enzyme;lane 3:purified SPase.
2.2 温度和pH对SPase酶活力和稳定性的影响
2.2.1 温度对SPase酶活力和稳定性的影响
在不同温度下测定SPase的酶活力,结果如图3A所示,酶的最适反应温度为35 ℃,在20–45 ℃之间时具有较高酶活力,当温度超过45 ℃时,酶活力开始迅速下降。研究温度对SPase稳定性的影响,结果见图3B,可以看出,SPase在30 ℃、35 ℃保温120 min后的残余酶活力仍然高于80%,而在45 ℃保温80 min后的残余酶活力几乎为零,这表明它在30–35 ℃范围内有较好的稳定性。
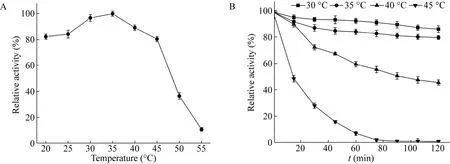
图3 SPase的最适温度 (A) 和温度稳定性 (B)Fig.3 Optimal temperature (A) and the temperature stability (B) of SPase.
2.2.2 pH对SPase酶活力和稳定性的影响
在不同pH下测定SPase的酶活力,结果见图4A。可以看出,酶的最适反应pH为7.0,在pH处于6.0–8.0之间时具有较高酶活力。研究pH对SPase稳定性的影响,结果见图4B,SPase在pH 6.0–7.0下保持2 h后的残余酶活力仍在90%以上,表明其在此pH范围内有较好的稳定性。
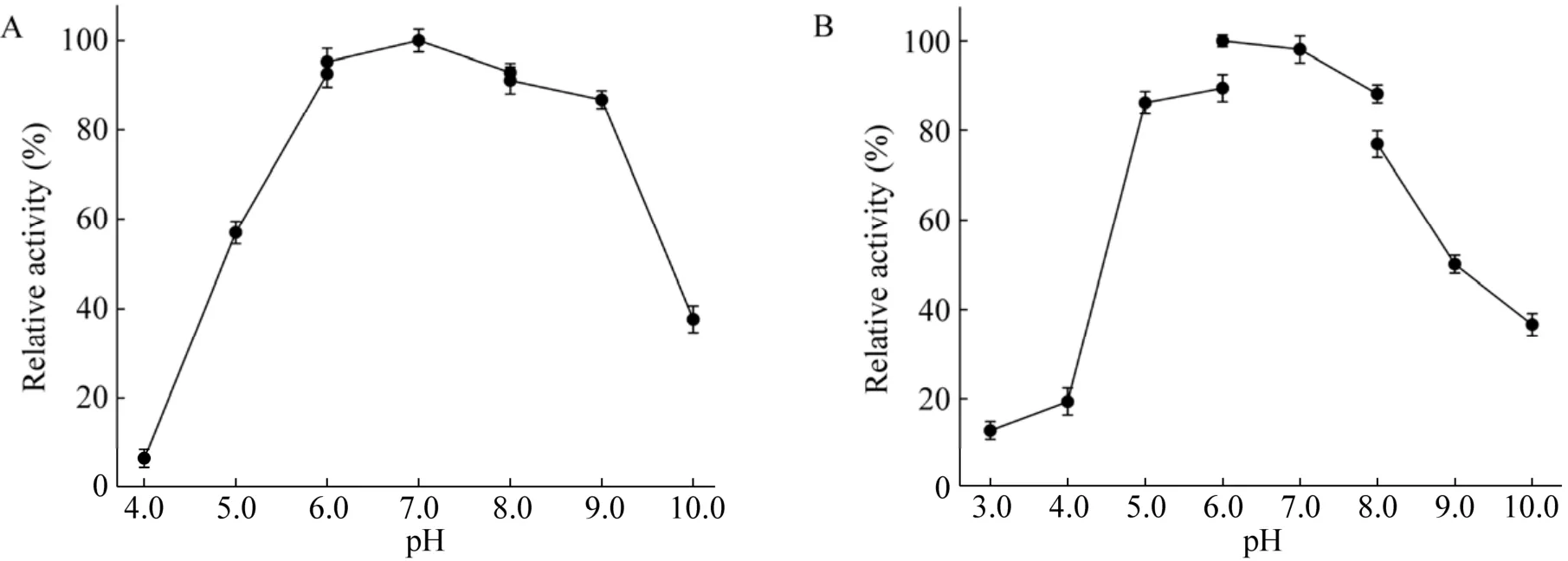
图4 SPase的最适pH (A) 和pH稳定性 (B)Fig.4 Optimal pH (A) and the pH stability (B) of SPase.pH 3.0–6.0:citric acid-sodium citrate buffer;pH 6.0–8.0:MES buffer;pH 8.0–10.0:glycine-sodium hydroxide buffer.
2.3 SPase在枯草芽孢杆菌中的表达
枯草芽孢杆菌通常被认为是一种食品安全级菌种,因此我们选择枯草芽孢杆菌作为宿主,用来开发2-O-α-D-甘油葡糖苷合成的全细胞生物催化方法。按照1.2.2中的方法构建重组枯草芽孢杆菌B.subtilis168/pMA5-gtfA,加入溶菌酶后超声破碎,SDS-PAGE分析结果如图5所示,重组菌破壁上清在约56 kDa大小处表达有清晰的蛋白条带,即表明SPase在宿主B.subtilis168中成功表达。

图5 SPase在枯草芽孢杆菌中的表达Fig.5 Expression of SPase in B.subtilis.M:protein marker;lane 1:B.subtilis 168/pMA5 crude enzyme;lane 2:B.subtilis 168/pMA5-gtfA crude enzyme;lane 3:B.subtilis 168/pMA5-gtfA fermentation broth.
2.4 优化SPase在枯草芽孢杆菌中的表达
在颈椎减压植骨融合术中,融合器在前期植骨愈合中起支撑作用,因此有必要对融合器的应力进行分析.图6是融合器模型在各种运动下的等效应力分布.在前屈运动图6(a)时,融合器的应力主要分布在上表面前方的锁定孔的周围以及下方区域,最大应力为123.1 MPa;后伸运动时,主要分布在上表面的前方锁定孔的周围及后方区域,但最大等效应力依然位于前方锁定孔周围,为115.5 MPa.侧弯运动时,应力主要分布在融合器的侧面和锁定孔周围,最大值为54.09 MPa.轴向旋转运动时,应力分布比较均匀,不存在应力集中,最大值为45.03 MPa.
2.4.1 培养温度的优化
本研究所用pMA5质粒搭载的是一种组成型的启动子[25],不需要其他因子的诱导,外源基因即可稳定表达,但其在宿主菌中表达水平的高低,会受环境因素的影响。按方法1.2.4接种重组菌B.subtilis168/pMA5-gtfA,转接100 mL发酵培养基,分别在20 ℃、25 ℃、30 ℃、35 ℃和40 ℃下培养16 h后,破碎细胞进行酶活力测定。结果显示 (图6A),在30 ℃下培养时,测得菌体裂解物的酶活力最高,为1.31 U/mL;温度低于30 ℃时,菌株的生长代谢速度过慢,表达量较低;而培养温度高于35 ℃时,由于酶的热稳定性不佳,在较高温度下,酶活性会逐渐丧失,所以测得的酶活也较低。
2.4.2 培养时间的优化
生活中类似的人性之恶与无耻并不罕见。2011年下半年,因为所在大学接受教育部本科合格评估,我对学生的出勤抓得比较严,一有迟到、早退、旷课的行为都登记在册,学生上课讲小话什么的,也会遭到我的批评。没想到期末教学检查时,居然有学生利用匿名向老师书面提意见的机会将我说得一无是处,甚至还捏造了我在课堂上的“违规行为”。好在我所在的文学院主持正义,当年将我推荐为学校的优岗,并公之于众,才将个别学生的这种无耻之举压下去。
按方法1.2.4接种重组菌B.subtilis168/pMA5-gtfA,转接100 mL发酵培养基后,30 ℃分别培养12、14、16、18、20、22、24 h后,破碎细胞进行酶活力测定。结果显示 (图6B),培养20 h时菌体裂解物酶活力达到最高,为1.43 U/mL;继续延长培养时间,酶活力并没有提高,可能是因为在发酵后期,其他代谢副产物的大量积累,影响了目的酶的表达。

图6 培养温度 (A) 及培养时间 (B) 对枯草芽孢杆菌中SPase表达的影响Fig.6 Influence of culture temperature (A) and time (B) on SPase expression in Bacillus subtilis.
2.5 重组菌B.subtilis 168/pMA5-gtfA全细胞转化合成2-O-α-D-甘油葡糖苷的条件优化
2.5.1 温度对全细胞转化合成2-O-α-D-甘油葡糖苷的影响
温度通过影响菌体状态和酶促反应的效率而影响2-O-α-D-甘油葡糖苷的合成。按方法1.2.4接种重组菌B.subtilis168/pMA5-gtfA,转接发酵培养基,30 ℃培养20 h后离心收集菌体,进行全细胞转化合成2-O-α-D-甘油葡糖苷。控制初始反应pH 7.0,蔗糖1 mol/L,甘油1 mol/L,菌体OD600为20,反应温度分别为25 ℃、30 ℃、35 ℃、40 ℃、45 ℃的条件下进行全细胞转化反应。结果如图7A所示,全细胞转化反应温度为30 ℃时,蔗糖转化率最高,达到53.2%,2-O-α-D-甘油葡糖苷产量为134.8 g/L;在45 ℃时,蔗糖转化率较低,仅为28.4%。
2.5.2 初始pH对全细胞转化合成2-O-α-D-甘油葡糖苷的影响
按方法1.2.4接种重组菌B.subtilis168/pMA5-gtfA,转接发酵培养基,30 ℃培养20 h后离心收集菌体,进行全细胞转化合成2-O-α-D-甘油葡糖苷,理论上转化反应过程中pH无明显变化,探究初始pH对全细胞转化合成2-O-α-D-甘油葡糖苷的影响。控制反应温度为30 ℃,蔗糖浓度1 mol/L,甘油浓度1 mol/L,菌体OD600为20,初始pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的条件下进行全细胞转化反应。结果如图7B所示,在pH小于7.0时,蔗糖转化率随pH的升高而增加,在pH 6.5–7.5时,产率较高,其中,pH 7.0时最高为53.5%。
2.5.3 菌体量对全细胞转化合成2-O-α-D-甘油葡糖苷的影响
车辆工程作为机械行业的一个代表产业和学科,汽车的设计、生产和发展也代表了机械行业的科技能力和一个国家制造水平。汽车行业作为一个较为成熟的领域,其中的制造技术和管理技术也对其他行业有着十分重要的借鉴性和启示性,因此了解汽车方面的专业词汇有很强的实用意义。
在转化反应中将菌体浓度控制在适宜的水平,对满足生产需要和降低生产成本是至关重要的。按方法1.2.4接种重组菌B.subtilis168/pMA5-gtfA,转接发酵培养基,30 ℃培养20 h后离心收集菌体,进行全细胞转化合成2-O-α-D-甘油葡糖苷。控制反应温度为30 ℃,初始pH 7.0,蔗糖浓度1 mol/L,甘油浓度1 mol/L,菌体OD600分别为10、20、30、40、50、60、70、80的条件下进行全细胞转化反应。结果如图7C所示,转化体系菌体OD600为40时,蔗糖转化率最高,达到61.7%,2-O-α-D-甘油葡糖苷产量为156.5 g/L;菌体量继续增加,转化率并没有随之提高,可能是因为转化体系中,小部分的蔗糖被菌体自身用于维持基本的生命活动所消耗。
图7 温度 (A)、pH (B)、菌体密度 (C) 及底物浓度 (D) 对重组菌B.subtilis 168/pMA5-gtfA全细胞转化合成2-O-α-D-甘油葡糖苷的影响Fig.7 Influence of temperature (A),pH (B),cell density (C) and substrate concentration (D) on the transformation of 2-O-α-D-glu-copyranosyl-sn-glycerol in recombinant B.subtilis 168/pMA5-gtfA whole cells.
2.5.4 底物浓度对全细胞转化合成2-O-α-D-甘油葡糖苷的影响
当反应体系中没有磷酸盐的情况下,蔗糖磷酸化酶催化蔗糖分解为果糖和葡糖基-酶中间体,并以甘油为受体催化转糖基反应合成2-O-α-D-甘油葡糖苷。理论上,蔗糖和甘油合成2-O-α-D-甘油葡糖苷的摩尔比为1︰1,但以甘油为受体的转糖基反应是一个可逆反应,反应中使甘油过量,可能会促使蔗糖得到较高的转化率。所以,控制反应温度30 ℃,初始pH 7.0,菌体OD600为40,蔗糖浓度1 mol/L,设置不同浓度蔗糖和甘油的摩尔配比的条件下进行全细胞转化合成2-O-α-D-甘油葡糖苷,结果如图7D所示,转化体系中的蔗糖和甘油的摩尔配比为1︰2.5时,蔗糖转化率达76.3%,继续增大甘油浓度,转化率并没有随之提高。
2.6 5 L发酵罐全细胞转化合成2-O-α-D-甘油葡糖苷
为验证重组菌B.subtilis168/pMA5-gtfA在大体系中的转化水平,在实验室5 L发酵罐进行初步测试。用1 L 50 mmol/L的MES缓冲液悬浮B.subtilis168/pMA5-gtfA菌体,控制反应温度30 ℃,初始pH 7.0,蔗糖1 mol/L,甘油2.5 mol/L,菌体OD600为40的条件下于5 L发酵罐上进行转化,HPLC分析检测转化液中各组分含量。结果如图8所示,前期的转化速率较快,在24 h后反应逐渐减慢,至48 h转化率基本达到最大,共生成2-O-α-D-甘油葡糖苷189.3 g/L,平均转化速率为15.6 mmol/(L·h),蔗糖转化率约为75.1%。可以发现,反应后期继续延长转化时间,转化率变化不明显,出现这种情况的原因,一方面可能是由于反应趋于平衡,另一方面可能是因为转化时间较长,酶活力逐渐丧失。
春节前后,人们都会参加大小的餐饮聚会,不定时定量的饮食往往会引起身体代谢系统的紊乱,而使体内毒素堆积。其中,肝、肾是人体内最重要的两个排毒器官。那么,我们该如何为自己的身体排毒呢?下面就推荐几种天然排除人体毒素的食物,供大家选购。

图8 重组菌B.subtilis 168/pMA5-gtfA在5 L发酵罐全细胞转化合成2-O-α-D-甘油葡糖苷Fig.8 The recombinant B.subtilis 168/pMA5-gtfA whole cells catalyze the synthesis of 2-O-α-D-glucopyranosyl-sn-glycerol in 5 L fermenter.
3 讨论
本研究将肠膜明串珠菌蔗糖磷酸化酶基因gtfA在大肠杆菌中进行克隆表达,研究其酶学性质,再将gtfA基因导入食品安全级枯草芽孢杆菌,用来开发2-O-α-D-甘油葡糖苷合成的全细胞生物催化方法。成功构建重组枯草芽孢杆菌B.subtilis168/pMA5-gtfA,通过优化培养条件,实现了蔗糖磷酸化酶在重组枯草芽孢杆菌胞内的高效表达,并将重组菌用作全细胞生物催化剂合成2-O-α-D-甘油葡糖苷,利用优化后的全细胞转化条件,在30 ℃、pH 7.0、菌体OD600为40、底物蔗糖浓度1 mol/L、甘油浓度2.5 mol/L的条件下,在5 L发酵罐进行全细胞转化48 h后,生成2-O-α-D-甘油葡糖苷189.3 g/L,平均转化速率为15.6 mmol/(L·h),蔗糖转化率约为75.1%,这是目前报道的利用重组枯草芽孢杆菌催化合成2-O-α-D-甘油葡糖苷的最高产量。2-O-α-D-甘油葡糖苷是一种在食品、化妆品、保健品及医药领域有着重大应用前景的高附加值产品,本研究首次利用枯草芽孢杆菌全细胞转化的方法应用于合成2-O-α-D-甘油葡糖苷,与酶法合成相比,全细胞催化发生在胞内,反应更稳定,可重复利用率高,而且省去了酶法催化前期所需破碎细胞的过程,工艺流程更简便,经济效益更高;另外,将食品安全级菌株用作表达宿主,也拓宽了产品在食品、医药领域的应用。然而,在合成2-O-α-D-甘油葡糖苷上,不管是酶法合成,还是全细胞催化方法,最终转化液中都有一定浓度的蔗糖和果糖存在,虽然有研究报道过一种从转化液中分离纯化出2-O-α-D-甘油葡糖苷的方法,但也仅有63%的产品收率[20]。所以,仍需要通过改进下游分离纯化工艺[26],以进一步提高2-O-α-D-甘油葡糖苷收率。总之,本研究所构建的重组枯草芽孢杆菌全细胞催化方法及其相关研究结果,为2-O-α-D-甘油葡糖苷的工业化生产及应用奠定了理论和实验基础。
