随机-半理性组合突变改造ω-转氨酶催化合成(R)-1-(1-萘基)乙胺
2020-04-15曹旭东韩瑞枝方红辉倪晔
曹旭东,韩瑞枝,方红辉,倪晔
1 江南大学 生物工程学院,江苏 无锡 214122
2 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122
(R)-1-(1-萘基)乙胺是一种重要的手性芳香族胺化合物,广泛应用于医药、化工、材料等领域[1]。(R)-1-(1-萘基)乙胺是重要的药物手性中间体,也是其他手性对映体的常用拆分剂和手性助剂,在手性医药工业领域具有重要用途[2]。例如,(R)-1-(1-萘基)乙胺既可用于制备拟钙剂盐酸西那卡塞[3],又可用于拆分外消旋邻苯二甲酸单薄荷酯以制备L-薄荷醇[4]。
迄今为止,用于催化合成手性胺的酶主要包括水解酶[5]、氨裂解酶[6]、单胺氧化酶[7]、胺脱氢酶[8]、还原胺化酶[9]、亚胺还原酶[10]、转氨酶[11]等。ω-转氨酶是一种5′-磷酸吡哆醛 (PLP) 依赖性酶,可将氨基从供体分子转移到前手性酮上,生成相应的手性胺[12]。目前,ω-转氨酶已广泛用于合成许多药物分子,如抗糖尿病药物西他列汀。Merck和Codexis公司通过蛋白质工程策略改造(R) 选择性ω-转氨酶 (ATA-117),通过多轮定点饱和突变、组合突变及随机突变技术,开发出了一种适用于工业化应用的新酶Rd11TA,其催化活性较野生型酶提高28 000倍以上,该酶可将前手性的西他列汀酮转化为西他列汀手性胺分子[13]。与以前的化学催化工艺相比,该生物催化工艺不仅减少了排废并消除了对重金属的需求,还使总产量提高了10%,生产率提高了53%[14]。
手性(R)-1-(1-萘基)乙胺的制备方法有很多,可分为两类。第一类是化学拆分法,即采用(D)-酒石酸作为拆分剂分离外消旋1-(1-萘基)乙胺[15]。但此过程时间较长,产物的光学纯度低并且产生大量废物。第二类是生物催化法,其中包括动力学拆分外消旋胺和不对称合成手性胺。Matthew等[16]将S型ω-转氨酶ATA113与氨基酸氧化酶组合,动力学拆分手性1-(1-萘基)乙胺,获得单一构型的(R)-1-(1-萘基)乙胺,但动力学拆分存在的问题是得率最高为50%。而不对称合成法是直接合成手性产物的方法,这是合成手性药物最经济有效的方法。Marx等[17]以1-萘乙酮为底物,采用Codexis公司市售的转氨酶试剂盒催化制备(R)-1-(1-萘基)乙胺,底物浓度20 mmol/L时转化率为98%,对映体过量 (ee)值大于99%,证明了转氨酶催化不对称合成(R)-1-(1-萘基)乙胺的方法有着一定的应用前景。但随着底物1-萘乙酮浓度的升高,转化率也显著降低,这严重限制了其工业化生产。
近年来对ω-转氨酶进行蛋白质工程改造的策略主要有随机突变、半理性设计和理性设计的策略[18-21]。Yun等[22]使用易错PCR技术构建突变文库,筛选出对2-氨基庚烷、2-氨基-6-甲基庚烷及2-氨基辛烷活力提高1.7–2.0倍的突变酶。Han等[23]对酶活性中心附近的氨基酸残基进行丙氨酸扫描并定点饱和突变,获得了催化活性较野生型酶明显提高的突变酶W58L。Daniel等[24]通过结构分析、分子对接、分子动力学模拟、量子力学计算、计算机蛋白质结构稳定性研究协同进化网络分析和体外筛选的理性设计策略,得到的突变酶不对称合成(1S)-1-(1,1′-联苯-2-基)乙胺的反应速率提高1 716倍以上,并且ee值大于99%。
本研究对节杆菌属 (Arthrobactersp.) 来源的ω-转氨酶ARTA[25](WT) 进行随机突变和半理性设计相结合的突变策略,旨在获得催化效率和热稳定性提高的突变酶,以期能够催化1-萘乙酮合成(R)-1-(1-萘基)乙胺,并为生物催化法制备(R)-1-(1-萘基)乙胺的工业化应用提供潜在生物催化剂。
1 材料与方法
1.1 材料与试剂
菌株与质粒:表达质粒pET28a、表达宿主大肠杆菌Escherichia coliBL21(DE3)、重组质粒pET28a/ BmGDH和pET28a/LpLDH为实验室前期构建保存。pET28a/ARTA由苏州金唯智生物科技有限公司合成。
LB培养基 (g/L):酵母粉5,蛋白胨10,氯化钠10。
酶、试剂、引物和DNA序列测定:限制性核酸内切酶和胶回收试剂盒购自TaKaRa公司。Bradford蛋白浓度测定试剂盒购自生工生物工程(上海) 股份有限公司。引物合成和DNA测序由天霖生物科技有限公司完成。
1.2 易错PCR构建随机突变文库
以pET28a/ARTA为模板,使用引物P1和P2(表1) 进行目的片段扩增。在PCR混合体系中加入100 μmol/L MnCl2用于控制突变概率[26],使得每个基因有1–3个突变位点。将PCR产物进行回收纯化后,并与NdeⅠ和XhoⅠ双酶切得到的线性化pET28a载体连接,然后通过一步克隆法将重组质粒转化到大肠杆菌BL21(DE3) 感受态细胞中。
1.3 高通量筛选方法
挑选单菌落接种至96深孔板中,每孔含300 μL LB培养基和50 μg/mL卡那霉素。37 ℃、120 r/min孵育12 h,取其中50 μL培养物接种至新的96深孔板中,每孔含有600 μL LB培养基和50 μg/mL卡那霉素。37 ℃、120 r/min培养2 h后,加入终浓度为0.2 mmol/L异丙基-β-D-硫代半乳糖苷 (IPTG),25 ℃、120 r/min再培养8 h后,4 ℃、4 000 r/min离心10 min收集细胞。
向收集细胞的96深孔板中加入200 μL溶菌酶溶液 (10 mmol/L磷酸钠 (PBS) 缓冲液,pH 8.0,含有750 mg/L溶菌酶和10 mg/L DNase),37 ℃、120 r/min振荡1 h,4 ℃、4 000 r/min离心10 min,上清即为酶液。
500 μL反应体系包括:100 μL酶液,2 mmol/L 1-萘乙酮,20 mmol/L丙氨酸,0.15 mmol/L PLP,4 U/mL LpLDH酶液,0.2 mmol/L NADH,2 U/mL BmGDH酶液,2 mmol/L葡萄糖,10 mmol/L PBS缓冲液 (pH 8.0),5%乙醇助溶。
30 ℃、120 r/min反应12 h后,4 ℃、4 000 r/min离心10 min,取上清100 μL到酶标板中,并加入100 μL的1 mmol/L酚红后测定OD560,并计算出ΔOD560(ΔOD560=OD560(WT)−OD560(Mutant)),由于ΔOD560的数值间接表示为突变酶相比于WT活力的大小[27],因此△OD560越高即说明该突变酶酶活力越高。
1.4 半理性设计突变酶的构建
ω-转氨酶的催化过程与底物和辅酶PLP都存在一定的相互作用[28],利用Discovery Studio软件(BIOVIA,美国) 的虚拟氨基酸突变模块,以PDB:3wwi (ω-转氨酶ARTA同源性大于99%) 为模板进行虚拟氨基酸突变得到ARTA-WT,并通过分子对接模块对接底物1-萘乙酮,选择底物1-萘乙酮周围6 Å范围及PLP周围4 Å范围内共同的氨基酸残基Tyr67、Trp192、Gly224、Phe225,并对这4个位点进行丙氨酸扫描及定点饱和突变,设计定点突变引物如表1所示。

表1 易错PCR及定点突变引物Table 1 Primers for error-prone PCR and site-directed mutagenesis
以重组质粒pET28a/ARTA为模板,采用全质粒PCR方法进行定点突变,经DpnⅠ消化PCR模板后,将构建的质粒转化到大肠杆菌E.coliBL21(DE3),挑选正确的突变体用于表达。
1.5 WT与突变酶的表达与纯化
将重组大肠杆菌BL21/pET28a/ARTA接种到40 mL LB培养基中 (含50 µg/mL卡那霉素),并于37 ℃、180 r/min培养到至OD600为0.6–0.8,加入终浓度为0.2 mmol/L IPTG,25 ℃、180 r/min继续培养10 h。将培养液于4 ℃、4 000 r/min离心10 min收集细胞。
将收集的细胞溶解在结合缓冲液 (0.5 mol/L NaCl,20 mmol/L咪唑,20 mmol/L PBS缓冲液、5%甘油,pH 7.4) 中,并通过超声处理破碎,4 ℃、12 000 r/min离心10 min,通过0.45 μm过滤器过滤上清液,并用10倍柱体积平衡Ni-NTA亲和层析柱,取10 mL破碎的上清液上样,用10倍柱体积的结合缓冲液洗涤非特异性结合的蛋白质,用15倍柱体积的洗脱缓冲液 (0.5 mol/L NaCl,100 mmol/L咪唑、100 mmol/L PBS缓冲液,5%甘油,pH 7.4) 洗脱蛋白质。收集样品通过超滤管除去残留的咪唑,并用PBS缓冲液 (100 mmol/L,pH 7.0) 置换。通过SDS-PAGE分析鉴定蛋白质样品,使用Bradford方法测定蛋白浓度。
1.6 比活力的测定
酶活力单位 (mU) 定义为:30 ℃、pH 7.0条件下,以1-萘乙酮为底物,每分钟催化产生1 nmol的(R)-1-(1-萘基)乙胺所需的酶量。所有酶活性测定结果均为3次重复试验数据的平均值。
500 μL反应体系中包括:0.2 mg/mL ARTA酶液,2 mmol/L 1-萘乙酮,20 mmol/L丙氨酸,0.15 mmol/L PLP,4 U/mL LpLDH酶液,0.2 mmol/L NADH,2 U/mL BmGDH酶液,2 mmol/L葡萄糖,100 mmol/L PBS缓冲液 (pH 7.0),5%乙醇助溶。
30 ℃、120 r/min反应30 min后,煮沸5 min终止反应,通过HPLC测定底物1-萘乙酮和产物(R)-1-(1-萘基)乙胺的浓度。对于初始速率测量,反应转化率限制在小于20%,并根据酶活力的定义及蛋白浓度计算出比活力。
HPLC检测方法为:用0.22 μm过滤膜将反应液过滤后进行HPLC测定,色谱柱为Diamonsil C18(5 μm,250 mm×4.6 mm),流动相为:乙腈︰水︰乙醇胺=70︰30︰0.05,流速为1 mL/min,UV检测波长为210 nm。
1.7 酶学性质的测定
1.7.1 动力学参数的测定
将1-萘乙酮浓度梯度设定在0–40 mmol/L的底物浓度范围内,同时固定丙氨酸浓度为20 mmol/L,其他条件根据1.6中描述的方法测量纯化后的WT及突变酶的比活力,通过Origin以底物1-萘乙酮浓度为横坐标、比活力为纵坐标作图计算动力学参数的kcat、Km和kcat/Km值。
1.7.2 温度对反应的影响
测定纯化后的WT及突变酶在20–50 ℃(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、50 ℃) 下的比活力,分析WT及其突变酶的最适反应温度。
1.7.3 pH对反应的影响
测定纯化后的WT及突变酶在不同pH值 (pH 5.0–9.0) 下的缓冲液中的比活力,分析WT及其突变酶的最适反应pH。其中缓冲液分别为柠檬酸-柠檬酸钠缓冲液 (pH 5.0、5.5、6.0)、PBS缓冲液(pH 6.0、6.5、7.0、7.5、8.0)、甘氨酸-氢氧化钠缓冲液 (pH 8.0、8.5、9.0)。
1.7.4 热稳定性测定
将纯化后的WT及突变酶分别在30 ℃、40 ℃温度下保温不同时间后,测定其残余的比活力,分析WT及其突变酶的热稳定性。
1.8 酶催化10 mmol/L 1-萘乙酮反应
1 mL反应体系中包括:100 mU/mL WT或突变酶液,10 mmol/L 1-萘乙酮,100 mmol/L 丙氨酸,0.5 mmol/L PLP,10 U/mL LpLDH酶液,1 mmol/L NADH,5 U/mL BmGDH酶液,10 mmol/L 葡萄糖,100 mmol/L PBS缓冲液 (pH 7.0),5%乙醇助溶。
30 ℃、120 r/min反应24 h,期间分别于20 min、40 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h时取样检测转化率。通过HPLC测定不同时间样品的底物1-萘乙酮和产物(R)-1-(1-萘基)乙胺的浓度,并计算出反应转化率绘制反应进程。
1.9 分子对接与分子动力学分析
利用Discovery Studio软件的虚拟氨基酸突变模块,以1.4中ARTA-WT为模板进行虚拟氨基酸突变得到ARTA-F225M/C281I。通过分子对接模块将ARTA-WT和ARTA-F225M/C281I分别对接底物1-萘乙酮,分别分析野生型和F225M/C281I与1-萘乙酮之间的相互作用力。通过分子动力学模拟模块对ARTA-WT和ARTA-F225M/C281I分别进行时长为100 ns的分子动力学模拟,并分析均方根偏移 (RMSD) 和均方根波动 (RMSF)。
2 结果与分析
2.1 随机突变提高ω-转氨酶活力
采用易错PCR方法对WT进行随机突变,以1-萘乙酮作为底物进行高通量筛选,最终从10 000个突变体中获得了一株催化活力提高的突变体,测序结果为C281I。纯化后测得突变体C281I的比活力为 (8.78±0.25) mU/mg,相比于WT的比活力((5.59±0.14) mU/mg) 提高了约57%。
2.2 半理性设计构建突变酶
对Tyr67、Trp192、Gly224、Phe225这4个位点进行丙氨酸扫描,相比于WT,发现只有F225A的比活力有所提升,而Y67A、W192A、G224A的比活力下降明显 (图1A)。因此,对Phe225进行定点饱和突变,获得19种突变酶。
对WT和19种突变酶进行酶活测定,结果表明,突变体F225M比活力最高 (图1B),为(10.07±0.49) mU/mg,与WT相比提高了约80%。将F225M与随机突变筛选到的C281I突变体进行组合突变得到突变体F225M/C281I,其纯酶比活力为 (9.37±0.55) mU/mg,相比WT提高了67%,因此选择突变体F225M、C281I和F225M/C281I为对象进行后续研究。
2.3 WT与突变酶反应动力学分析
将纯化后的突变酶F225M、C281I和F225M/C281I进行酶反应动力学参数分析 (表2),与WT相比,突变体F225M、C281I和F225M/C281I的kcat分别提高了110%、55%和85%,Km分别下降了44%、49%和56%,催化效率kcat/Km分别提高了2.81倍、2.08倍和3.42倍。突变体F225M、C281I和F225M/C281I相比于WT均表现出较低的Km值和较高的kcat值,这表明突变体的催化效率提高归因于酶与底物亲和力的增强[29]。
如表2所示,与WT相比,突变体在30 ℃和40 ℃的半衰期虽有一定提高,但提升并不显著,其中提升最多的F225M/C281I在30 ℃和40 ℃的半衰期分别仅提高了0.64 h和0.33 h。因此,分子改造并未对酶的热稳定性造成显著的影响,仍保持与野生酶相当的半衰期。
以上结果表明,获得的3个突变酶 (特别是F225M/C281I) 对1-萘乙酮底物亲和力以及催化效率均有提高,并保持与野生型相当的热稳定性。
2.4 反应温度及pH对WT和突变酶的影响
反应温度对WT与突变酶F225M、C281I和F225M/C281I的影响如图2A所示。WT和突变酶的最适反应温度均为30 ℃,在20–30 ℃时,比活力随着反应温度升高而上升;在30–50 ℃时,比活力随着反应温度升高而下降。其中在30–35 ℃范围内,WT和突变酶比活力均维持在最高比活力的70%以上。
pH对WT与突变酶反应的影响如图2B所示。WT与突变酶F225M、C281I和F225M/C281I最适反应pH均为7.0。在pH 5.0–7.0范围内时,WT与突变酶比活力随着反应pH的增高而上升;当缓冲液在pH 7.0–8.0范围内,比活力随着反应pH的增高而下降。在pH 6.5–7.5范围内,WT与突变酶比活力均维持在70%以上。

图1 WT及突变体酶比活力 (A:丙氨酸扫描;B:定点饱和突变与组合突变)Fig.1 Specific activities of WT and its mutants.(A) Alanine scanning.(B) Site-directed saturation mutagenesis of Phe225 and combinatorial mutation.

表2 WT及突变体酶学特性Table 2 Enzymatic characterization of WT and its mutants

图2 WT及突变体的最适反应温度 (A) 和最适反应pH (B)Fig.2 Optimum reaction temperature (A) and pH (B) of WT and its mutants.Buffers include sodium citrate buffer(pH 5.0–6.0),PBS buffer (pH 6.0–8.0) and Gly-NaOH buffer (pH 8.0–9.0) were used.
2.5 酶催化10 mmol/L 1-萘乙酮的反应进程
在10 mmol/L的1-萘乙酮底物浓度下,采用0.1 U/mL WT和突变酶。如图3所示,在前2 h反应速率最快,从2 h开始反应开始变缓,到12 h反应基本趋于稳定。反应24 h,突变酶的转化率均较WT有所提高,突变酶F225M、C281I和F225M/C281I的转化率分别为76.79%±1.69%、69.81%±0.70%、78.87%±2.06%,其中突变酶F225M/C281I比WT (64.41%±2.58%) 提高22%。

图3 WT及突变酶不对称还原10 mmol/L 1-萘乙酮的反应进程Fig.3 Time course of asymmetric reduction catalyzed by WT and its mutants at 10 mmol/L 1-acetonaphthone.
2.6 突变体的结构模拟分析
为解析突变体催化效率与稳定性提高的机制,通过Discovery Studio进行分子对接和分子动力学模拟。首先模拟了突变体F225M/C281I突变位点的改变,并进行了与底物1-萘乙酮的分子对接,作用力模拟分析表明 (图4),WT与1-萘乙酮12个氨基酸残基之间分别存在9个范德华力、1个碳氢键和2个Pi-烷基作用力。而突变体F225M/C281I与1-萘乙酮之间除了存在12个范德华力、1个传统氢键、1个Pi-烷基作用力,还存在着2个Pi-Pi T形相互作用力,并且与1-萘乙酮之间存在相互作用力的氨基酸残基增加到16个。因此,相比于WT,突变体F225M/C281I除了由于其亲和力增加了对底物1-萘乙酮的结合之外,底物似乎在结合口袋中更加稳定了,更有利于催化反应的进行[30]。模拟结果与实验测得酶促反应动力学参数Km下降一致,进一步解释了突变体酶活力提高的原因。尽管225位点和281位点远离酶活性中心,不直接参与底物的结合和催化反应,但它们在催化过程中也会起较大的辅助作用,并在酶催化过程中对酶的构象变化起一定作用。

图4 分子对接分析WT (A、B) 及突变体F225M/C281I (C、D) 与底物1-萘乙酮之间的作用力Fig.4 Molecular docking analysis of interactions between WT,variant F225M/C281I and substrate 1-acetonaphthone.(A–B) 3D and 2D views of the interactions between WT and 1-acetonaphthone.(C–D) 3D and 2D views of the interactions between F225M/C281I and 1-acetonaphthone.
分子动力学模拟结果 (图5) 表明,虽然突变酶F225M/C281I与WT的RMSD没有明显变化,但是突变酶F225M/C281I的134–139位点残基的RMSF比WT明显降低。RMSF值通常反映分子动力学模拟过程中单个残基的波动,通过对RMSF数值高的氨基酸残基进行突变也是一种常见的提高蛋白质热稳定性的方法[31]。因此RMSF的降低与热稳定性呈正相关,在此猜想突变体F225M/C281I半衰期略微提高可能是由于Met225和Ile281影响了另一条链的Loop 134–139区的刚性。
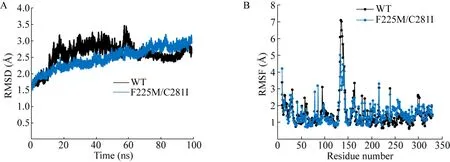
图5 分子动力学模拟分析WT及突变酶F225M/C281IFig.5 Molecular dynamics simulation analysis of WT and variant F225M/C281I.(A) RMSD.(B) RMSF.
3 结论
本研究采用随机突变和半理性设计相结合的策略,对来源于Arthrobactersp.的ω-转氨酶进行蛋白质工程改造,筛选得到对1-萘乙酮具有高催化效率的突变酶F225M、C281I和F225M/C281I。其中F225M/C281I提升最为明显,与WT相比,其kcat提高了85%,Km下降了56%,相应的催化效率kcat/Km提高了3.42倍。在底物1-萘乙酮浓度提高至10 mmol/L时,F225M/C281I反应24 h转化率为78.87%±2.06%,较WT提高了22%。通过Discovery Studio进行分子对接和分子动力学模拟,分析了突变体F225M/C281I相比于WT催化效率提高的原因是增加了与底物1-萘乙酮之间的Pi-Pi T形相互作用力。突变体F225M/C281I的loop区134–139位点残基的均方根波动RMSF相比WT明显降低,与其半衰期略微提高相关。
