海南西海岸4种真红树植物根际土壤细菌多样性及其生物活性研究
2020-04-14韩敏敏李蜜高程海陈秋琪陈春棣钟振国易湘茜
韩敏敏 李蜜 高程海 陈秋琪 陈春棣 钟振国 易湘茜

摘要:【目的】研究海南西海岸真紅树根际土壤细菌多样性及延缓衰老活性和杀线虫活性,挖掘更多潜在新物种和高效活性物质,为红树林微生物资源的开发应用提供参考依据。【方法】以海南西海岸4种真红树植物(红海榄、桐花树、白骨壤和红树)根际土壤为研究对象,采用9种分离培养基(AGG、M4、M5、M7、M9、M10、M11、P3和P7),以稀释涂布法和三线法从真红树根际土壤中分离细菌,通过菌株形态特征观察及16S rRNA序列分析,探讨真红树根际土壤细菌物种多样性;利用秀丽隐杆线虫活体模型对分离获得的细菌发酵产物粗提物进行延缓衰老活性筛选,并采用96孔板法测试细菌发酵产物粗提物的杀线虫活性。【结果】经排重合并及16S rRNA序列比对分析,从真红树根际土壤中分离得到23株根际细菌,隶属于10目11科12属,其中芽孢杆菌属(Bacillus sp.)11株,占分离细菌总数的47.83%,为优势菌属。有2株细菌(IMDGX 6099和IMDGX 6198)的16S rRNA序列与有效发表菌株的相似性低于98.65%,可能为潜在新种。秀丽隐杆线虫模型筛选发现3株细菌(IMDGX 6153、IMDGX 6098和IMDGX 6198)发酵液具有不同程度延缓线虫衰老的活性,有1株细菌(IMDGX 6094)的发酵液对秀丽隐杆线虫具有杀线虫活性,其半数致死浓度(LC50)为192.02 μg/mL。【结论】海南西海岸真红树根际土壤细菌具有较高的物种多样性,蕴藏着丰富的细菌资源,且部分细菌菌株具有延缓衰老和杀线虫活性,在新菌种、生物活性物质的发现及研制新型抗衰老药物和高效生物杀虫剂方面均具有巨大潜力。
关键词: 真红树植物;根际细菌;细菌多样性;延缓衰老活性;杀线虫活性
中图分类号: S154.381 文献标志码: A 文章编号:2095-1191(2020)02-0327-08
Diversity and bioactivity of bacteria in rhizosphere soil of four true mangrove species on the west coast of Hainan
HAN Min-min, LI Mi, GAO Cheng-hai, CHEN Qiu-qi, CHEN Chun-di,
ZHONG Zhen-guo, YI Xiang-xi*
(Institute of Marine Drugs/Guangxi Scientific Research Center of Traditional Chinese Medicine,
Guangxi University of Chinese Medicine, Nanning 530200, China)
Abstract:【Objective】To study the bacterial diversity, anti-aging activity and nematocidal activities of rhizosphere soil of true mangrove in the west coast of Hainan, and to explore more potential new species and highly effective active substances, so as to provide reference for the development and application of mangrove microbial resources. 【Method】With the west coast of Hainan four true mangrove plants(Rhizophora stylosa, Avicennia marina, Avicennia marina and Rhizophora apiculata) rhizosphere soil as the research object, using nine kinds of isolation media(AGG, M4, M5, M7, M9, M10, M11, P3 and P7), bacteria was isolated from true mangrove rhizosphere by dilute coating method and three line method. Through observing the strain morphological characteristics and 16s rRNA gene sequence analysis, the true mangrove rhizosphere bacteria species diversity was explored. The crude extracts from isolated bacterial fermentation products were screened for anti-aging activity by using Caenorhabditis elegans in vivo model, and the nematocidal activity of crude extracts from bacterial fermentation products was tested by 96-well plate method. 【Result】After sequencing, recombination and comparative analysis of 16S rRNA sequence, 23 strains of rhizosphere bacteria were isolated from the rhizosphere soil of mangrove trees, belonging to 10 orders, 11 families and 12 genera. Eleven strains of Bacillus sp. were dominant genus, accounting for 47.83% of the total number of isolated bacteria. Two strains (IMDGX 6099 and IMDGX 6198) had 16S rRNA sequences that shared less than 98.65% similarity with effective strains, which might be potential new species. Three strains of bacteria(IMDGX 6153, IMDGX 6098 and IMDGX 6198) were screened by C. elegans, their fermentation broth had nematicidal activity to various extents. The fermentation broth of one strain (IMDGX 6094) showed nematicidal activity, and its lethal concentration(LC50) was 192.02 μg/mL. 【Conclusion】The rhizosphere bacteria of true mangrove in the west coast of Hainan have high species diversity and rich microbial resources, and some bacterial strains have anti-aging and nematocidal activities. They have huge potential in the discovery of new species, and biological active substances and development of new anti-aging drugs and efficient biological pesticides.
Key words: true mangrove plants; rhizosphere bacteria; plants species diversity; anti-aging activity; nematocidal activity
Foundation item: National Natural Science Foundation of China(41566004); Development Program of High-level Talent Team under Qihuang Project of Guangxi University of Chinese Medicine(2018006); Scientific Research Group Foundation of Institute of Marine Drugs, Guangxi University of Chinese Medicine(2018ZD005-A06); Research Laun-ching Fund Project for Guangxi University of Chinese Medicine Introduced Doctors(2017BS039)
0 引言
【研究意義】2017年国家统计局发布的最新人口数据显示,60周岁及以上老年人口比重为17.3%(殷勇,2019),预示着我国已进入老龄化的快速发展阶段。随着全球人口老龄化趋势日趋严重,衰老及衰老相关问题已成为世界各国共同面临的紧要问题。结合当前社会需求背景及现代医学科技手段,研制开发抗衰老药物具有可观的研究前景与价值。近年来,随着环境绿化程度的不断加深,植物病虫害防治也成为人们关注的焦点。植物病虫害问题严重危害着我国乃至全世界农作物,致使作物受到不同程度的侵害,最终导致农作物减产甚至绝收。据报道,植物线虫病对全球21种主要农作物造成的损失每年可高达1000亿美元(胡玉金等,2019)。世界范围内线虫病害占植物病害的15%~20%,由此造成的经济损失可达1570亿美元(余威,2019)。因此,寻找新型高效的生物杀虫剂已成为当前植保领域的重要任务。1963年,英国科学家Brenner首次发现秀丽隐杆线虫(Caenorhabditis elegans)成虫是研究发育生物学和神经生物学理想的模型动物(Brenner,1974)。秀丽隐杆线虫因具有细胞数目少、全身通透、含有大多数动物神经系统的成分分子、基因组序列测序完整、生命周期短和遗传背景清晰等特点,已成为遗传学、细胞生物学、分子生物学研究领域的重要模式材料(Greer et al.,2015;Koopman et al.,2016)。目前线虫模型已广泛应用于神经退行性疾病、抗衰老、抗肿瘤和抗菌药物筛选,也常用于脂质代谢糖尿病及慢性疲劳综合症等疾病的药物筛选研究,发展前景十分广阔;此外,由于线虫在药物筛选方面具有无需药物诱导即可造模、能够稳定遗传等优势,使线虫模型逐渐成为药物高通量筛选平台(Kaletta and Hengartner,2006;许巧等,2015)。因此,以线虫模型来模拟人类疾病是最简单直接且有效的建模手段之一。【前人研究进展】近年来,我国科研人员从红树林植物中分离出放线菌和真菌资源,但相比之下对细菌的研究报道较少。刘慧杰等(2010)采用PCR-DGGE和DGGE指纹图谱对福建省九龙江口红树林区的微生物群落结构及基因多样性进行分析,发现红树林区细菌多样性远大于非红树林区域。夏丽娟等(2014)从桐花、秋茄、白莲、木榄和老鼠簕等5种真红树根际土壤中分离得到50株真菌,其中有16株真菌对多种球菌有抑菌活性,占总分离菌株的30.77%,且对金黄色葡萄球菌的拮抗率最高达32.00%。曹阳等(2018)从西门岛红树林根系沉积物样品中共分离到128株海洋细菌,检测发现31株能产生群体感应信号分子AHLs,占可培养海洋细菌总数的24%,均为变形菌门细菌。李小群等(2018)从广西北仑河口红树林底泥中分离得到36株放线菌,有22株放线菌对甘蔗鞭黑粉菌有抑制作用,占所分离放线菌总数的61.11%。叶景静等(2018)从8份红树林根际土壤样品中共分离获得88株放线菌,分属于6目8科9属,优势菌属为小单孢菌属和链霉菌属;14株放线菌中,有7株具良好抗菌活性,阳性率为50.00%,其中4株分别对粪肠球菌或表皮球菌有一定抑制效果。【本研究切入点】海南西海岸红树林区是我国南海热带海岸特有的自然景观,植物种类齐全,物质积累丰富,加上独特的热带雨林气候,使其具有丰富的生物多样性。但目前对该生境中细菌的多样性研究报道较少,且在活性研究方面,尤其是针对延缓衰老和杀线虫活性的研究鲜见报道。【拟解决的关键问题】从海南西海岸红树林区采集4种真红树植物(红海榄、桐花树、白骨壤和红树)根际土壤样品,对其根际细菌进行分离并研究其多样性,结合16S rRNA序列分析及生物模型筛选具有延缓衰老活性和杀线虫活性菌株,为红树林微生物资源的开发应用提供参考依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 样品采集 供试真红树根际土壤样品于2017年7月采集于海南西海岸海域。样品采集方法:用取样工具挖取表层5 cm左右的土壤,采用抖落法收集根际土壤,装入作好标记的取样瓶中立即拧紧盖子,置于采样冰盒中24 h内运回实验室,-20 ℃冰箱中保存备用。样品采集信息见表1。
N2野生型秀丽隐杆线虫(雌雄同体)和尿嘧啶缺陷型大肠杆菌(Escherichia coli OP50)均由广西科学院汪斌博士惠赠。
1. 1. 2 主要试剂及仪器设备 主要试剂:PCR引物及相关试剂均购自生工生物工程(上海)股份有限公司,Chelex-100树脂购自伯乐生命医学产品有限公司,其他有机试剂均为国产分析纯。主要仪器设备:Olympus SZX16体视镜[奥林巴斯(北京)销售服务有限公司]、SPH-200B振荡培养箱(上海知楚仪器有限公司)、超净工作台(北京亚泰科隆仪器有限公司)、恒温培养箱(上海博讯实业有限公司)、凝胶成像仪(美国BioRad公司)、Systerc VB-75灭菌锅(日本Sanyo公司)、小型离心机(德国Sigma公司)、电泳仪(北京市六一仪器厂)、B-100旋转蒸发仪(上海沃珑仪器有限公司)和PCR扩增仪(伯乐生命医学产品有限公司)。
1. 1. 3 培养基 9种分离培养基分别为AGG、M4、M5、M7、M9、M10、M11、P3和P7等;纯化及保藏培养基为改良ISP2固体培养基;发酵培养基为改良ISP2液体培养基。
1. 2 试验方法
1. 2. 1 细菌分离纯化 新鲜土壤样品置于无菌平皿中,室温下在超净工作台内自然风干后,用无菌研钵研磨成粉末状。称取2.0 g土壤样品,将其倒入装有20.0 mL无菌水的锥形瓶中,手动摇匀;依次稀释至10-3和10-4组织悬液,分别取组织悬液0.2 mL接种于9种分离培养基上,于28 ℃恒温培养箱中培养14~30 d,观察菌落形态特征,挑选表面光滑的单菌落,使用改良ISP2培养基进行分离纯化,通过稀释涂布法和三线法划线纯化,如有杂菌则进行二次或多次纯化,直至获得纯净的单菌落,同时记录菌落数及菌落形态特征。纯化后的菌株制成20%(v/v)的菌悬液,采用甘油管冷藏法进行保存。
1. 2. 2 PCR扩增和16S rRNA序列系统发育分析
提取菌株DNA及16S rRNA序列测定,参照周双清等(2010)Chelex-100 Resin法进行菌株DNA提取,PCR扩增参照Walsh等(1991)的方法。采用細菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行16S rRNA序列扩增。PCR扩增程序:95 ℃预变性5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,进行35个循环。采用1%琼脂糖凝胶电泳检测PCR扩增产物,Bio-RAD凝胶成像系统观察电泳结果。条带合格后委托上海美吉生物医药科技有限公司广州分公司进行DNA测序。测序结果采用DNA STAR处理,登陆数据库EzBioCloud(https://www.ezbiocloud.net/)(Kim et al.,2009)进行相似性比对搜索,从中选取同源性最高典型菌株的16S rRNA序列作为参比对象。
1. 3 细菌菌株活性试验
1. 3. 1 粗提物制备 参考覃媚等(2016)的方法,将分离获得的细菌菌株培养至对数生长期后分别接种于200.0 mL ISP2液体培养基中发酵7 d,离心收集发酵液,立即用乙酸乙酯萃取,取乙酸乙酯层减压浓缩备用;收集粗提物,置于干燥器中低温保存,用于延缓线虫衰老活性的初步筛选及杀线虫活性试验。
1. 3. 2 NGM(Nematode growth medium)培养基配制 参照Brenner(1974)的方法,1000.0 mL NGM培养基中含3.00 g NaCl、2.50 g蛋白胨、17.00 g琼脂、25.0 mL K3PO4 缓冲液(含3.56 g K2HPO4、10.83 g KH2PO4,加水至100.0 mL)、975.0 mL蒸馏水,灭菌后加入抽滤除菌的5 mg/mL胆固醇溶液1.0 mL、1 mol/L MgSO4 溶液1.0 mL和1 mol/L CaCl2 溶液1.0 mL。
1. 3. 3 线虫培养方法 参照Brenner(1974)的方法,将线虫挑至含E. coli OP50的NGM培养基中,于恒温培养箱中20 ℃培养(秀丽隐杆线虫最佳生存温度20~25 ℃,实验室培养温度一般设定为20 ℃的标准条件以保证线虫正常生存)。线虫同期化采用高氯酸钠裂解法,即将正处于产卵期的雌雄同体线虫用已灭菌、预冷的M9缓冲液清洗虫体,从NGM培养基上冲洗至无菌的离心管中。向离心管中加入1∶3的裂解液,手动摇匀混合3~5 min,于离心机中3000 r/min离心30~60 s,弃上清液收集沉淀。沉淀用已灭菌的M9溶液反复清洗2~3次,再转至含E. coli OP50的NGM培养基中,20 ℃培养48 h后即可用于后续试验。
1. 3. 4 延缓衰老活性试验 细菌粗提物样品用1% DMSO溶液超声波溶解制成500 μg/mL药液,4 ℃保存备用。将培养好的L4期线虫挑至加有50 μL药液的NGM培养基中,以1% DMSO溶液为空白对照,生化培养箱中恒温20 ℃培养,每组2板,每板20条线虫,此时线虫寿命天数记为0 d。此后,隔天对培养基中的线虫进行计数,每天观察并记录线虫生存、死亡及剔除的数量,将线虫每2 d转移至新的含药液NGM培养基中,直至线虫全部死亡。
1. 3. 5 杀线虫活性试验 参照许敏等(2016)的方法,将同期化后的线虫从培养基上洗下至1.5 mL EP管中,用M9缓冲液稀释线虫,使其浓度约1条/μL。在超净工作台上,将20 μL线虫液加至96孔板中,再加入5 μL甲醇溶解的细菌发酵液粗提物(浓度为500 μg/mL),用M9缓冲液补足至100 μL后,20 ℃培养24 h后在体视显微镜下观察并记录线虫总数和死亡数。另设1 μg/mL阿维菌素阳性组和5%甲醇溶液阴性对照组。
1. 3. 6 线虫半数致死浓度(LC50)测定 将75 μL新鲜M9缓冲液加至96孔板中,同时加入20 μL线虫液(1条/μL)。利用倍半稀释法,将活性菌株(IMDGX 6094)的乙酸乙酯提取浓缩物用甲醇稀释,使终浓度分别为1000、500、250和125 μg/mL,取5 μL置于96孔板中,置于20 ℃的培养箱培养24 h后在体视显微镜下观察。虫体僵直,振荡30 s仍僵直判定为线虫死亡,计算线虫致死率,计算公式:线虫致死率(%)=线虫死亡数/线虫总数×100,以线虫致死率>50%为阳性结果。再以样品浓度为横坐标、致死率为纵坐标作图,采用Probit法分别计算活性菌株的LC50。
1. 4 统计分析
线虫寿命数据及杀线虫数据均采用SPSS 21.0进行统计分析,采用GraphPad Prism 5.0绘图,利用DNASTAR整理细菌16S rRNA序列。
2 结果与分析
2. 1 真红树根际土壤细菌物种多样性分析结果
采用9种分离培养基从真红树根际土壤中分离获得49株细菌,根据16S rRNA序列对比排重,得到23株根际细菌,隶属于2门4纲10目11科12属,其中芽孢杆菌属11株,占所分离细菌总数的47.83%,为优势菌属(表2)。根据细菌16S rRNA序列比对分析结果,菌株IMDGX 6099和IMDGX 6198与有效发表菌株B. hwajinpoensis SW-72T和S. rhizophila DSM 14405T的最高相似性分别为98.04%和98.32%,根据细菌16S rRNA序列相似性低于98.65%的菌株属于潜在新属或新种的归类原则(Kim et al.,2014),推测IMDGX 6099和IMDGX 6198可能为潜在新细菌物种。
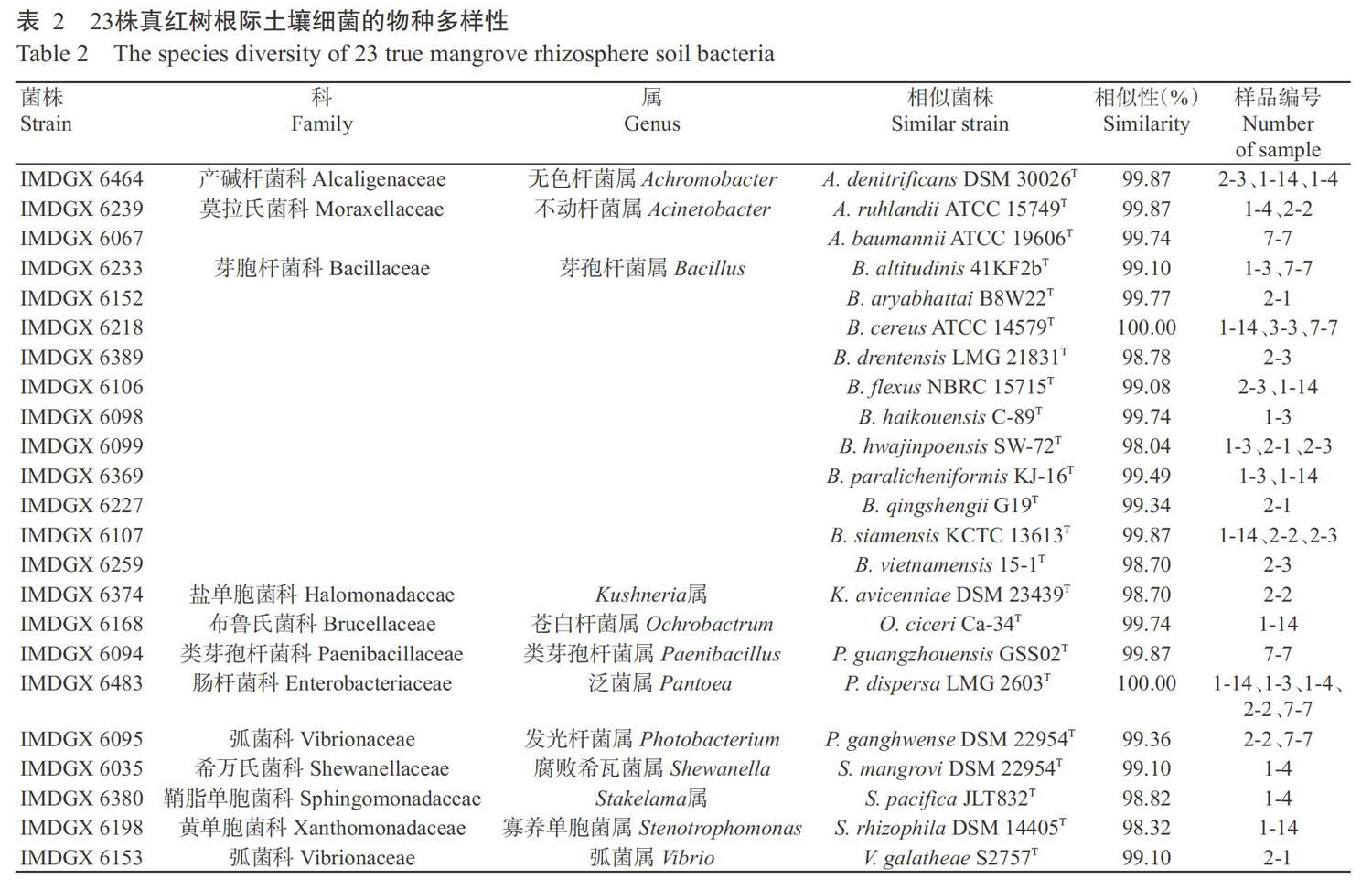
2. 2 23株根际土壤细菌在不同土壤样品及培养基中的分布情况
由表2和图1可知,来源于不同土壤样品的细菌种类和数量存在一定差异,其中,来源于红海榄的1-14样品分离获得的细菌数量最多,共8株,包括苍白杆菌属、芽孢杆菌属、泛菌属、寡养单胞菌属和无色杆菌属;1-3和2-3样品均分离到芽孢杆菌属,2-2样品分离到不动杆菌属、泛菌属、发光杆菌属和Kushneria属,1-4样品分离到无色杆菌属、不动杆菌属、泛菌属、腐败希瓦菌属和Stakelama属,7-7样品分离到不动杆菌属、芽孢杆菌属、类芽孢杆菌属和发光杆菌属;来源于桐花树的2-1样品中主要分离到芽孢杆菌属的细菌,虽然分布种属数量少,但分布广泛。
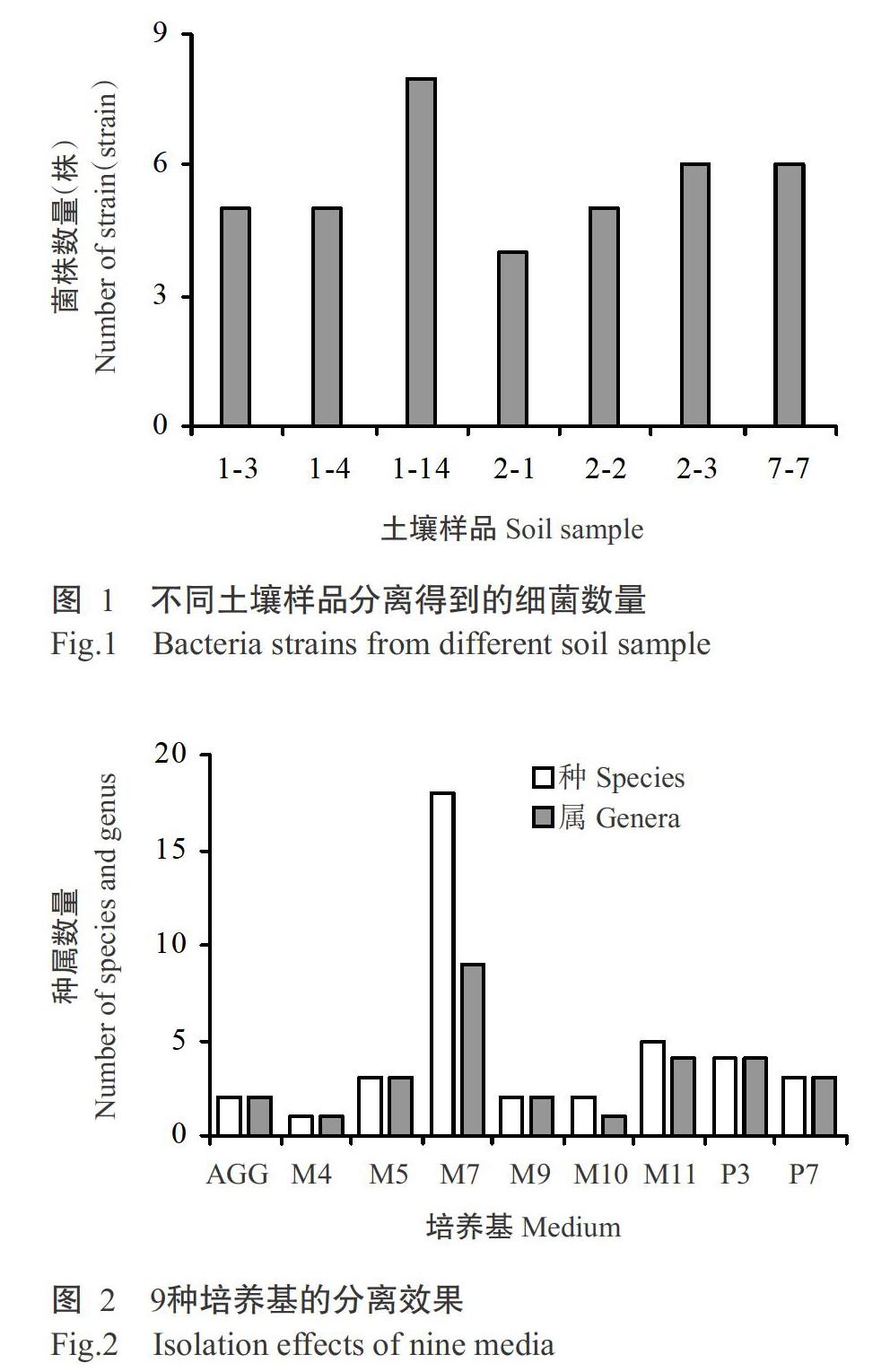
由图2可知,9种培养基分离得到的细菌数量差异较大,其中M7分离到的菌株最多,且菌属最丰富,共有9个属;其次是M11培养基,分离到4个属;AGG、P3、P7、M4、M5、M9和M10培养基均分离到芽孢杆菌属,且为优势菌属。由此可见,M7培养基有利于真红树根际土壤细菌的分离纯化,且分离到的细菌种类丰富,可作为红树林土壤细菌的首选分离培养基。
2. 3 细菌发酵产物延缓线虫衰老活性试验结果
以23株真红树植物根际土壤细菌的发酵产物为材料,秀丽隐杆线虫经典模型为对象筛选具有延缓线虫衰老活性的菌株,结果(表3)显示,菌株IMDGX 6153、IMDGX 6098和IMDGX 6198均具有不同程度的延长线虫寿命作用;差异显著性分析结果表明,菌株IMDGX 6198处理下线虫的平均寿命与空白组相比差异显著(P<0.05),而菌株IMDGX 6098和IMDGX 6153处理下线虫的平均寿命与空白组相比达极显著差异水平(P<0.01),菌株IMDGX 6098和IMDGX 6153延长线虫寿命的程度高于菌株IMDGX 6198。其中,菌株IMDGX 6153是从桐花树根际土壤中分离获得,菌株IMDGX 6098和IMDGX 6198是从红海榄根际土壤中分离获得,说明红海榄根际土壤是强活性微生物的高产环境。寿命是反映机体衰老的直接指标之一(张丽梅,2018),经对线虫寿命周期分析可知,3株真红树根际土壤细菌均能延长线虫寿命,活性菌株IMDGX 6153、IMDGX 6098和IMDGX 6198与空白组相比,其平均寿命分别提高27.49%、23.94%和10.54%,最大寿命分别提高36.36%、27.79%和13.87%。
2. 4 细菌发酵产物杀线虫活性测定结果
采用96孔板法对真红树植物根际土壤细菌发酵产物进行杀线虫活性测定,结果(表4)显示,菌株IMDGX6094(P. guangzhouensis)发酵产物对线虫的致死率最高,为55.00%,LC50为192.02 μg/mL(图3);其余细菌菌株发酵产物对线虫的致死率较低,均在35.00%以下。
3 讨论
真红树植物生长在强辐射、高盐、低氧、低光照、高压及强还原性等特征的海岸潮间带,为独特的海洋微生物提供了巨大的生存空间(Takahashi and Omura,2003)。红树林生态系统蕴藏着丰富且极具特色的海洋微生物资源。据报道,自2007年以来已从红树林生境中分离和鉴定出66个新种和8个新属(Jiang et al.,2018)。基于该生态系统资源丰富,红树林已成为新型生物活性代谢物的主产区(Jiang et al.,2015)。同时,该生态系统的特殊性造就了其植物根际土壤中微生物物种的多样性,且富含大量已知和未知的新种属微生物(Cheng et al.,2019),在新菌种、生物活性物质的发现及产生新药药效方面均具有巨大潜力。
本研究从海南西海岸真红树根际土壤中分离获得2株疑似潜在新菌株,即来源于1-3、2-1和2-3样品的IMDGX 6099(Bacillus sp.)和1-14样品的IMDGX 6198(Stenotrophomonas sp.),其与有效发表菌株B. hwajinpoensis SW-72T和S. rhizophila DSM 14405T的16S rRNA序列相似性均低于98.65%。鉴于新物种发现生物活性的潜力相对较大,为此开展了延缓衰老活性分析,结果发现其中1株细菌IMDGX 6198具有延缓线虫衰老的活性,能在一定程度上延长线蟲平均寿命周期。Alavi等(2013)报道菌株S. rhizophilac DSM14405T具有促进植物生长、保护根系免受生物胁迫和非生物胁迫的能力,在生物防治方面具有巨大的应用潜力。Kumar和Manjunatha(2015)从油质污染土壤堆肥中分离到Stenotrophomonas rhizophila (PM-1),经检测具有潜在的多环芳烃和原油利用能力;延缓衰老活性筛选结果显示,有3株活性菌株均有不同程度的延长线虫寿命周期的活性。本研究筛选出的活性菌株IMDGX 6198与有效发表菌株S. rhizophila DSM 14405T具有较高的序列相似性,该菌株能延长线虫寿命周期,与Alavi等(2013)的研究结果一致。海南西海岸红树林土壤微生物兼具物种多样性和生物活性多样性,不仅丰富了延缓衰老活性菌株,还为挖掘新型活性物质提供了研究依据。
在设计筛选杀虫活性物质策略上,早期活性初筛主要是利用小型活体动物,是人们从微生物筛选杀虫活性物质常用的方法之一。结合从红树林生境发现细菌新物种和新型活性物质的研究主要集中在土壤上(杜萍等,2014),以及有关海洋微生物菌株杀线活性的报道(陶玲等,2012;许敏等,2016),本研究初步探讨了真红树根际土壤细菌的杀线虫活性,发现IMDGX 6094(P. guangzhouensis)(类芽孢杆菌属)具有杀线虫活性,有望开发成一种对环境影响小、安全高效的杀线虫剂。鉴于红树林土壤细菌的分布密度,结合近年来各红树林保护区细菌新物种、新活性化合物的发现及本研究中延缓线虫衰老活性和杀线虫活性筛选结果,可确定的是海南西海岸红树林植物根际土壤细菌物种多样性丰富,但生物活性研究报道不多,尤其关于延缓衰老的活性鲜有报道。本研究发现3株延缓线虫衰老菌株,说明其代谢产物中可能包含新的化合物,从而赋予菌株延缓衰老的活性。但对于菌株延缓线虫衰老的作用机制仍不清楚,有待于进一步开展相关试验验证及深层次研究。
4 结论
采用9种分离培养基对海南西海岸红树林4种真红树植物根际土壤进行细菌分离及鉴定,共分离获得23株细菌,归属于2门4纲10目11科12个属,并从中筛选出3株具有延缓衰老活性的细菌及1株杀线虫细菌,表明真红树根际土壤中细菌种类丰富,且富含独特的生物活性菌株,在新菌种、生物活性物质的发现及研制新型抗衰老药物和高效生物杀虫剂方面均具有巨大潜力。
参考文献:
曹阳,裘娟萍,余志良. 2018. 西门岛红树林细菌种群及群体感应细菌的分析[J]. 科技通报,34(10):93-100. [Cao Y,Qiu J P,Yu Z L. 2018. Analysis of cultural bacterial po-pulation and quorum sensing bacteria in mangrove forest sediment at Ximen Island[J]. Bulletin of Science and Technology,34(10):93-100.]
杜萍,刘晶晶,曾江宁,陈全震,朱旭宇,高瑜. 2014. 西门岛红树林沉积物细菌分布与环境特征[J]. 海洋环境科学,33(5):763-771. [Du P,Liu J J,Zeng J N,Chen Q Z,Zhu X Y,Gao Y. 2014. Bacteria distribution and environmental characteristics in the sediment of Ximen Island mangrove[J]. Marine Environmental Science,33(5):763-771.]
胡玉金,冯敏,郭文秀,于毅. 2019. 作物根结线虫病害综合防治技术概述[J]. 山东农业科学,51(4):149-156. [Hu Y J,Feng M,Guo W X,Yu Y. 2019. Overview of integrated control techniques of root-knot nematode disease[J]. Shan-dong Agricultural Sciences,51(4): 149-156.]
李小群,于清武,易湘茜,郝二伟,马亮,颜栋美,高程海. 2018. 广西北仑河口红树林底泥放线菌多样性及其抑制甘蔗鞭黑粉菌活性分析[J]. 南方农业学报,49(4): 708-713. [Li X Q,Yu Q W,Yi X X,Hao E W,Ma L,Yan D M,Gao C H. 2018. Diversity of actinomycetes isolated from bottom mud of mangrove forest in Beilun Estuary of Guangxi and its antibacterial activity against Sporisorium scitamineum[J]. Journal of Southern Agriculture,49(4): 708-713.]
刘慧杰,杨彩云,田蕴,林光辉,郑天凌. 2010. 基于PCR-DGGE技术的红树林区微生物群落结构[J]. 微生物学报,50(7): 923-930. [Liu H J,Yang C Y,Tian Y,Lin G H,Zheng T L. 2010. Analysis of microbial community structure in mangrove sediments by PCR-DGGE technique[J]. Acta Microbiologica Sinica,50(7): 923-930.]
覃媚,于清武,竺利波,李菲,颜栋美,余炼,高程海. 2016. 三种江蓠共附生细菌多样性及抑菌活性分析[J]. 南方农业学报,47(11): 1966-1973. [Qin M,Yu Q W,Zhu L B,Li F,Yan D M,Yu L,Gao C H. 2016. Diversity of epiphytic bacteria of three species of Gracilaria and their bacteriostatic activities[J]. Journal of Southern Agriculture,47(11): 1966-1973.]
陶玲,旭格拉·哈布丁,韩宁宁,余生艳,闫蕾蕾,栾迎春,刘少偉,郭琳,蒋忠科,余利岩,孙承航. 2012. 红树林植物内生放线菌I07A-01824发酵液中杀线虫活性成分的分离、纯化与鉴定[J]. 中国医药生物技术,7(1): 5-8. [Tao L,Habden X,Han N N,Yu S Y,Yan L L,Luan Y C,Liu S W,Guo L,Jiang Z K,Yu L Y,Sun C H. 2012. Separation,purification and structural identification of an active nematicidal component from the fermentation broth of Endophytic streptomyces I07A-01824 from mangrove ecosystem[J]. Chinese Medicinal Biotechnology,7(1): 5-8.]
夏丽娟,张焜,黄华容,张占生. 2014. 5种红树根际土壤真菌和内生真菌的分离及抑菌活性的研究[J]. 中国农学通报,30(4):259-263. [Xia L J,Zhang K,Huang H R,Zhang Z S. 2014. The antimicrobial activity of 5 kinds of mangrove fungi in rhizosphere soil and endophytic fungi[J]. Chinese Agricultural Science Bulletin,30(4): 259-263.]
许敏,李静,戴素娟,高春燕,刘佳萌,庹利,王飞飞,李小俊,刘少伟,蒋忠科,罗辉,张海涛,江黎明,孙承航. 2016. 广东湛江红树林植物内生放线菌资源勘探及生物活性研究[J]. 中国抗生素杂志,41(1): 26-34. [Xu M,Li J,Dai S J,Gao C Y,Liu J M,Tuo L,Wang F F,Li X J,Liu S W,Jiang Z K,Luo H,Zhang H T,Jiang L M,Sun C H. 2016. Study on diversity and bioactivity of actinobacteria isolated from mangrove plants collected from Zhanjiang in Guangdong Province[J]. Chinese Journal of Antibiotics,41(1): 26-34.]
许巧,许湘,王平. 2015. 福苓方对秀丽隐杆线虫寿命的影响[J]. 中国实验方剂学杂志,21(4): 171-173. [Xu Q,Xu X,Wang P. 2015.Effect of fuling prescription on life-span of Caenorhabditis elegans[J]. Chinese Journal of Experimental Traditional Medical Formulae,21(4):171-173.]
叶景静,郑红芸,吴越,蒋莲秀,陈建宏,黄庶识,黄大林. 2018. 广西茅尾海红树林植物根际土壤放线菌多样性及抗菌活性研究[J]. 中国病原生物学杂志,13(11): 1221-1226. [Ye J J,Zheng H Y,Wu Y,Jiang L X,Chen J H,Huang S S,Huang D L. 2018. Diversity and antimicro-bial activity of actinobacteria isolated frommangrover rhizosphere soil in the Maowei Sea of Guangxi[J]. Journal of Pathogen Biology,13(11): 1221-1226.]
殷勇. 2019. 人口老龄化对东北亚地区经济的影响——中日韩比较[J]. 商業经济,(8): 120-122. [Yin Y. 2019. The influence of aging population on the economy of northeast Asia—A comparison between China,Japan and South Korea[J]. Business & Economy,(8): 120-122.]
余威. 2019. 农作物栽培及病虫害防治技术[J]. 农家参谋,(16):4. [Yu W. 2019. Techniques of crop cultivation and pest control [J]. The Farmers Consultant,(16): 4.]
张丽梅. 2018. 紫山药多糖抗衰老活性及其机制研究[D]. 北京: 中国农业大学.[Zhang L M. 2018. Effect of purple yam polysaccharides(PYPs) on anti-aging activity and its mechanism[D]. Beijing: China Agricultural University.]
周双清,黄小龙,黄东益,胡新文,陈吉良. 2010. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报,24(2): 123-125. [Zhou S Q,Huang X L,Huang D Y,Hu X W,Chen J L. 2010. A rapid method for Extracting DNA from actinomycetes by Chelex-100[J]. Biotechnology Bulletin,24(2): 123-125.]
Alavi P,Starcher M R,Zachow C,Müller H,Berg G. 2013. Root-microbe systems: The effect and mode of interaction of stress agent(SPA)Stenotrophomonas rhizophila DSM 14405T[J]. Frontiers in Plant Science,4:141.
Brenner S. 1974. The genetics of Ceanorhabditis elegans[J]. Genetics,77(1): 71-94.
Cheng J,Xue L L,Zhu M,Feng J Y,Shen-Tu J,Xu J M,Brookes P C,Tang C X,He Y. 2019. Nitrate supply and sulfate-reducing suppression facilitate the removal of pentachlorophenol in a flooded mangrove soil[J]. Environmental Pollution,244: 792-800.
Greer E L,Blanco M A,Gu L,Sendinc E,Liu J Z,Aristiza-Corrales D,Hsu C H,Aravind L,He C,Shi Y. 2015. DNA methylation on N6-Adenine in C-elegans[J]. Cell,161(4): 868-878.
Jiang Z K,Guo L,Chen C,Liu S W,Zhang L,Dai S J,He Q Y,You X F,Hu X X,Tuo L,Jiang W,Sun C H. Xiakemycin A. 2015. A novel pyranonaphthoquinone antibio-tic,produced by the Streptomyces sp. CC8-201 from the soil of a karst cave[J]. The Journal of Antibiotics,68(12): 771-774.
Jiang Z K,Tuo L,Huang D L,Osterman I A,Tyurin A P,Liu S W,Lukyanov D A,Sergiev P V,Dontsova O A,Korshun V A,Li F N,Sun C H. 2018. Diversity,novelty,and antimicrobial activity of endophytic actinobacteria from mangrove plants in Beilun Estuary National Nature Reserve of Guangxi,China[J]. Frontiers in Microbiology,9: 868-879.
Kaletta T,Hengartner M O. 2006. Finding function in novel targets: C-elegans as a model organism[J]. Nature Reviews Drug Discovery,5(5): 387-398.
Kim K H,Roh S W,Chang H W,Nam Y D,Yoon J H,Jeon C O,Oh H M,Bae J W. 2009. Nitratireductor basaltis sp. nov. isolated from black beach sand[J]. International Journal of Systematic and Evolutionary Microbiology,59(1): 135-138.
Kim M,Oh H S,Park S C,Chun J. 2014. Towards a taxono-mic coherence between average nucleotide identity and 16S rRNA gene sequence similarity for species demarcation of prokaryotes[J]. International Journal of Systema-tic and Evolutionary Microbiology,64(2): 346-351.
Koopman M,Michels H,Dancy B M,Kamble R,Mouchiroud L,Auwerx J,Nollen E A A,Houtkooper R H. 2016. A screening-based platform for the assessment of cellular respiration in Caenorhabditis elegans[J]. Nature Protocols,11(10):1798-1816.
Kumar S V P,Manjunatha B K. 2015. Studies on hydrocarbon degradation by the bacterial isolate Stenotrophomonas rhizophila(PM-1) from oil spilled regions of Western Ghats of Karnataka[J]. Science,Technology and Arts Research Journal,4(3): 139.
Takahashi Y,Omura S. 2003. Isolation of new actinomycete strains for the screening of new bioactive compoundsl[J]. Journal of General and Applied Microbiology,49(3): 141.
Walsh P S,Metzger D A,Higuchi R. 1991. Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material[J]. Biotechniques,10(4): 506-513.
