碱性成纤维细胞生长因子在富集结直肠癌肿瘤干细胞中的作用
2020-04-14周国俊冯彦超黄理政孙成杰吴妮莎侍琳雷蕾钟晓蓉冷政伟
周国俊,冯彦超,黄理政,孙成杰,吴妮莎,侍琳,雷蕾,钟晓蓉,冷政伟
(川北医学院附属医院 肝胆外科二/肿瘤干细胞研究中心,四川 南充 637000)
肝癌的发病率及死亡率在世界范围内逐年上升[1],从组织学上可将肝癌分为原发性肝癌和转移性肝癌,其中转移性肝癌致死率更高。全球27个肝脏外科中心共3 765例病例分析发现,结直肠癌肝转移(colorectal cancer liver metastasis,CRLM)占比已经超过肝细胞癌(hepatocellular carcinoma,HCC) (56.4%vs43.6%)。国内HCC发病率相对较高,CRLM有明显增长[2],目前转移性肝癌治疗上主要依赖早期诊断结合手术、放化疗、靶向药物等针对肿瘤细胞群的综合治疗[3],然而耐受治疗的肿瘤细胞却引起了肿瘤的转移、复发,从而导致患者死亡。有科学家们认为,这一类细胞主要是由肿瘤干细胞(cancer stem cells,CSCs)组成[4]。所以,获取CSCs并进行研究可能为靶向治疗转移性肝癌提供新的方法。
在转移性肝癌中,绝大部分为结直肠癌肝转移[5],进一步研究证实是结直肠癌CSCs介导了CRLM。目前结直肠癌CSCs的筛选和富集常通过CSCs表面分子为标记进行免疫磁珠或流式细胞分选(flow cytometry,FCM)[6]的方法实现,但此方法获取的CSCs不仅数量少而且价格昂贵,难以广泛应用[7-8]。Cariati等[9]研究发现,无血清悬浮培养可得到具有CSCs特性的球细胞,为CSCs的获取提供了替代方法。主要的培养方案为向DMEM/F12培养基中加入胰岛素、B27等基础物质后,再加入上皮细胞生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)[10-11]。bFGF可支持并诱导干细胞的自我更新及多能性,bFGF单独使用也可富集CSCs[12-13],但采用何种浓度的bFGF培养基及培养多长时间可最大效率地富集CSCs仍未有确切的答案。因此,本实验以结直肠癌细胞为模型,以三种不同浓度的bFGF培养基分别设置10 d、20 d、30 d三个时间梯度富集CSCs,利用流式细胞术、Real-time PCR及Sphereforming assay方法鉴别并比较各组球细胞的肿瘤细胞特性,探究出碱性成纤维细胞生长因子(bFGF)在富集结直肠癌CSCs的最佳浓度及时间,为针对结直肠癌肝转移的治疗提供策略。
1 材料和方法
1.1 材料
人结直肠癌DLD-1细胞系购买自美国模式培养物集存库ATCC(American Type Culture Collection,ATCC),DMEM/F12培养基以及1640培养基购于美国Hyclone公司,碱性成纤维细胞生长因子(bFGF)购自美国PeproTech公司,Gibco胎牛血清购于美国Amresco公司,胰岛素采购于美国Sigma公司,B27因子购自美国Invitrogen公司,CD133-PE、CD44-FITC及相应同型对照流式抗体购自德国Miltenyi公司,PCR试剂盒为Takara反转录试剂盒,引物由美国Invitrogen公司合成。
1.2 实验方法
1.2.1 实验分组:DMEM/F12培养基+10%胎牛血清白蛋白(BSA)+5 mg/mL胰岛素+B27细胞培养添加剂(1:50)+100 U/mL链霉素+0.1 mg/mL青霉素+不同浓度的碱性成纤维细胞生长因子,将分别加入5 ng/mL、10 ng/mL、20 ng/mL bFGF分组为G1、G2、G3组。
1.2.2 细胞培养:将对数生长期的DLD-1贴壁细胞以DMEM/F12培养基饥饿培养24 h后,消化、悬浮为单个细胞,计数3×104个/mL分别以G1、G2、G3组培养基种入培养瓶,初始体系为20 mL/瓶,于37 ℃、5% CO2的培养箱中培养10 d、20 d、30 d,每隔1 d加2 mL相应培养基,每隔7 d换液一次。分别在10 d、20 d、30 d时,进行后续实验。
1.2.3 流式细胞术检测CD44+、CD133+、CD44+CD133+的细胞表达:取5×105个单细胞,PBS漂洗2次,向其中加入Staining Buffer封闭液(pH为7.2的PBS,含2% FBS和0.4% BSA),4 ℃封闭l h,离心弃上清,加入25 μL Staining Buffer及相应的抗体各1.25 μL,4 ℃避光孵育30 min,再次离心弃上清液,以500 μL PBS悬浮,上机检测。
1.2.4 Real-time PCR检测:细胞成球后的第10 d、20 d、30 d的球细胞用氯仿萃取、无水乙醇沉淀后提取mRNA,再逆转录为cDNA。选用GAPDH作内参,用Takara试剂盒(具体用法按照商家说明),检测每个样品中基因的mRNA的表达量。具体操作步骤参考文献[14]。Real-time PCR上机检测条件:预热:95 ℃30 s;三步扩增依次为:95 ℃ 10 s、60 ℃ 10 s、72 ℃10 s;融合依次为:95 ℃ 10 s、65 ℃ 60 s、97 ℃ 1 s;冷却:50 ℃ 30 s。引物序列详见表1。
1.2.5 成球实验(sphere-forming assay):取成球后第10 d、20 d、30 d的球细胞各100个,用相应组的培养基1 mL,悬浮培养于24孔板,分别在培养后第15 d时记数球细胞个数,并行统计学分析。
1.3 统计学分析
应用SPSS 22.0软件进行统计分析,正态分布的计量资料采用(±s)表示,组内两两比较采用配对样本t检验,组间比较采用单因素方差分析,P<0.05认为差异有统计学意义。
2 结果
2.1 流式细胞术检测细胞球中CD44+、CD133+及CD44+CD133+双阳性的细胞表达比例
结合数据分析可知(见表2及图1),CD44+细胞比例以G2组20 d表达最高,差异有统计学意义(F=98.895,P<0.05);CD133+细胞比例以G3组10 d比例最高,G2组20 d次之,差异有统计学意义(F=147.641,P<0.05);CD44+CD133+双阳性的细胞比例以G2组20 d与G3组10 d表达较高,差异有统计学意义(F=13.321,P<0.05),G3组10 d与G2组20 d比较差异无统计学意义(t=0.871,P>0.05)。

表1 Real-time PCR引物序列
2.2 Real-time PCR检测球细胞中的干细胞基因KLF4、Nanog,上皮间质转化基因E-cadherin、Snail,Wnt/β-catenine通路基因Wnt-3a的mRNA表达情况
结果显示(表3),基因KLF4、Nanog、Snail、Wnt-3a均以G2组20 d表达最高,差异有统计学意义(F=2.424、7.694、2.951、3.771,均P<0.05),基因E-cadherin以G2组20 d表达最低(除G2组30 d、G1组10 d) (F=10.620,P<0.05)。
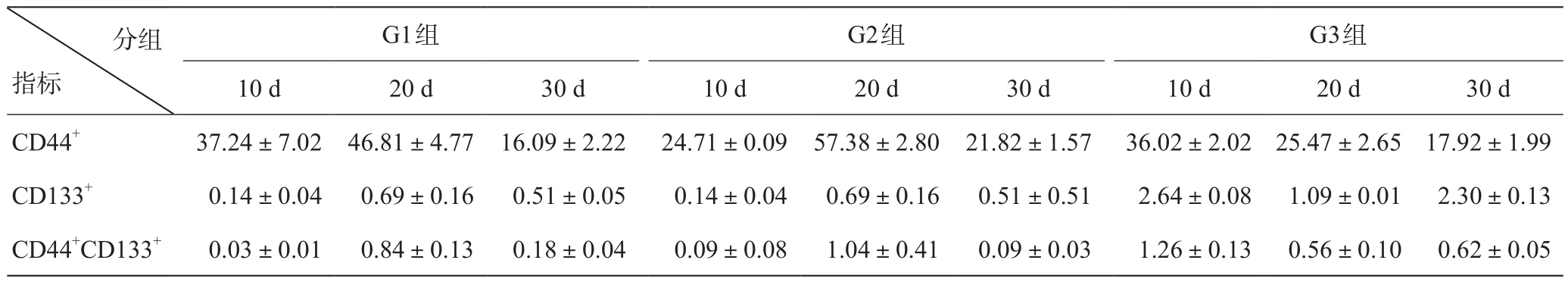
表2 流式细胞术检测肿瘤干细胞
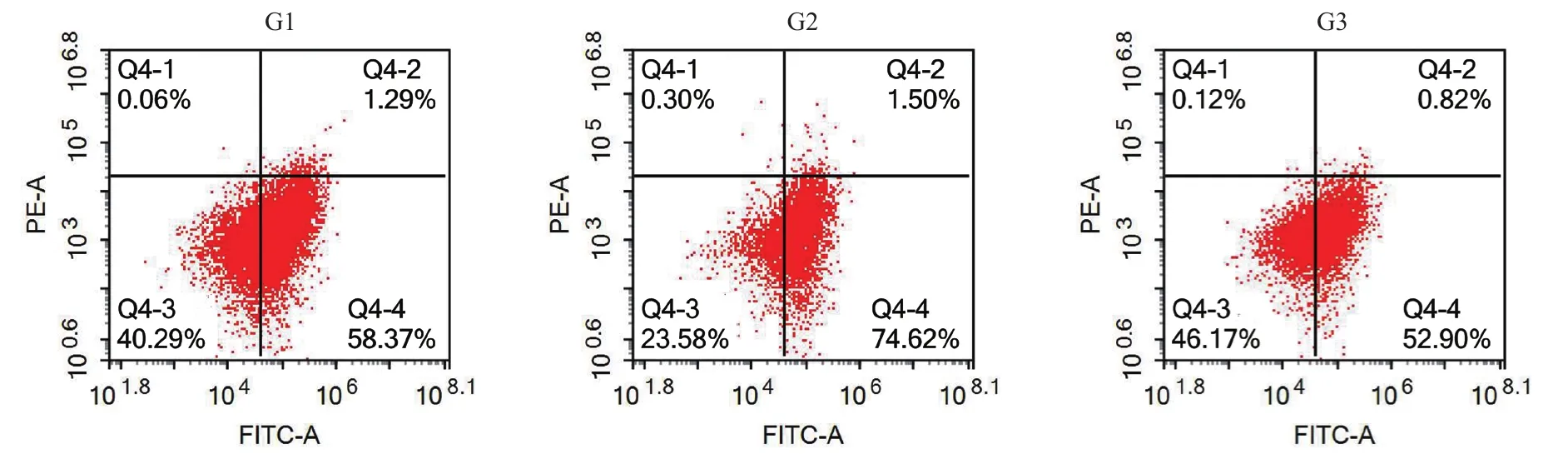
图1 细胞培养10 d后CD44+、CD133+及CD44+CD133+细胞比例
2.3 成球实验结果
G1组10 d、20 d、30 d,G2组10 d、20 d、30 d及G3组10 d、20 d、30 d成球数量分别为4.667±4.726、46.000±11.136、26.000±4.000,34.333±6.3501、41.333±8.505、18.667±2.309,18.333±3.786、15.333±5.860、15.333±4.509,各组比较G1组20 d和G2组20 d成球数量明显多于其他组,差异具有统计学意义(F=14.279,P<0.01),G1组20 d和G2组20 d比较,差异无统计学差异(t=0.605,P=0.578),见图2。

表3 Real-time PCR检测相关基因mRNA表达量

图2 三组细胞成球实验结果
3 讨论
肿瘤干细胞理论认为CSCs是导致肿瘤转移复发的根源细胞,科学家主要通过流式细胞分选、磁珠分选、无血清悬浮培养等方法来获取CSCs以展开研究。相较于其他方法,悬浮培养法具有操作简便、成本较低、获取效率较高及对细胞无机械损伤等优势[15]。普通肿瘤细胞在无血清悬浮培养中,不能贴壁而逐渐死亡,而CSCs则依赖于自我更新能力逐渐得到富集,bFGF在体外培养时浓度从1 ng/mL至50 ng/mL均有报道可促进干细胞自我更新,但不同浓度bFGF在富集CSCs的效能也不同,生长因子bFGF可以促使CSCs体外分裂增殖,利于体外扩增,但同时也会通过Wnt/β-catenine通路诱导肿瘤干细胞分化为肿瘤细胞[16-17]。所以,对bFGF的浓度的选择以及悬浮培养时间的研究显得非常重要。本研究以结直肠癌肿瘤细胞为研究模型,以期确定最优的CSCs富集方案,为后续针对结直肠癌肝转移相关机制的研究提供基础。
随着研究的深入,表面标记物CD133、CD44成为比较公认的结直肠癌肿瘤干细胞表面标识[15],因此本研究采用流式细胞术检测细胞球中的CD44+、CD133+及CD44+CD133+双阳性的细胞表达比例以反应CSCs富集情况,分析可知富集CD44+的细胞以G2组20 d方案最优,富集CD44+CD133+双阳性的细胞G2组20 d仅次于G3组10 d。CD44作为CSCs的标识之一,主要通过逆转录调控c-Myc、Twist1等基因,进而调控肿瘤细胞的增值、分化、凋亡等恶性生物学行为,CD133作为CSCs的标识之一,在结直肠癌细胞中表达时易受多种因素影响,多用于生存率分析、预测肿瘤预后、复发及耐药等方面[18-19]。本研究中表达CD44+的细胞比例明显高于CD133+及CD44+CD133+双阳性的细胞,G2组20 d富集CD44+的细胞能力明显高于其他组合方案,且富集CD44+CD133+双阳性的细胞能力仅次G3组10 d,表达CD133+细胞的比例并非G2组20 d最高,但CD133+的细胞比例在所有组数均较低(小于3%)。
Real-time PCR检测发现,各种基因mRNA均不同程度的高表达,但E-cadherin低表达。各组合方案比较,基因KLF4、Nanog、Snail、Wnt-3a均以G2组20 d表达最高,基因E-cadherin以G2组20 d表达最低(除G2组30 d、G1组10 d),这表明G2 20 d所富集到的球细胞具有最强的干细胞特性,并且具有间质细胞特征,通路Wnt/β-catenine也被激活。研究显示,肿瘤发生EMT可以激活肿瘤增殖、侵袭、转移、耐药等方面的重要通路[20],如TGF-β[21]、Wnt/β-catenine[22]通路等,从而增强细胞的各种恶性生物学行为。Lachej等[23]和Pashirzad等[24]认为Wnt/β-catenine通路是CSCs自我更新的一个关键调控位置,Wnt/β-catenine通路中的Wnt-3a不仅可以促进肿瘤的分化和迁移,而且还维持细胞的增殖能力。在我们的实验中,G2组20 d的方案同其余方案比较表现出了更强的间质细胞特征及Wnt/β-catenine通路的激活,结合其表达量分析G2组20 d方案的干细胞基因较其余组也相对高表达。
成球实验广泛用于检测细胞的自我更新能力变化,自我更新能力是CSCs能否得到富集的一个重要参考指标[25],本研究中,G2组20 d(除G1组20 d)的成球数量最多,表明G2组20d的方案可更大限度地促使CSCs的更新,且CSCs分化程度最低,可认为G2组20 d与G1组20 d为优势富集方案。
本研究结果显示,各组合方案均可富集得到CSCs,但各组之间存在着差异。在FCM结果中,G2组20 d富集CD133+及CD44+CD133+双阳性的细胞能力仅次G3组10 d,但是其余组细胞在富集CD44+细胞、干细胞相关基因、间质基因及Wnt-3amRNA表达量,以及成球能力方面明显低于G2组20 d。所以,在结直肠癌DLD-1悬浮培养富集CSCs的方案中,G2组培养方案悬浮培养20 d为最佳组合方案。目前国内外多采用上皮细胞生长因子和bFGF联合培养14 d左右的方法来富集CSCs,但是EGF或bFGF在此过程中的作用如何以及最佳培养时间等问题均未进行探讨;因此,本研究单独探讨不同浓度bFGF作用结直肠癌细胞不同时间在富集CSCs中的效果,以期为后续研究bFGF联合其他生长因子在富集CSCs中的作用提供前期基础。但本研究也存在只使用一种细胞且未对30 d以后的培养时间点进行研究,bFGF作用于其他细胞富集CSCs效率如何?培养超过30 d效率是否有改变等问题均需要更进一步深入探讨。
