PEG改性的聚丙烯酸酯膜控制口含烟烟碱体外释放的研究
2020-04-13简小朋张怡春王雨青李淼詹晓平史慧颖夭建华高茜
简小朋 张怡春 王雨青 李淼 詹晓平 史慧颖 夭建华 高茜

摘要 为了方便、高效地模拟口含烟烟碱的体内吸收行为,采用PEG改性的聚丙烯酸酯薄膜模拟人口腔黏膜,研究了聚合物薄膜控制口含烟烟碱的体外释放性能。结果表明,聚合物薄膜控制口含烟烟碱的体外释放符合零级释放方程,降低薄膜的厚度或增加薄膜中PEG的分子量,可以增大烟碱的渗透速率,DSC和SEM表征结果说明PEG和PAL互混后形成了均相的IPN-1D薄膜,接触角表征说明PEG增强了薄膜的亲水性,薄膜控制烟碱体外释放的渗透速率与烟碱的体内吸收速率值相近。因此,PEG改性的聚丙烯酸酯薄膜可用于口含烟烟碱的体外释放评价。
关键词 口含烟,口腔黏膜,烟碱,聚丙烯酸酯薄膜,体外释放
中图分类号 TS45文献标识码 A
文章编号 0517-6611(2020)06-0170-05
Abstract In order to simulate the in vivo absorption behavior of nicotine in snus,a PEGmodified polyacrylate film was used to simulate human oral mucosa,and the in vitro release of nicotine from the polymer film was studied.The results showed that the in vitro release behavior of nicotine from the polymer film accorded with a zeroorder release equation,the permeation rates of nicotine reduced with the increase of the thickness of the film or the molecular weight of PEG,DSC and SEM results indicated the IPN1D film mixing PEG and PAL was homogeneous,the contact angle characterization indicated that PEG enhanced the hydrophilicity of the film,the permeation rates of nicotine from the film were similar to the in vivo absorption rate of nicotine.Therefore,the PEGmodified polyacrylate film could be used for in vitro release evaluation of nicotine in snus.
Key words Snus,Oral mucosa,Nicotine,Polyacrylate film,In vitro release
口含烟是将磨碎的烟草颗粒经过加工后直接放在口腔中消费的一种无烟气烟草制品[1]。相比于传统卷烟,口含烟不发生燃烧和裂解,因此不产生燃烧产物和裂解产物,被认为对人体的危害性更小[2-7]。近年来,随着世界反吸烟运动的不断发展,口含烟作为烟草消费的补充形式日益受到关注,国内也已开展口含烟的各项研究工作[8-10],其中包括了评价口含烟效力的研究。由于人类吸食烟草制品行为的个体差异,烟草制品标示的烟碱量并不能准确反映人体摄入的烟碱量。若要准确评价口含烟的效力,需要监测烟碱的血药浓度和持续时间,但如果每批次的口含烟制品都要依赖体内试验获得这些数据,不仅操作繁琐,增加成本,还对实验人员和实验环境的要求较高。因此,使用体外释放试验的数据来预测烟碱的体内吸收,建立体外释放和体内吸收的相关性是评价口含烟效力更简单、更高效的方法。目前,研究口含烟体外释放的方法主要包括:①开发模拟口腔环境的新装置,比如中國专利CN109030398A的新装置是通过人工唾液淋洗口含烟收集待测组分,使用改良的药物溶出仪即时检测待测组分中的烟碱浓度[11],中国专利CN205352766U的新装置是将口含烟置于两层薄膜之间,薄膜内部导入的人工唾液浸润口含烟后,检测导出液中的烟碱浓度[12]。这些装置的作用都是在模拟口含烟在口腔中的溶出情况,但溶出的烟碱量并不能准确反映吸收的烟碱量,该方法无法评价口含烟的效力,②使用动物皮肤来模拟人口腔黏膜,比如口含烟烟碱渗透穿过猪口腔黏膜的体外透皮试验[13],但由于离体的动物皮肤易丧失生物活性,导致试验结果稳定性差,也无法准确评价口含烟的效力。笔者开发出一种既能复原人口腔黏膜的生物活性又具有稳定性能的材料,其可用于评价口含烟的体外释放行为,并且体外释放行为能用于模拟烟碱体内吸收,这对于口含烟的体外评价具有重要作用。
口含烟在使用时,由于口腔黏膜的上皮细胞被厚度为40~300 μm的黏液覆盖,黏液不仅快速溶解释放出口含烟中的烟碱,还将烟碱运载到黏膜的各个位置,其中部分的烟碱被直接吞咽,剩余的烟碱被口腔黏膜吸收进入体循环。口腔黏膜是烟碱吸收的主要屏障,烟碱在口腔的吸收是个被动扩散的过程,但同时口腔黏膜因其渗透性好,血流量丰富,被口腔黏膜吸收后的烟碱会快速进入体循环。因此开发的新材料应该具有以下的特点:亲水性好,能模拟水溶性烟碱在口腔黏膜上的快速分布,表面结构致密,能模拟口腔黏膜的屏障作用,对烟碱具有良好的渗透性能,能模拟烟碱被口腔黏膜吸收的过程。由于聚丙烯酸酯薄膜对小分子药物具有良好的渗透性能[14],笔者将对这类薄膜进行改性,使其能用于口含烟的体外释放评价。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂。口含烟(2017年产金鹿牌口含烟,上海新型烟草制品研究院有限公司),丙烯酸酯单体(Aldrich(USA)公司,分析纯),过氧化二苯甲酰(上海国药试剂有限公司),聚乙二醇(PEG,购自上海国药试剂有限公司),烟碱(98.54%,购自上海雅吉生物科技有限公司),磷酸氢二钠(国药集团化学试剂有限公司),三乙胺(上海凌峰化学试剂有限公司),磷酸(上海凌峰化学试剂有限公司),甲醇(上海百灵威化学技术有限公司)。
1.1.2 仪器。Waters高效液相色谱仪(美国Waters公司),RYJ-6B药物透皮扩散试验仪(上海黄海药检仪器有限公司),Valia-Chien扩散池(上海交通大学药学院制备,扩散面积0.785 cm2),紫外光固化仪(总功率3 000 W,北京埃士博机械电子设备中心),电子天平(梅勒特-托利多仪器(上海)有限公司)。
1.2 方法
1.2.1 口含烟体内吸收的评价标准的建立。
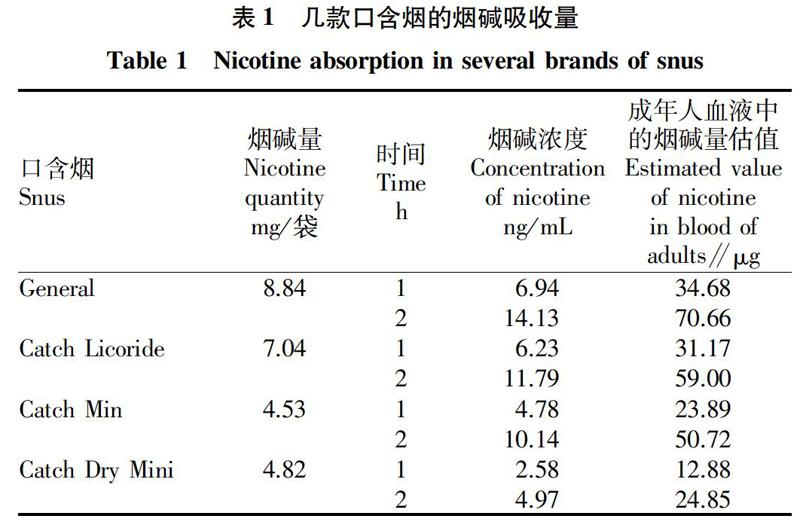
由于该研究中使用的这款国产口含烟还未有血药浓度方面的数据,参考了国外几款口含烟的药时曲线数据[15],对烟碱在第一个半衰期内(小于2 h)的药时曲线数据用Origin Lab软件进行数据分析,并对曲线进行调零(即0 h时的血药浓度值为零),得到表1中的浓度栏的数据。根据正常人的血液总量约相当于体重的7%~8%,成年男性体重约70 kg,估算出一个成年人的血液量约5 L。文献报道试验时每次采血5 mL,可以估算出血液中的烟碱量,结果见表1。
1.2.2 聚合物薄膜的制备。链状丙烯酸酯聚合物(PAL)的合成方法参考文献[14],将2-丙烯酸-2-羟基-3-苯氧基丙酯、4-羟基丁基丙烯酸酯、马来酸二乙酯按照质量比4∶4∶2混合,再加入3%(m/m)过氧化二苯甲酰(BPO),搅拌至BPO完全溶解,得到单体溶液。取适量单体溶液置于不锈钢模具内,进行紫外光固化反应,全功率3 kW,反应时间4 min,得到链状丙烯酸酯聚合物(PAL)。
为了增强薄膜的亲水性,用PEG来改性PAL薄膜,1D链状聚丙烯酸酯/PEG互穿聚合物(IPN-1D)的合成方法:将2-丙烯酸-2-羟基-3-苯氧基丙酯、4-羟基丁基丙烯酸酯、马来酸二乙酯按照质量比4∶4∶2混合,再加入3%(m/m)过氧化二苯甲酰(BPO),搅拌至BPO完全溶解,得单体溶液A,将不同分子量的PEG混合,如果PEG是固体,则加热助溶,得PEG溶液B,将单体溶液A与PEG溶液B按质量比9∶1混合,得到混合物溶液C,取适量混合物溶液C置于不锈钢模具内,进行紫外光固化反应,全功率3 kW,反应时间4 min,得1D链状聚丙烯酸酯/PEG互穿聚合物(IPN-1D)。
1.2.3 聚合物薄膜的表征。
(1)FTIR表征。仪器Thermo,NICOLET iS10(美国)。聚合物薄膜冷冻干燥,厚度控制在20 μm以下,采用ATR法直接扫描薄膜,扫描波数700~4 000 cm-1,分辨率1 cm-1。
(2)DSC表征。仪器PerkinElmer,DSC8500差示扫描量热仪(美国)。氮气保护,以10 ℃/min的速度从-60 ℃升温到120 ℃,2次加热升温。
(3)SEM表征。仪器FEI/Philips,Sirion 200高分辨场发射扫描电子显微镜SEM(美国)。薄膜表面需喷金后进行检测。
(4)接触角(θ)表征。仪器Biolin Scientific,ThetaLite 101(瑞典)。在聚合物薄膜表面滴10 μL水滴,测量左接触角和右接触角,取平均值。
1.2.4 聚合物薄膜控制口含烟中烟碱的体外释放的研究。
磷酸缓冲液的配制:取85 mL 0.33 mol/L的Na2HPO4·12H2O水溶液,15 mL 0.33 mol/L的KH2PO4水溶液,混匀即得0.33 mol/L磷酸缓冲液,pH为7.5,取0.33 mol/L磷酸缓冲液 100 mL,加入0.9%NaCl溶液2 900 mL,混匀即得0.01 mol/ L的磷酸盐缓冲液(PBS,pH 7.4)[9]。
将聚合物薄膜固定在Valia-Chien水平扩散池之间,Valia-Chien水平扩散池的示意图见参考文献[16]。扩散试验参数设置如下:水浴温度37 ℃,攪拌速度200 r/min。供给池内放置1袋口含烟样品,供给液和接收液均为10 mL的磷酸缓冲液。分别在1、2、3、4、5、6、7、8 h取1 mL样品,同时补充等量磷酸缓冲液。每组平行试验3次,样品检测参考文献报道的HPLC方法[13]。
1.2.5 数据处理。单位面积的薄膜上烟碱释放量(Q)的计算公式:
式中,V为接受池体积(mL),Vi为每次取样体积(mL),Cn和Ci分别为第n次和第i次取样时接受液的浓度(μg/mL),A为扩散面积(cm2)。
渗透速率(J):将累积释放量Q对时间(t)的曲线图,用直线进行拟合,拟合得到的直线斜率即为渗透速率(J),单位为μg/(cm2·h)。
1.2.6 口含烟中烟碱体外释放的数学模型。采用Origin Pro 2016 软件对体外渗透试验数据分别进行零级、一级、Higuchi方程拟合。
2 结果与分析
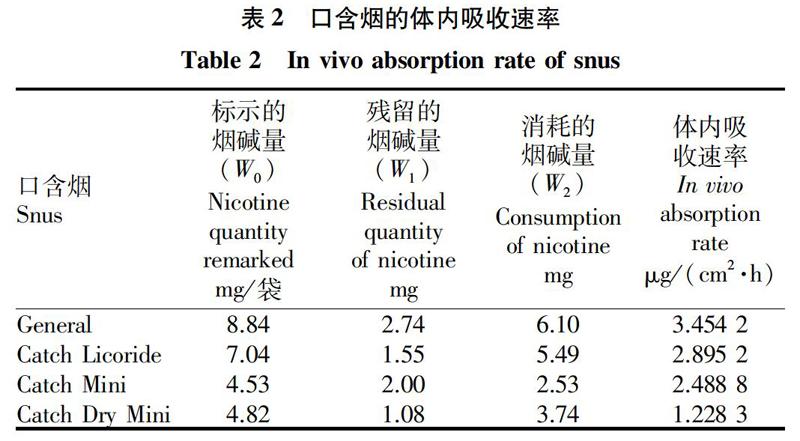
2.1 口含烟中烟碱体内吸收速率
使用口含烟时,每袋口含烟标示的烟碱量(W0)减去使用后残留在口含烟中的烟碱量(W1),可以得到消耗的烟碱量(W2),即W2=W0-W1。在消耗的烟碱量(W2)中,部分烟碱随唾液被吞咽后在胃肠道中被快速清除,其余烟碱被人口腔黏膜吸收后进入体循环。以10.19 cm2的人上唇面积[17],估算表1中的数据得到烟碱透过单位面积的口腔黏膜的速率从1.22 μg/(cm2·h)至3.45 μg/(cm2·h)不等(表2)。表2还表明,烟碱体内吸收速率与口含烟中烟碱标示量(W0)和消耗的烟碱量(W2)均不存在正相关,这也从侧面说明用标示量(W0)和消耗量(W2)不能预测体内吸收情况。目前已开发的几款模拟口腔环境的新装置[11-12]检测的就是烟碱消耗量(W2),并不能真实反映口含烟烟碱的体内吸收。
2.2 聚合物薄膜控制口含烟中烟碱的体外释放的研究
2.2.1 PAL薄膜控制口含烟中烟碱的体外释放。
考察了厚度为30和40 μm的PAL薄膜控制口含烟中烟碱的体外释放的行为(表3),分别用零级、一级和Higuchi方程来拟合体外释放结果,拟合时以相关系数(r)最接近1为最好拟合结果。通过比较各拟合方程的相关系数可看出,零级方程较好地拟合了PAL薄膜控制烟碱的体外释放行为(表4)。试验发现,当PAL薄膜的厚度从40 μm降至30 μm时,渗透速率从1.363 9 μg/(cm2·h)增至2.033 4 μg/(cm2·h),此结果与文献报道[15]的结果相一致,即降低了薄膜厚度,可以增大渗透速率。
2.2.2 IPN-1D薄膜控制口含烟中烟碱的体外释放。
分别考察了PEG200、PEG600、PEG4000与PAL组成的1D链状聚丙烯酸酯/PEG互穿聚合物(IPN-1D)薄膜控制口含烟中烟碱的体外释放行为(表5),并用零级、一级和Higuchi方程来拟合体外释放结果(表6)。试验发现,虽然Higuchi方程对IPN-1D∶PEG600(膜厚30 μm)组呈现出更好的拟合效果,但其对IPN-1D∶PEG4000(膜厚30 μm)组的拟合效果较差,一级方程无法对IPN-1D∶PEG200(膜厚40 μm)组进行拟合,零级方程对三组薄膜拟合的r大于0.95,说明零级方程能较好地拟合IPN-1D薄膜控制烟碱体外释放的行为。
PAL(膜厚40 μm)对烟碱的渗透速率为1.363 9 μg/(cm2·h),当PAL中加入PEG200后,得到的IPN-1D∶PEG200(膜厚40 μm)的渗透速率为1.598 μg/(cm2·h)。该结果表明PEG可以增大薄膜的渗透速率。此外,随着PEG质量分数的增加,薄膜的渗透速率增大,比如PAL(膜厚30 μm)、IPN-1D∶PEG600(膜厚30 μm),IPN-1D∶PEG4000(膜厚30 μm)的渗透速率分别是2.033 4、2.854 6和5.150 7 μg/(cm2·h)。
2.3 人工生物膜的表征
2.3.1 FTIR表征。比较IPN-1D∶PEG200、IPN-1D∶PEG600、IPN-1D∶PEG4000 3种薄膜的FTIR数据(图1),发现这3种薄膜的FTIR数据非常相似,这是因为4种薄膜的单体成分一样,区别在于聚乙二醇的聚合度不同,因此FTIR的特征吸收峰相同。以IPN-1D∶PEG200薄膜为例,进行FTIR吸收峰的归属:3 100~3 600 cm-1 (νOH),2 936 cm-1 (νCH),1 599,1 495和1 448 cm-1 (νC=C,aromatic ring),755 cm-1 (δCH,aromatic ring),1 724 cm-1 (νC=O),1 160和1 241 cm-1 (νC-O-C ),1 041 cm-1 (νC-OH)。
2.3.2 DSC表征。IPN-1D∶PEG200、IPN-1D∶PEG600、IPN-1D∶PEG4000薄膜的玻璃化转变温度(Tg)依次为-6.9、-10.2和-13.4 ℃(图2)。在每种IPN-1D薄膜中仅观察到一个Tg值,说明IPN-1D是均相体系。结合Zhan等[14]报道的PAL的Tg值为8.819 ℃,发现随着PEG分子质量的增加,薄膜的玻璃化转变温度降低,聚合物的分子链越柔软,因此烟碱分子越易渗透穿过薄膜,这与渗透速率的结果一致。
2.3.3 SEM表征。
IPN-1D∶PEG200薄膜在2万倍、40万倍和80万倍下均未观察到纳米级孔洞(图3),说明IPN-1D薄膜具有致密的表面结构,也从侧面说明PEG与PAL形成了均相结构。
2.3.4 接触角(θ)。
聚丙烯酸酯薄膜的接触角均小于90°,说明这些薄膜表面都具有良好的亲水性,而且PEG能有效改善PAL薄膜的亲水性能。
3 结论与讨论
聚丙烯酸酯薄膜控制烟碱体外释放的速率会随着薄膜厚度和PEG的不同而表现不同,比如PAL薄膜,厚度从40 μm到30 μm时,烟碱体外释放速率从1.36 μg/(cm2·h)到2.03 μg/(cm2·h)不等。經PEG改性后的PAL薄膜又表现出不同的控释性能,比如厚度40 μm的 IPN-1D∶200薄膜对烟碱的体外释放速率为1.60 μg/(cm2·h),厚度30 μm的IPN-1D∶4000薄膜对烟碱的体外释放速率为5.15 μg/(cm2·h)。
该研究参考的国外几款口含烟烟碱的体内吸收速率为1.22~3.45 μg/(cm2·h)。该研究中开发的几款聚合物薄膜对口含烟烟碱的体外释放速率的范围已基本覆盖了体内吸收速率的范围。在今后的研究中,通过对这款国产口含烟的血液浓度的监测,得到其体内吸收速率,通过调节聚丙烯酸酯膜的成分和厚度等参数,得到与体内吸收速率相匹配的体外释放速率,再用筛选出的聚合物薄膜进行口含烟的质量控制和新配方的开发。这不仅会提高体内和体外的相关性,而且会提高口含烟新工艺开发的效率。
目前已开发的模拟口腔的装置[11-12]检测的只是口含烟中烟碱的消耗量,不能代表烟碱体内吸收的情况。而使用猪口腔黏膜模拟口含烟烟碱的体外吸收时,烟碱的体外渗透速率高达85.88 μg/(cm2·h)[13],远高于烟碱的体内吸收速率值。因此,用PEG改性后的PAL聚丙烯酸酯薄膜来模拟人口腔黏膜,提供了一种更接近口含烟烟碱体内吸收情况的体外评价方法。
参考文献
[1] LAWLER T S,STANFILL S B,ZHANG L Q,et al.Chemical characterization of domestic oral tobacco products:Total nicotine,pH,unprotonated nicotine and tobaccospecific Nnitrosamines[J].Food and chemical toxicology,2013,57:380-386.
[2] KLUS H,KUNZE M,KNIG S,et al.Smokeless tobacco—An overview[J].Contributions to tobacco research,2009,23(5):248-276.
[3] BALLIN S D.Tobacco,nicotine,and alternative product regulation in the 21st century[C]//American Association for the Advancement of Science 2012 Annual Meeting.Vancouve:AAAS,2012.
[4] DRAKE L,BETSON T R,RICHTER A,et al.2009 collaborative study report[R].Edinburgh:CORESTA,2010:180-186.
[5] BATES C,FAGERSTRM K,JARVIS M J,et al.European Union policy on smokeless tobacco:A statement in favour of evidence based regulation for public health[J].Tobacco control,2003,12(4):360-367.
[6] BROADSTOCK M.Systematic review of the health effects of modified smokeless tobacco products[R].Christchurch:New Zealand Health Technology Assessment,2007:261-267.
[7] 谢剑平,宗永立,钱发成,等.袋装口含烟草制品及其制备方法:CN 200810049347.X[P].2008-09-03.
[8] 张建勋,宗永立,孙世豪,等.一种口含型烟草制品:CN200810050106.7[P].2008-10-29.
[9] 张建勋,屈展,郭学科,等.含有烟草成分的硬质糖:CN200810049285.2[P].2008-08-06.
[10] DJORDJEVIC M V,HOFFMANN D,GLYNN T,et al.US commercial brands of moist snuff,1994.I.Assessment of nicotine,moisture,and pH[J].Tobacco control,1995,4(1):62-66.
[11] 李鹏,王丁众,孙世豪,等.一种口含烟烟碱释放行为检测方法及其专用测试仪器:CN201810987568.5[P].2018-12-18.
[12] 张怡春,王申,郑赛晶,等.用于口含烟溶出物采集的模拟口腔装置:CN201521136441.0[P].2016-06-29.
[13] 艾明欢,陈超英,郑赛晶,等.基于猪口腔黏膜模型的口含烟烟碱渗透速率的影响因素[J].烟草科技,2017(6):33-39.
[14] ZHAN X P,CHEN S J,TANG G C,et al.A new poly (2-hydroxy-3-phenoxypropylacrylate,4 -hydroxybutyl acrylate,diethyl maleate) membrane controlled clonidine linear release in the transdermal drug delivery system[J].Eur Polym J,2007,43:1588-1594.
[15] LUNELL E,LUNELL M.Steady-state nicotine plasma levels following use of four different types of Swedish snus compared with 2-mg Nicorette chewing gum:A crossover study[J].Nicotine & tobacco research,2005,7(3):397-403.
[16] 田璐,張蜀,林华庆,等.经皮给药制剂体外透皮扩散试验方法的研究进展[J].中国药房,2012(29):2761-2764.
[17] 王继华,左大松,吴汉云.50例正常成人口腔黏膜面积测量报告[J].临床口腔医学杂志,1985(2):68-69.
